|
|
|
| (1 промежуточная версия не показана) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Ізотопи (стабільні та радіоактивні)''' <metakeywords>Хімія, клас, урок, на Тему, Ізотопи, стабільні та радіоактивні</metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>> Ізотопи (стабільні та радіоактивні)''' <metakeywords>Хімія, клас, урок, на Тему, Ізотопи, стабільні та радіоактивні</metakeywords> <br> |
| | + | |
| | <br> | | <br> |
| - | Тут буде текст
| + | |
| | + | Якщо нукліди належать одному й тому самому [[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|хімічному елементу]] і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце). |
| | + | |
| | + | '''''[[Склад_ядра_атома._Ізотопи._Ядерні_сили._Енергія_зв’язку_атомних_ядер|Ізотопи]]''''' — це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).<br>Позначення нуклідів [[Оксиген._Кисень,_склад_його_молекули,_фізичні_властивості|Оксигену]]:<br>Оксиген-16, Оксиген-17, Оксиген-18 або <sup>16</sup>О, <sup>17</sup>О,<sup>18</sup>О |
| | + | |
| | + | Зверни увагу, термін «ізотопи» вживається лише у множині (застаріле «ізотоп» і є нуклід). Наприклад, природний Оксиген, крім нуклідів <sup>16</sup>О, містить ще атоми з нуклонними числами 17 і 18. Це означає, що в природному Оксигені є різні види атомів, які в ядрі містять однакову кількість протонів (по 8), але різну кількість нейтронів (відповідно 8, 9, 10). Саме тому вони й різняться між собою атомною масою. Зазначені нукліди <sup>16</sup>О, <sup>17</sup>О,<sup>18</sup>О і є ізотопами Оксигену.<br>Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів — Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 13).<br><br>''Таблиця 13. Ізотопи Гідрогену й Карбону''<br>[[Image:Таблиця 13. Ізотопи Гідрогену й Карбону.jpg|Ізотопи Гідрогену й Карбону. фото]]<br><br>Відкриття ізотопів дало змогу поглибити знання про хімічний елемент як вид [[Атоми_і_хімічні_елементи._Перевір_себе|атомів]], що характеризується однаковим протонним числом (зарядом ядра).<br>Звичайно в природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атомна маса таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі. Наприклад, елемент Оксиген являє собою суміш ізотопів — нуклідів <sup>16</sup>О 99,757 %, <sup>17</sup>О 0,039 % і <sup>18</sup>О 0,204 %. Аби знайти відносну атомну масу Оксигену, треба:<br> |
| | + | |
| | + | [[Image:Атомна маса нукліду .jpg|формула. фото]]<br> <br>Заокруглюємо знайдене середнє значення, виходить А<sub>r</sub>(0) = 16.<br>[[Атомна_одиниця_маси._Відносна_атомна_маса_хімічних_елементів|Відносна атомна маса]] елемента в періодичній системі — це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі<br>Саме тому, що майже всі елементи — це суміші нуклідів, їх відносні атомні маси не цілочислові, а дробові.<br>Але ти можеш заперечити, чому ж тоді відносна атомна маса таких елементів як Натрій, Алюміній, Фосфор, Флуор, які не мають ізотопів, не є цілочисловою, а лише наближається до неї? Це пояснюється тим, що Карбон, який береться за точку відліку атомних мас інших елементів, сам складається з двох природних ізотопів <sup>12</sup>С і <sup>13</sup>С, а для визначення відносної атомної маси береться один із природних ізотопів, саме <sup>12</sup>С, або Карбон-12.<br>Оскільки ізотопи певного елемента мають однакове протонне число (заряд ядра), а отже, й однакове число електронів, які однаково розміщені за енергетичними рівнями, то їх хімічні властивості також практично однакові. Тому можна говорити про хімічні властивості, наприклад Хлору, не беручи до уваги його ізотопний склад. [[Image:Ізотопи стабільні і радіоактивні .jpg|Ізотопи. фото]] |
| | + | |
| | + | ''Мал. 14. Ізотопи.''<br> Ізотопи (окремі нукліди) поділяють на стабільні і радіоактивні (радіонукліди). Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом (зарядом ядра) < 83. Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту, радіоактивні. |
| | | | |
| | <br> | | <br> |
| - | <sub>Матеріали з хімії, завдання школяру, програма з хімії за 8 клас</sub> | + | |
| - | <br> | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту'' |
| | + | |
| | + | <br> <sub>[[Хімія|Матеріали]] з хімії, [[Гіпермаркет Знань - перший в світі!|завдання]] школяру, програма з хімії за 8 клас</sub> <br> |
| | + | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 05:40, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>> Ізотопи (стабільні та радіоактивні)
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце).
Ізотопи — це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).
Позначення нуклідів Оксигену:
Оксиген-16, Оксиген-17, Оксиген-18 або 16О, 17О,18О
Зверни увагу, термін «ізотопи» вживається лише у множині (застаріле «ізотоп» і є нуклід). Наприклад, природний Оксиген, крім нуклідів 16О, містить ще атоми з нуклонними числами 17 і 18. Це означає, що в природному Оксигені є різні види атомів, які в ядрі містять однакову кількість протонів (по 8), але різну кількість нейтронів (відповідно 8, 9, 10). Саме тому вони й різняться між собою атомною масою. Зазначені нукліди 16О, 17О,18О і є ізотопами Оксигену.
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів — Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 13).
Таблиця 13. Ізотопи Гідрогену й Карбону
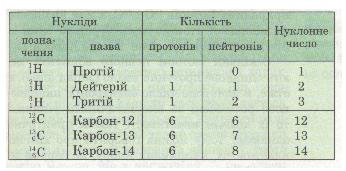
Відкриття ізотопів дало змогу поглибити знання про хімічний елемент як вид атомів, що характеризується однаковим протонним числом (зарядом ядра).
Звичайно в природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атомна маса таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі. Наприклад, елемент Оксиген являє собою суміш ізотопів — нуклідів 16О 99,757 %, 17О 0,039 % і 18О 0,204 %. Аби знайти відносну атомну масу Оксигену, треба:

Заокруглюємо знайдене середнє значення, виходить Аr(0) = 16.
Відносна атомна маса елемента в періодичній системі — це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі
Саме тому, що майже всі елементи — це суміші нуклідів, їх відносні атомні маси не цілочислові, а дробові.
Але ти можеш заперечити, чому ж тоді відносна атомна маса таких елементів як Натрій, Алюміній, Фосфор, Флуор, які не мають ізотопів, не є цілочисловою, а лише наближається до неї? Це пояснюється тим, що Карбон, який береться за точку відліку атомних мас інших елементів, сам складається з двох природних ізотопів 12С і 13С, а для визначення відносної атомної маси береться один із природних ізотопів, саме 12С, або Карбон-12.
Оскільки ізотопи певного елемента мають однакове протонне число (заряд ядра), а отже, й однакове число електронів, які однаково розміщені за енергетичними рівнями, то їх хімічні властивості також практично однакові. Тому можна говорити про хімічні властивості, наприклад Хлору, не беручи до уваги його ізотопний склад. 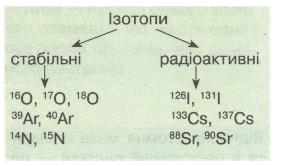
Мал. 14. Ізотопи.
Ізотопи (окремі нукліди) поділяють на стабільні і радіоактивні (радіонукліди). Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом (зарядом ядра) < 83. Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту, радіоактивні.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Матеріали з хімії, завдання школяру, програма з хімії за 8 клас
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












