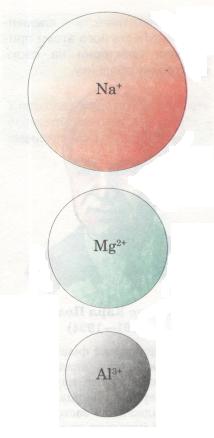|
|
|
| (4 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Структура періодичної системи. Поняття про радіус атома''' <metakeywords>Хімія, клас, урок, на Тему, Структура періодичної системи, Поняття про радіус атома</metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Структура періодичної системи. Поняття про радіус атома''' <metakeywords>Хімія, клас, урок, на Тему, Структура періодичної системи, Поняття про радіус атома</metakeywords> <br><br> |
| | + | |
| | <br> | | <br> |
| - | Тут буде текст
| + | |
| | + | '''СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ'''<br> |
| | | | |
| | <br> | | <br> |
| - | <sub>Підручник з хімії для 8 класу, хімія в школі, підручники та книги безкоштовно</sub> | + | |
| | + | Існує понад 500 різних видів зображення [[41._Періодичний_закон_та_періодична_система_хімічних_елементів_Д._І._Менделєєва|періодичної системи]] — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ти вже знаєш. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений [[52._Значення_періодичного_закону._Життя_і_наукова_дiяльність_Д._І._Менделєєва|Д. І. Менделєєвим]].<br>Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності.<br>У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів забудовується зовнішній енергетичний рівень.<br>У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d-орбіталі передзовнішнього рівня.<br>Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій ззовні рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів. |
| | + | |
| | <br> | | <br> |
| | + | |
| | + | Яка ж структура короткої форми періодичної системи? Основними структурними одиницями є періоди і групи.<br> |
| | + | |
| | + | <br>'''''Період''''' — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх відносних атомних мас, що починається лужним металом і закінчується інертним газом.<br><br>''• Визнач за періодичною системою, які періоди є винятком з цього правила (чому?).''<br><br>Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів:<br>1- й період (малий) — 2 елементи;<br>2- й період (малий) — 8 елементів;<br>3- й період (малий) — 8 елементів;<br>4- й період (великий) — 18 елементів;<br>5- й період (великий) — 18 елементів;<br>6- й період (великий) — 32 елементи;<br>7- й період (великий) — досі ще не завершений, містить поки що 24 елементи.<br> |
| | + | |
| | + | [[Image:Група.jpg|Групи. фото]] |
| | + | |
| | + | ''Мал. 17. Групи.''<br>'''''Група''''' — це вертикальний стовпчик, в якому один під одним розміщені подібні за властивостями хімічні елементи.<br> |
| | + | |
| | + | Усього груп вісім. Кожна з них поділяється на дві підгрупи: А — головну, до складу якої входять елементи малих періодів (типові) і Б — побічну, яка складається тільки з елементів великих періодів, вони є неповними аналогами типових елементів і навіть можуть дуже відрізнятися від них за властивостями. Так, сьома група складається з головної підгрупи — Флуор, Хлор (типові елементи) та їх аналоги — Бром, Йод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган,<br>Технецій, Реній. Елементи головної підгрупи — активні неметали, а елементи побічної — метали.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | <br> |
| | + | |
| | + | '''ПОНЯТТЯ ПРО РАДІУС АТОМА'''<br> |
| | + | |
| | + | <br>Тобі вже відомо, що в періодах у міру зростання заряду [[Атом_і_атомне_ядро._Дослід_Резерфорда._Ядерна_модель_атома|ядра атомів]] елементів послідовно змінюється структура зовнішнього енергетичного рівня (кількість валентних електронів). Саме з цим пов'язана зміна властивостей елементів, тобто тих ознак, які становлять їх відмінну особливість. Такими ознаками можуть бути радіус атома, електронегативність, металічний або неметалічний характер елемента та його сполук тощо.<br>[[Image:Мал. 14. Порівняльний розмір йонів.jpg|Порівняльний розмір йонів. фото]]<br>''Мал. 18. Порівняльний розмір йонів''<br><br>'''Радіус атома.''' У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється — відбувається своєрідне «стискання» їх, і радіус атомів і йонів зменшується (мал. 14). Наприклад, у разі переходу від Літію до Неону заряд ядра поступово збільшується (від +3 до +10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періодів розміщуються елементи, в яких невелике число валентних електронів (на зовнішньому енергетичному рівні) і великий радіус атома. А в групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується. |
| | + | |
| | + | У періодах із зростанням протонного числа радіус атомів елементів зменшується, а в групах (головних підгрупах) — збільшується.<br>Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабкіше вони зв'язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для елементів-металів. |
| | + | |
| | + | ''• Схарактеризуй електронну будову атомів елементів, розміщених у періодичній системі на- І прикінці періодів, наприклад 2-го чи 3-го. До яких родин елементів вони мають належати?''<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | '''[[57._Поняття_про_електронегативність_елементів|Електронегативність]].''' Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.<br>Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).<br>Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд: |
| | + | |
| | + | F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs<br> |
| | + | |
| | + | [[Image:Лайнус Карл Полінг.jpg|Лайнус Карл Полінг. фото]] |
| | + | |
| | + | ''Мал. 19. Лайнус Карл Полінг.''<br>Лайнус Карл Полінг (1901—1994)<br>Американський [[Фізика_і_астрономія|фізик]] і [[Хімія|хімік]], громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)<br><br>Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.<br>Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі: |
| | + | |
| | + | '''''у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.'''''<br> |
| | + | |
| | + | <br>Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.<br>Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.<br>Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів. |
| | + | |
| | + | [[Image:Ряд 1.jpg|Елементи третього періоду. фото]] |
| | + | |
| | + | ''Мал. 20. Елементи третього періоду.''<br>В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються. |
| | + | |
| | + | Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію.<br>Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:<br> |
| | + | |
| | + | [[Image:Ряд 2.jpg|склад оксидів. фото]] |
| | + | |
| | + | <br>'''''Виконай лабораторні досліди.'''''<br>У дві пробірки налий розчини натрій гідроксиду і сульфатної кислоти, до кожної додай по 2 краплі метилоранжу. До першої пробірки додавай краплинами розчин кислоти, до другої — лугу. Що спостерігаєш? Чому? Напиши рівняння виконаних реакцій і зроби висновок про характер гідратів оксидів Na і S(VI).<br>У пробірку налий розчин алюміній хлориду і додавай краплинами розчин лугу до утворення драглистої маси. Вміст пробірки розділи на дві частини. До першої додай розчин кислоти, до другої — лугу. Що спостерігається? Який висновок про характер алюміній гідроксиду можна зробити?<br>Отже, так само можна простежити й зміну характеру гідратів оксидів, що відповідають вищій валентності елементів:<br>[[Image:Ряд 3.jpg|гідрати оксидів. фото]]<br><br>'''ВИСНОВКИ'''<br>Розміри атомів визначаються зарядом ядра і будовою електронної оболонки. Ось чому зміна радіусів атомів зі збільшенням протонного числа мас чітко виражений періодичний характер. У періодах радіус атомів поступово зменшується, а в головних підгрупах — збільшується.<br>Електронегативність характеризує здатність атома будь-якого елемента в хімічній сполуці притягувати електрони на свою електронну оболонку.<br>Властивості хімічних елементів, розміщених у порядку зростання заряду ядра, змінюються періодично: у межах періоду металічні властивості елементів поступово послаблюються, а неметалічні — посилюються; основні властивості оксидів і гідроксидів елементів поступово послаблюються, а кислотні — посилюються. У головних підгрупах елементів навпаки.<br>Властивості хімічних елементів періодично повторюються, оскільки періодично повторюється будова зовнішніх енергетичних рівнів у їх атомах.<br> |
| | + | |
| | + | <br>'''Завдання для самоконтролю'''<br>''1. Поясни причину періодичності в зміні властивостей хімічних елементів, розміщених у порядку зростання заряду ядра їх атомів.<br>2. Як пояснити з погляду теорії будови атома зміну властивостей елементів у періодах від металічних до неметалічних?<br>3. Як пояснити хімічну пасивність інертних газів?<br>4. Наведи приклади періодично повторюваних явищ, які відомі тобі в результаті вивчення інших предметів.<br>5. Хімічні елементи Н, О, F, S, Р розмісти у порядку зростання їх електронегатив-ності.<br>6. Зростання атомних радіусів спостерігається в ряду елементів<br>(а) Na, Mg, Al, Si; (в) О, S, Se, Те;<br>(б) C, N, О, R (г) l, Br, CI, F.<br>7. Максимальний радіус атома має елемент<br>(a) Be; (б) Mg; (в) Са; (г) Ra.<br>8. Найінтенсивніше реагуватимуть між собою<br>(а) Fe і Р; (в) Na і СІ<sub>2</sub>;<br>(б) Bi i Br<sub>2</sub>; (г) Аu і I<sub>2</sub>.<br>9. Серед наведених електронних конфігурацій атома Оксигену неправильною є''<br>[[Image:Електронні конфігурації атома Оксигену.jpg|Електронні конфігурації атома. фото]] |
| | + | |
| | + | ''Мал. 21. Електронні конфігурації атома.''<br>''10. Характеристики атомів елементів, що перебувають у періодичній залежності від заряду ядра, — це<br>(а) маса; (в) валентність;<br>(б) радіус; (г) металічні та неметалічні властивості.'' |
| | + | |
| | + | <br>'''Додаткові завдання'''<br>''11. Скільки завершених енергетичних рівнів міститься в атомах елементів з протонними числами: а) 5; б) 12; в) 18? Відповідь поясни.<br>12. Елементи розміщені у порядку зростання електронегативності в ряду<br>(а) F,CI,Br,l; (в) C, N, О, R<br>(б) Li, Na, К, Rb; (г) О, S, Se, Те.<br>13. Формула вищого оксиду елемента із величиною заряду ядра +24 — це'' |
| | + | |
| | + | ''(а) ЕО; (б) Е<sub>2</sub>О<sub>7</sub>; (в) ЕО<sub>3</sub>; (г) Е<sub>2</sub>О<sub>3</sub>.'' |
| | + | |
| | + | ''14. Формула гідрогенної сполуки елемента з протонним числом +32 — це'' |
| | + | |
| | + | ''(а) ЕН; (б) ЕН<sub>2</sub>; (в) ЕН<sub>3</sub>; (г) ЕН<sub>4</sub>.'' |
| | + | |
| | + | ''15*. Знаючи протонні числа елементів 8, 13, 18, але не користуючись періодичною системою, напиши електронні формули цих елементів і визнач їх хімічний характер.'' |
| | + | |
| | + | ''16*. Елемент зі скороченою електронною конфігурацією незбудженого стану атома ...3d<sup>1</sup>4s<sup>2</sup><br>(а) метал;<br>(б) розміщується у 3-му періоді;<br>(в) розміщується у головній підгрупі III групи;<br>(г) має валентність 3.'' |
| | + | |
| | + | ''17*. Кислотні властивості сполук, формули яких наведені нижче, зростають уряду<br>(а) N<sub>2</sub>О<sub>5</sub>, Р<sub>2</sub>О<sub>5</sub>, As<sub>2</sub>О<sub>5</sub>; (в) H<sub>2</sub>SeО<sub>3</sub>, H<sub>2</sub>SО<sub>3</sub>, H<sub>2</sub>SО<sub>4</sub>;<br>(б) HF, HBr, HI; (г) Al<sub>2</sub>О<sub>3</sub>, P<sub>2</sub>О<sub>5</sub>, Cl<sub>2</sub>О<sub>7</sub>.'' |
| | + | |
| | + | ''18*. Елемент із протонним числом 114 повинен мати хімічні властивості, подібні до властивостей<br>(а) Платини Pt; (в) Плюмбуму РЬ;<br>(б) Арсену As; (г) Меркурію Нg.''<br><br> |
| | + | |
| | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту''<br> |
| | + | |
| | + | <br> <sub>Підручник з хімії для [[Хімія 8 клас|8 класу]], хімія в школі, [[Гіпермаркет Знань - перший в світі!|підручники]] та книги безкоштовно</sub> <br> |
| | + | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 06:11, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Структура періодичної системи. Поняття про радіус атома
СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ
Існує понад 500 різних видів зображення періодичної системи — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ти вже знаєш. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений Д. І. Менделєєвим.
Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності.
У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів забудовується зовнішній енергетичний рівень.
У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d-орбіталі передзовнішнього рівня.
Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій ззовні рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.
Яка ж структура короткої форми періодичної системи? Основними структурними одиницями є періоди і групи.
Період — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх відносних атомних мас, що починається лужним металом і закінчується інертним газом.
• Визнач за періодичною системою, які періоди є винятком з цього правила (чому?).
Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів:
1- й період (малий) — 2 елементи;
2- й період (малий) — 8 елементів;
3- й період (малий) — 8 елементів;
4- й період (великий) — 18 елементів;
5- й період (великий) — 18 елементів;
6- й період (великий) — 32 елементи;
7- й період (великий) — досі ще не завершений, містить поки що 24 елементи.
Мал. 17. Групи.
Група — це вертикальний стовпчик, в якому один під одним розміщені подібні за властивостями хімічні елементи.
Усього груп вісім. Кожна з них поділяється на дві підгрупи: А — головну, до складу якої входять елементи малих періодів (типові) і Б — побічну, яка складається тільки з елементів великих періодів, вони є неповними аналогами типових елементів і навіть можуть дуже відрізнятися від них за властивостями. Так, сьома група складається з головної підгрупи — Флуор, Хлор (типові елементи) та їх аналоги — Бром, Йод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган,
Технецій, Реній. Елементи головної підгрупи — активні неметали, а елементи побічної — метали.
ПОНЯТТЯ ПРО РАДІУС АТОМА
Тобі вже відомо, що в періодах у міру зростання заряду ядра атомів елементів послідовно змінюється структура зовнішнього енергетичного рівня (кількість валентних електронів). Саме з цим пов'язана зміна властивостей елементів, тобто тих ознак, які становлять їх відмінну особливість. Такими ознаками можуть бути радіус атома, електронегативність, металічний або неметалічний характер елемента та його сполук тощо.
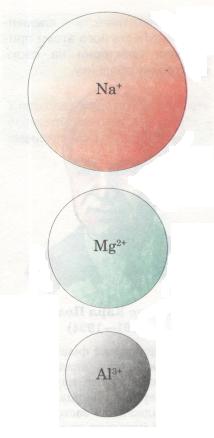
Мал. 18. Порівняльний розмір йонів
Радіус атома. У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється — відбувається своєрідне «стискання» їх, і радіус атомів і йонів зменшується (мал. 14). Наприклад, у разі переходу від Літію до Неону заряд ядра поступово збільшується (від +3 до +10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періодів розміщуються елементи, в яких невелике число валентних електронів (на зовнішньому енергетичному рівні) і великий радіус атома. А в групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується.
У періодах із зростанням протонного числа радіус атомів елементів зменшується, а в групах (головних підгрупах) — збільшується.
Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабкіше вони зв'язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для елементів-металів.
• Схарактеризуй електронну будову атомів елементів, розміщених у періодичній системі на- І прикінці періодів, наприклад 2-го чи 3-го. До яких родин елементів вони мають належати?
Електронегативність. Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.
Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).
Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд:
F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Мал. 19. Лайнус Карл Полінг.
Лайнус Карл Полінг (1901—1994)
Американський фізик і хімік, громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)
Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.
Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі:
у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.
Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.
Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.
Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів.
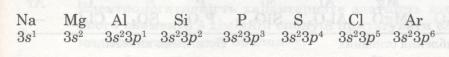
Мал. 20. Елементи третього періоду.
В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються.
Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію.
Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:
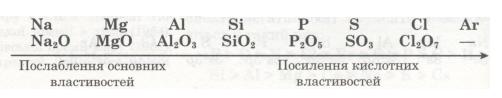
Виконай лабораторні досліди.
У дві пробірки налий розчини натрій гідроксиду і сульфатної кислоти, до кожної додай по 2 краплі метилоранжу. До першої пробірки додавай краплинами розчин кислоти, до другої — лугу. Що спостерігаєш? Чому? Напиши рівняння виконаних реакцій і зроби висновок про характер гідратів оксидів Na і S(VI).
У пробірку налий розчин алюміній хлориду і додавай краплинами розчин лугу до утворення драглистої маси. Вміст пробірки розділи на дві частини. До першої додай розчин кислоти, до другої — лугу. Що спостерігається? Який висновок про характер алюміній гідроксиду можна зробити?
Отже, так само можна простежити й зміну характеру гідратів оксидів, що відповідають вищій валентності елементів:

ВИСНОВКИ
Розміри атомів визначаються зарядом ядра і будовою електронної оболонки. Ось чому зміна радіусів атомів зі збільшенням протонного числа мас чітко виражений періодичний характер. У періодах радіус атомів поступово зменшується, а в головних підгрупах — збільшується.
Електронегативність характеризує здатність атома будь-якого елемента в хімічній сполуці притягувати електрони на свою електронну оболонку.
Властивості хімічних елементів, розміщених у порядку зростання заряду ядра, змінюються періодично: у межах періоду металічні властивості елементів поступово послаблюються, а неметалічні — посилюються; основні властивості оксидів і гідроксидів елементів поступово послаблюються, а кислотні — посилюються. У головних підгрупах елементів навпаки.
Властивості хімічних елементів періодично повторюються, оскільки періодично повторюється будова зовнішніх енергетичних рівнів у їх атомах.
Завдання для самоконтролю
1. Поясни причину періодичності в зміні властивостей хімічних елементів, розміщених у порядку зростання заряду ядра їх атомів.
2. Як пояснити з погляду теорії будови атома зміну властивостей елементів у періодах від металічних до неметалічних?
3. Як пояснити хімічну пасивність інертних газів?
4. Наведи приклади періодично повторюваних явищ, які відомі тобі в результаті вивчення інших предметів.
5. Хімічні елементи Н, О, F, S, Р розмісти у порядку зростання їх електронегатив-ності.
6. Зростання атомних радіусів спостерігається в ряду елементів
(а) Na, Mg, Al, Si; (в) О, S, Se, Те;
(б) C, N, О, R (г) l, Br, CI, F.
7. Максимальний радіус атома має елемент
(a) Be; (б) Mg; (в) Са; (г) Ra.
8. Найінтенсивніше реагуватимуть між собою
(а) Fe і Р; (в) Na і СІ2;
(б) Bi i Br2; (г) Аu і I2.
9. Серед наведених електронних конфігурацій атома Оксигену неправильною є
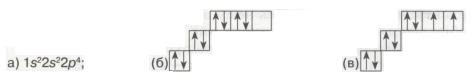
Мал. 21. Електронні конфігурації атома.
10. Характеристики атомів елементів, що перебувають у періодичній залежності від заряду ядра, — це
(а) маса; (в) валентність;
(б) радіус; (г) металічні та неметалічні властивості.
Додаткові завдання
11. Скільки завершених енергетичних рівнів міститься в атомах елементів з протонними числами: а) 5; б) 12; в) 18? Відповідь поясни.
12. Елементи розміщені у порядку зростання електронегативності в ряду
(а) F,CI,Br,l; (в) C, N, О, R
(б) Li, Na, К, Rb; (г) О, S, Se, Те.
13. Формула вищого оксиду елемента із величиною заряду ядра +24 — це
(а) ЕО; (б) Е2О7; (в) ЕО3; (г) Е2О3.
14. Формула гідрогенної сполуки елемента з протонним числом +32 — це
(а) ЕН; (б) ЕН2; (в) ЕН3; (г) ЕН4.
15*. Знаючи протонні числа елементів 8, 13, 18, але не користуючись періодичною системою, напиши електронні формули цих елементів і визнач їх хімічний характер.
16*. Елемент зі скороченою електронною конфігурацією незбудженого стану атома ...3d14s2
(а) метал;
(б) розміщується у 3-му періоді;
(в) розміщується у головній підгрупі III групи;
(г) має валентність 3.
17*. Кислотні властивості сполук, формули яких наведені нижче, зростають уряду
(а) N2О5, Р2О5, As2О5; (в) H2SeО3, H2SО3, H2SО4;
(б) HF, HBr, HI; (г) Al2О3, P2О5, Cl2О7.
18*. Елемент із протонним числом 114 повинен мати хімічні властивості, подібні до властивостей
(а) Платини Pt; (в) Плюмбуму РЬ;
(б) Арсену As; (г) Меркурію Нg.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Підручник з хімії для 8 класу, хімія в школі, підручники та книги безкоштовно
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|