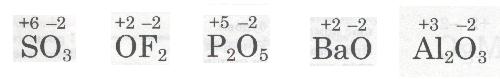|
|
|
| (4 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Ступінь окиснення''' <metakeywords>Хімія, клас, урок, на Тему, Ступінь окиснення</metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Ступінь окиснення''' <metakeywords>Хімія, клас, урок, на Тему, Ступінь окиснення</metakeywords> <br><br> |
| - | <br> | + | |
| - | Тут буде текст
| + | |
| | | | |
| | <br> | | <br> |
| - | <sub>Безкоштовні підручники по всім предметам безкоштовно, уроки хімії за 8 клас онлайн, конспекти уроків</sub> | + | |
| - | <br> | + | '''ВАЛЕНТНІСТЬ І СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТІВ'''<br><br><br>Пригадуєш, ми вивчали раніше поняття «[[Валентність_хімічних_елементів._Визначення_валентності_за_формулами_бінарних_сполук|валентність]]» і на його підставі складали формули різних сполук та їх назви за сучасною номенклатурою. І ти вже знаєш, що валентність — це здатність [[Атоми_і_хімічні_елементи._Перевір_себе|атома]] приєднувати або заміщувати певне число інших атомів або атомних груп з утворенням [[Хімічний_зв’язок_і_будова_речовин|хімічного зв'язку]]. А чому це так? Зрозуміти фізичний зміст валентності допомогла електронна теорія [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|будови атома]] і хімічного зв'язку. З розвитком цієї теорії змінилося і саме поняття валентності. У наш час валентність визначається числом ковалентних зв'язків, якими атом з'єднаний з іншими атомами.<br> |
| | + | |
| | + | А число зв'язків, які може утворювати атом, дорівнює числу його неспарених електронів, які йдуть на утворення спільних електронних пар. При цьому полярність утворених зв'язків не враховується, а тому валентність не має знака. Вона не може бути ні позитивною, ні негативною. Наприклад, у молекулах азоту N<sub>2</sub> та амоніаку NH<sub>3</sub> атом Нітрогену N тривалентний, оскільки він з'єднаний з N і з Н трьома спільними електронними парами (три зв'язки). Отже, валентність визначається тільки числом ковалентних зв'язків. Ось чому поняття «валентність» не можна застосовувати для сполук немолекулярної будови (з йонним, атомним, металічним зв'язками). Саме тому замість поняття «валентність» використовується поняття «ступінь окиснення».<br> |
| | + | |
| | + | <br>'''''[[Тема_25._Кристалічні_ґратки._Атомні,_молекулярні_та_йонні_кристали._Ступінь_окиснення._Складання_формули_сполуки|Ступінь окиснення]]''''' — це умовний заряд атома в речовині, який виник би на атомі за умови, що спільні електронні пари повністю змістилися б до більш електронегативного атома.<br> |
| | + | |
| | + | Ступінь окиснення, на відміну від валентності, може мати позитивне, негативне і нульове значення. Це значення зі знаком плюс чи мінус перед арабською цифрою зазначається над символом елемента або римською цифрою без знака у дужках після назви елемента. Наприклад:<br><sub>+1 -2 0</sub><br>Na, O, Н<sub>2</sub>,<br>де ступені окиснення Натрію +1, [[Оксиген._Кисень,_склад_його_молекули,_фізичні_властивості|Оксигену]] -2, Гідрогену 0; або Ферум(ІІІ), Купрум(ІІ), Нітроген(V) тощо.<br> |
| | + | |
| | + | Якщо сполука бінарна, то один із елементів має позитивний ступінь окиснення, а інший — негативний. Так, у більшості сполук Гідроген має ступінь окиснення +1, а Оксиген -2. Наприклад, у формулі води:<br><sub>+1 -2</sub><br>Н<sub>2</sub>O.<br><br>Але це зовсім не означає, що атоми елемента, наприклад Гідрогену, несуть на собі заряд +1, а атоми Оксигену -2. Це умовні числа, якими домовилися позначати ступінь окиснення.<br>А як дізнатися, який елемент у сполуці виявляє позитивний ступінь окиснення, а який — негативний?<br>З цією метою потрібно звернутися до ряду електронегативності хімічних елементів:<br><br>''' F О N CI Br S Р С Н Si Al Mg Са Na Cs'''<br><br>У бінарних сполуках хімічний елемент, що стоїть у цьому ряду лівіше, виявляє негативний ступінь окиснення, а той, що стоїть правіше, — позитивний. Так, у сполуці MgO хімічний елемент Магній мас позитивний ступінь окиснення +2, а Оксиген — негативний ступінь окиснення -2.<br> |
| | + | |
| | + | Позитивні значення ступенів окиснення мають ті атоми, які віддали свої електрони іншим атомам (зв'язувальна електронна хмара зміщена від них). Наприклад, атоми металів.<br> |
| | + | |
| | + | Негативні значення ступенів окиснення мають ті атоми, які приєднали електрони від інших атомів (зв'язувальна електронна хмара зміщена до них). <br> |
| | + | |
| | + | Негативне значення ступеня окиснення -1 завжди має Флуор у всіх сполуках.<br> |
| | + | |
| | + | Нульове значення ступенів окиснення мають атоми в простих речовинах, наприклад Сl<sub>2</sub>, N<sub>2</sub>, Н<sub>2</sub>, 0<sub>2</sub>, Br<sub>2</sub>, F<sub>2</sub>, оскільки у них зв'язувальна електронна пара не зміщена в жоден бік, а розміщена симетрично.<br><br>Під час обчислення ступенів окиснення слід пам'ятати, що:<br>1) алгебрична сума ступенів окиснення всіх атомів у сполуці має дорівнювати нулю, наприклад у ферум(ІІІ) хлориді FeCl<sub>3</sub> сума усіх ступенів окиснення дорівнює:<br>+3 + (-1) -3 = 0;<br>2) ступінь окиснення елементів у простих речовинах дорівнює нулю;<br>3) ступінь окиснення лужних металів завжди дорівнює +1;<br>4) ступінь окиснення Гідрогену в сполуках, як правило, дорівнює +1;<br>5) Флуор в усіх сполуках має ступінь окиснення -1;<br>6) ступінь окиснення Оксигену в сполуках, як правило, дорівнює -2.<br><br>Наприклад,<br><sub>+1 +6 -2 0 -3 +1 +1 +7 -2 + 1 -2</sub><br>H<sub>2</sub>SO<sub>4</sub>, N<sub>2</sub>, NH<sub>3</sub>, KMnO<sub>4</sub>, H<sub>2</sub>S |
| | + | |
| | + | Ступінь окиснення не слід ототожнювати з валентністю навіть у тому разі, коли їхні значення збігаються. Наприклад, у хлороводні НСl ступінь окиснення Гідрогену +1, Хлору -1 і валентність того й іншого елемента — 1. А в молекулі азоту N<sub>2</sub> (N=N) є три електронні пари між атомами Нітрогену, тому він тривалентний. Проте ступінь окиснення Нітрогену дорівнює нулю, оскільки спільні електронні пари розміщені симетрично й однаковою мірою належать обом атомам. Через це в усіх простих речовинах ступінь окиснення елементів дорівнює нулю. |
| | + | |
| | + | [[Image:Валентности.jpg|Ступінь окислення нуль. фото]] |
| | + | |
| | + | Періодична система елементів дає змогу за місцем того чи іншого елемента в ній дізнатися про ступінь його окиснення (табл. 15).<br><br>''Таблиця 15. Деякі значення ступенів окиснення елементів 3-го періоду періодичної системи''<br>[[Image:Таблиця 15. Деякі значення ступенів окиснення елементів 3-го періоду періодичної системи.jpg|Деякі значення ступенів окиснення елементів 3-го періоду періодичної системи. фото]]<br><br>Наприклад, для Сульфуру як елемента VI групи ступінь окиснення дорівнює +6, для Нітрогену, елемента V групи, +5, для Барію, елемента II групи, +2. На підставі теорії будови атома це легко пояснити. Адже зовнішній електронний шар атомів цих елементів містить відповідно 6, 5 і 2 валентні електрони. Під час взаємодії з більш електронегативним елементом, наприклад з Оксигеном, електрони зміщуються в бік Оксигену, а сполучені з ним елементи набувають ступеня окиснення відповідно +6, +5, +2. Прикладами можуть бути сполуки SО<sub>3</sub>, Р<sub>2</sub>О<sub>5</sub>, ВаО. |
| | + | |
| | + | Винятком є Флуор та Оксиген як найбільш електронегативні елементи (Флуор ніколи не виявляє позитивного ступеня окиснення, а Оксиген інколи виявляє, <br> <sub> +2 -1</sub> <br> тільки у сполуках з Флуором, наприклад флуорид оксигену OF<sub>2</sub>), а також деякі елементи VIII групи і підгрупи Купруму з І групи. <br> |
| | + | |
| | + | <br> Найвищий ступінь окиснення у сполуках з Оксигеном, що чисельно дорівнює номеру групи, виявляють елементи не лише головних підгруп, а й побічних, незважаючи на те, що на зовнішньому електронному шарі їхніх атомів найчастіше міститься 1—2 електрони незалежно від того, в якій групі вони перебувають. Наприклад, в оксиді мангану(VII) Мn<sub>2</sub>0<sub>7</sub> ступінь окиснення Мангану, елемента VII групи, дорівнює +7, хоча на зовнішньому електронному шарі атома Мангану містяться два електрони (ще 5 валентних електронів розміщені на передостанньому шарі). |
| | + | |
| | + | Поняття «ступінь окиснення», хоча й є формальним, широко використовується в хімії (особливо в неорганічній) під час класифікації хімічних процесів, складання хімічних рівнянь тощо.<br><br><br>'''Bисновки'''<br>З розвитком науки змінився зміст поняття «валентність». Воно має чіткий і однозначний сенс тільки для сполук молекулярної будови, де хімічні зв'язки — ковалентні, що здійснюються парою електронів.<br>Поняття «валентність» не можна застосовувати до атомів елементів, що входять до складу сполук немолекулярної будови.<br>У неорганічній хімії замість валентності використовується ступінь окиснення. Це поняття умовне, реального змісту воно не має.<br>Ступінь окиснення елемента можна визначати за періодичною системою хімічних елементів, у якій найвищий позитивний ступінь окиснення елемента чисельно дорівнює номеру групи, в якій розміщено елемент.<br>Про негативний ступінь окиснення елемента можна дізнатися, якщо від номера групи, де він розміщений, відняти 8.<br>Знання ступенів окиснення дає змогу складати формули бінарних сполук. У свою чергу, за формулами бінарних сполук можна обчислювати ступені окиснення елементів.<br><br><br>'''Завдання для самоконтролю'''<br>''1. Як ти розумієш зміст поняття «ступінь окиснення»? У чому виявляється його подібність і відмінність порівняно з поняттям «валентність»?<br>2. Визнач ступені окиснення атомів елементів у сполуках, формули яких:<br>(a) N<sub>2</sub>, NO<sub>2</sub>, NO, N<sub>2</sub>O<sub>5</sub>, N<sub>2</sub>O, N<sub>2</sub>O<sub>3</sub>; <br>(б) MnSO<sub>4</sub>, MnO<sub>2</sub>, Mn<sub>2</sub>O<sub>7</sub>, Mn<sub>2</sub>O<sub>3</sub>;<br>(в) As<sub>2</sub>O<sub>3</sub>, AsH<sub>3</sub>, H<sub>2</sub>, H<sub>2</sub>O;<br>(г) Cl<sub>2</sub>O<sub>7</sub>, Cl<sub>2</sub>, Cl<sub>2</sub>O, O<sub>2</sub>, Cl<sub>2</sub>O<sub>5</sub>, Cl<sub>2</sub>O<sub>3</sub>.'' |
| | + | |
| | + | ''3. Визнач ступені окиснення атомів елементів у сполуках, формули яких:<br>(а) H<sub>2</sub>SO<sub>4</sub>, SO<sub>2</sub>, SO<sub>3</sub>, H<sub>2</sub>SO<sub>3</sub>, MgSO<sub>4</sub>;<br>(б) HClO<sub>4</sub>, HPO<sub>3</sub>, Ba(NO<sub>3</sub>)<sub>2</sub>, Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>, P<sub>2</sub>O<sub>5</sub>;<br>(в) Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub>, AI(NO<sub>3</sub>)<sub>3</sub>, K<sub>2</sub>SO<sub>3</sub>, Na<sub>2</sub>SO<sub>4</sub>.<br>4. У молекулі білого фосфору Р<sup>4</sup> валентність і ступінь окиснення атома Фосфору дорівнюють відповідно<br>(а)1 і +3; (б)3 і +3; (в) 3 і 0; (г) 2 і 0.<br>5. Атоми Нітрогену мають однаковий ступінь окиснення в сполуках, формули яких<br>(a) HNO<sub>3</sub>; (б) Ca<sub>3</sub>N<sub>2</sub>; (в) NH<sub>4</sub>Cl; (г) N<sub>2</sub>O<sub>3</sub>.''<br><br> |
| | + | |
| | + | '''Додаткові завдання'''<br>''6. Найменший ступінь окиснення атомів Сульфуру має речовина, формула якої<br>(a) H<sub>2</sub>SO<sub>4</sub>; (б) Na<sub>2</sub>SO<sub>3</sub>; (в) SO<sub>3</sub>; (г) Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>.<br>7*. Ступінь окиснення атома Фосфору в йоні НР0<sub>4</sub><sup>2-</sup> дорівнює<br>(а) + 5; (б) + 3; (в) 0; (г) - 5.<br>8*. Передбач мінімальний і максимальний ступені окиснення Селену. <br>9*. Визнач ступені окиснення атомів елементів у таких сполуках: O<sub>2</sub>, Н<sub>2</sub>O, Н<sub>2</sub>O<sub>2</sub>, OF<sub>2</sub>, Н<sub>2</sub>, ВаН<sub>2</sub>, NaH, H<sub>2</sub>S.''<br><br> |
| | + | |
| | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту''<br> |
| | + | |
| | + | <br> <sub>Безкоштовні [[Гіпермаркет Знань - перший в світі!|підручники]] по всім предметам, уроки хімії за 8 клас [[Хімія 8 клас|онлайн]], конспекти уроків</sub> <br> |
| | + | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 08:43, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Ступінь окиснення
ВАЛЕНТНІСТЬ І СТУПІНЬ ОКИСНЕННЯ ЕЛЕМЕНТІВ
Пригадуєш, ми вивчали раніше поняття «валентність» і на його підставі складали формули різних сполук та їх назви за сучасною номенклатурою. І ти вже знаєш, що валентність — це здатність атома приєднувати або заміщувати певне число інших атомів або атомних груп з утворенням хімічного зв'язку. А чому це так? Зрозуміти фізичний зміст валентності допомогла електронна теорія будови атома і хімічного зв'язку. З розвитком цієї теорії змінилося і саме поняття валентності. У наш час валентність визначається числом ковалентних зв'язків, якими атом з'єднаний з іншими атомами.
А число зв'язків, які може утворювати атом, дорівнює числу його неспарених електронів, які йдуть на утворення спільних електронних пар. При цьому полярність утворених зв'язків не враховується, а тому валентність не має знака. Вона не може бути ні позитивною, ні негативною. Наприклад, у молекулах азоту N2 та амоніаку NH3 атом Нітрогену N тривалентний, оскільки він з'єднаний з N і з Н трьома спільними електронними парами (три зв'язки). Отже, валентність визначається тільки числом ковалентних зв'язків. Ось чому поняття «валентність» не можна застосовувати для сполук немолекулярної будови (з йонним, атомним, металічним зв'язками). Саме тому замість поняття «валентність» використовується поняття «ступінь окиснення».
Ступінь окиснення — це умовний заряд атома в речовині, який виник би на атомі за умови, що спільні електронні пари повністю змістилися б до більш електронегативного атома.
Ступінь окиснення, на відміну від валентності, може мати позитивне, негативне і нульове значення. Це значення зі знаком плюс чи мінус перед арабською цифрою зазначається над символом елемента або римською цифрою без знака у дужках після назви елемента. Наприклад:
+1 -2 0
Na, O, Н2,
де ступені окиснення Натрію +1, Оксигену -2, Гідрогену 0; або Ферум(ІІІ), Купрум(ІІ), Нітроген(V) тощо.
Якщо сполука бінарна, то один із елементів має позитивний ступінь окиснення, а інший — негативний. Так, у більшості сполук Гідроген має ступінь окиснення +1, а Оксиген -2. Наприклад, у формулі води:
+1 -2
Н2O.
Але це зовсім не означає, що атоми елемента, наприклад Гідрогену, несуть на собі заряд +1, а атоми Оксигену -2. Це умовні числа, якими домовилися позначати ступінь окиснення.
А як дізнатися, який елемент у сполуці виявляє позитивний ступінь окиснення, а який — негативний?
З цією метою потрібно звернутися до ряду електронегативності хімічних елементів:
F О N CI Br S Р С Н Si Al Mg Са Na Cs
У бінарних сполуках хімічний елемент, що стоїть у цьому ряду лівіше, виявляє негативний ступінь окиснення, а той, що стоїть правіше, — позитивний. Так, у сполуці MgO хімічний елемент Магній мас позитивний ступінь окиснення +2, а Оксиген — негативний ступінь окиснення -2.
Позитивні значення ступенів окиснення мають ті атоми, які віддали свої електрони іншим атомам (зв'язувальна електронна хмара зміщена від них). Наприклад, атоми металів.
Негативні значення ступенів окиснення мають ті атоми, які приєднали електрони від інших атомів (зв'язувальна електронна хмара зміщена до них).
Негативне значення ступеня окиснення -1 завжди має Флуор у всіх сполуках.
Нульове значення ступенів окиснення мають атоми в простих речовинах, наприклад Сl2, N2, Н2, 02, Br2, F2, оскільки у них зв'язувальна електронна пара не зміщена в жоден бік, а розміщена симетрично.
Під час обчислення ступенів окиснення слід пам'ятати, що:
1) алгебрична сума ступенів окиснення всіх атомів у сполуці має дорівнювати нулю, наприклад у ферум(ІІІ) хлориді FeCl3 сума усіх ступенів окиснення дорівнює:
+3 + (-1) -3 = 0;
2) ступінь окиснення елементів у простих речовинах дорівнює нулю;
3) ступінь окиснення лужних металів завжди дорівнює +1;
4) ступінь окиснення Гідрогену в сполуках, як правило, дорівнює +1;
5) Флуор в усіх сполуках має ступінь окиснення -1;
6) ступінь окиснення Оксигену в сполуках, як правило, дорівнює -2.
Наприклад,
+1 +6 -2 0 -3 +1 +1 +7 -2 + 1 -2
H2SO4, N2, NH3, KMnO4, H2S
Ступінь окиснення не слід ототожнювати з валентністю навіть у тому разі, коли їхні значення збігаються. Наприклад, у хлороводні НСl ступінь окиснення Гідрогену +1, Хлору -1 і валентність того й іншого елемента — 1. А в молекулі азоту N2 (N=N) є три електронні пари між атомами Нітрогену, тому він тривалентний. Проте ступінь окиснення Нітрогену дорівнює нулю, оскільки спільні електронні пари розміщені симетрично й однаковою мірою належать обом атомам. Через це в усіх простих речовинах ступінь окиснення елементів дорівнює нулю.
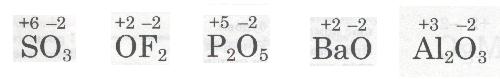
Періодична система елементів дає змогу за місцем того чи іншого елемента в ній дізнатися про ступінь його окиснення (табл. 15).
Таблиця 15. Деякі значення ступенів окиснення елементів 3-го періоду періодичної системи
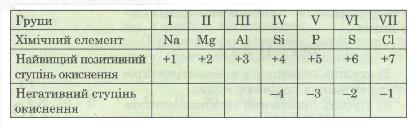
Наприклад, для Сульфуру як елемента VI групи ступінь окиснення дорівнює +6, для Нітрогену, елемента V групи, +5, для Барію, елемента II групи, +2. На підставі теорії будови атома це легко пояснити. Адже зовнішній електронний шар атомів цих елементів містить відповідно 6, 5 і 2 валентні електрони. Під час взаємодії з більш електронегативним елементом, наприклад з Оксигеном, електрони зміщуються в бік Оксигену, а сполучені з ним елементи набувають ступеня окиснення відповідно +6, +5, +2. Прикладами можуть бути сполуки SО3, Р2О5, ВаО.
Винятком є Флуор та Оксиген як найбільш електронегативні елементи (Флуор ніколи не виявляє позитивного ступеня окиснення, а Оксиген інколи виявляє,
+2 -1
тільки у сполуках з Флуором, наприклад флуорид оксигену OF2), а також деякі елементи VIII групи і підгрупи Купруму з І групи.
Найвищий ступінь окиснення у сполуках з Оксигеном, що чисельно дорівнює номеру групи, виявляють елементи не лише головних підгруп, а й побічних, незважаючи на те, що на зовнішньому електронному шарі їхніх атомів найчастіше міститься 1—2 електрони незалежно від того, в якій групі вони перебувають. Наприклад, в оксиді мангану(VII) Мn207 ступінь окиснення Мангану, елемента VII групи, дорівнює +7, хоча на зовнішньому електронному шарі атома Мангану містяться два електрони (ще 5 валентних електронів розміщені на передостанньому шарі).
Поняття «ступінь окиснення», хоча й є формальним, широко використовується в хімії (особливо в неорганічній) під час класифікації хімічних процесів, складання хімічних рівнянь тощо.
Bисновки
З розвитком науки змінився зміст поняття «валентність». Воно має чіткий і однозначний сенс тільки для сполук молекулярної будови, де хімічні зв'язки — ковалентні, що здійснюються парою електронів.
Поняття «валентність» не можна застосовувати до атомів елементів, що входять до складу сполук немолекулярної будови.
У неорганічній хімії замість валентності використовується ступінь окиснення. Це поняття умовне, реального змісту воно не має.
Ступінь окиснення елемента можна визначати за періодичною системою хімічних елементів, у якій найвищий позитивний ступінь окиснення елемента чисельно дорівнює номеру групи, в якій розміщено елемент.
Про негативний ступінь окиснення елемента можна дізнатися, якщо від номера групи, де він розміщений, відняти 8.
Знання ступенів окиснення дає змогу складати формули бінарних сполук. У свою чергу, за формулами бінарних сполук можна обчислювати ступені окиснення елементів.
Завдання для самоконтролю
1. Як ти розумієш зміст поняття «ступінь окиснення»? У чому виявляється його подібність і відмінність порівняно з поняттям «валентність»?
2. Визнач ступені окиснення атомів елементів у сполуках, формули яких:
(a) N2, NO2, NO, N2O5, N2O, N2O3;
(б) MnSO4, MnO2, Mn2O7, Mn2O3;
(в) As2O3, AsH3, H2, H2O;
(г) Cl2O7, Cl2, Cl2O, O2, Cl2O5, Cl2O3.
3. Визнач ступені окиснення атомів елементів у сполуках, формули яких:
(а) H2SO4, SO2, SO3, H2SO3, MgSO4;
(б) HClO4, HPO3, Ba(NO3)2, Al2(SO4)3, P2O5;
(в) Ca3(PO4)2, AI(NO3)3, K2SO3, Na2SO4.
4. У молекулі білого фосфору Р4 валентність і ступінь окиснення атома Фосфору дорівнюють відповідно
(а)1 і +3; (б)3 і +3; (в) 3 і 0; (г) 2 і 0.
5. Атоми Нітрогену мають однаковий ступінь окиснення в сполуках, формули яких
(a) HNO3; (б) Ca3N2; (в) NH4Cl; (г) N2O3.
Додаткові завдання
6. Найменший ступінь окиснення атомів Сульфуру має речовина, формула якої
(a) H2SO4; (б) Na2SO3; (в) SO3; (г) Al2(SO4)3.
7*. Ступінь окиснення атома Фосфору в йоні НР042- дорівнює
(а) + 5; (б) + 3; (в) 0; (г) - 5.
8*. Передбач мінімальний і максимальний ступені окиснення Селену.
9*. Визнач ступені окиснення атомів елементів у таких сполуках: O2, Н2O, Н2O2, OF2, Н2, ВаН2, NaH, H2S.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Безкоштовні підручники по всім предметам, уроки хімії за 8 клас онлайн, конспекти уроків
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|