|
|
|
| (6 промежуточных версий не показаны.) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Хімія: Електроліти та неелектроліти''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Електроліти та неелектроліти''' <br> |
| | | | |
| - | <metakeywords>Хімія, клас, урок, на тему, 9 клас, Електроліти та неелектроліти.</metakeywords>ЕЛЕКТРОЛІТИ ТА НЕЕЛЕКТРОЛІТИ | + | <metakeywords>Хімія, клас, урок, на тему, 9 клас, Електроліти та неелектроліти.</metakeywords> |
| | | | |
| | + | ЕЛЕКТРОЛІТИ ТА НЕЕЛЕКТРОЛІТИ |
| | | | |
| - | Електроліти та неелектроліти. Електролітична дисоціація<br>Після опрацювання § 9 ви зможете:<br>наводити приклади електролітів і неелектролітів, встановлювати відмінність між ними; розрізняти катіони й аніони; пояснювати суть електролітичної дисоціації.<br>На шляху до успіху пригадаємо з вивчених курсів хімії, фізики:<br>за яким принципом класифікують електричні заряди; як утворюються катіони й аніони; що таке електричний струм і які умови його існування; за якою ознакою класифікують речовини на провідники, напівпровідники та діелектрики; що таке теорія і які ознаки її якісності.<br>• Електроліти та неелектроліти ви вивчатимете не лише на уроках хімії, а й у курсі фізики 9-го класу. Характеризуючи системи з кількох речовин (мал. 3.2), ми класифікували істинні розчини на молекулярні та йонні.<br> <br><br>Завдання<br>Пригадайте, які структурні частинки містяться у вузлах кристалічних ґраток сахарози (цукру) та натрій хлориду (кухонної солі). За малюнком 9.1 поясніть відмінність між молекулярним і йонним розчинами.<br>Ви вже знаєте, як можна розрізнити істинні та колоїдні розчини (пригадайте, як саме). А чи існує простий і надійний спосіб відрізнити молекулярний розчин від ионного?<br>У XIX ст. англійські науковці Гемфрі Деві та Майкл Фарадей (мал. 9.2) досліджували різноманітні властивості розчинів, зокрема їхню здатність проводити електричний струм.<br>У шкільній лабораторії ці досліди можна виконати за допомогою простого приладу (мал. 9.3,1). Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера (мал. 9.3,2).<br><br>Завдання<br>Використовуючи знання з фізики, назвіть елементи зображеного на малюнку 9.3,1 електричного кола. Які його компоненти розташовані за межами малюнка? Схематично зобразіть це електричне коло повністю.<br>З курсу фізики вам відомо, що однією з умов існування електричного струму є наявність носіїв електричного заряду - електронів або йонів (назвіть ще одну умову існування електричного струму). Отже, якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Очевидно, що у розчинах йонних речовин носії електричного заряду - йони. Ви вже знаєте, що йони - заряджені одно- або багатоатомні частинки. Механізм утворення йонів через втрату або приєднання атомами електронів вам також відомий. На відміну від електронейтральних частинок (атомів, молекул), йони здатні рухатись в електричному полі. Саме тому у 1834 р. Майкл Фарадей запропонував для цих частинок назву, яка походить від грецького «іоп» - той, що йде. Пригадайте: за знаками зарядів йони класифікують на катіони та аніони. За складом йони поділяють на прості й складні.<br>Завдання<br><br>Використовуючи таблицю «Розчинність основ, кислот і солей у воді» (див. додаток), наведіть кілька прикладів простих і складних йонів. Результати дослідження електропровідності деяких речовин та їхніх розчинів наведено у таблиці 9.1. Проаналізуймо її зміст, аби з'ясувати, чи пов’язана електропровідність розчинів із типом хімічного зв’язку у досліджуваних речовинах.<br><br>Отже, електричний струм проводять водні розчини речовин із йонним або ковалентним сильно полярним типом хімічного зв'язку.<br>Речовини, водні розчини яких проводять електричний струм, називають електролітами*.<br>Натомість розчини неелектролітів не проводять електричного струму. Чому розчини одних речовин проводять електричний струм, а розчини інших - ні? З малюнка 9.3,1 (Б) легко зрозуміти, чому електричного струму не проводить водний розчин цукру. Адже у ньому відсутні носії електричного заряду.<br>Залишається з'ясувати причину електропровідності хлоридної кислоти водного розчину гідроген хлориду. Сухий гідроген хлорид електричного струму не проводить, бо не містить вільних носіїв електричних зарядів. Молекули цієї сполуки - диполі. Під час розчинення гідроген хлориду виникають диполь-дипольні взаємодії між його молекулами та диполями води. Під їхньою дією ковалентний полярний зв'язок у молекулі гідроген хлориду (мал. 9.4, А) поляризується настільки сильно, що спільна електронна пара повністю переходить (мал. 9.4, Б) від атома Гідрогену до атома Хлору - відбувається йонізація (мал. 9.4, В). Внаслідок цього процесу утворюються гідратовані йони (мал. 9.4, Г) - катіони Гідрогену й аніони Хлору.<br><br>* Під час топлення кристалічні ґратки йонних сполук руйнуються - з'являються вільні носії електричних зарядів. Тому розтопи електролітів також проводять електричний струм.<br>Отже, електроліти - речовини з йонним або ковалентним сильно полярним типом хімічного зв'язку (див. схему).<br><br>Завдання<br>Виберіть формули речовин, водні розчини яких проводять електричний струм: А KCl; Б HNO3; B О2; Г KOH; Д СО.<br><br>Електролітична дисоціація у водних розчинах - це повний або частковий процес розпаду електроліту на йони під впливом полярних молекул води<br>Основу теорії електролітичної дисоціації, згідно з якою електроліти в розчинах розпадаються на йони, заклав у 1883-1887 роках шведський хімік Сванте Арреніус (мал. 9.5). Однак він не врахував роль молекул розчинника і вважав, що у водному розчині перебувають вільні йони.<br><br><br>Дослідження Арреніуса продовжили інші вчені, зокрема І.О. Каблуков (мал 9.6) і В.О. Краківський (мал. 9.7). Вони спиралися на уявлення Д.І. Менделєєва про ХІМІЧНИЙ характер взаємодії між розчинником і розчинюваною речовиною.<br>Незалежно один від одного ці науковці дійшли однакових висновків А саме: електроліти під час розчинення у воді розпадаються на позитивні и негативні йони. Дисоціація електролітів зумовлена взаємодією диполів води зі структурними частинками електролітів. Йони у розчинах електролітів гідратовані. Під дією електричного струму позитивні йони катіони) рухаються до негативного полюса - катода, а негативні йони (аніони) - до позитивного полюса - анода. Процес дисоціації оборотний<br> <br>Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.<br>Гіпотеза про хімічну взаємодію розчинника і розчинюваної речовини причину розпаду електролітів на йони набула ознак теорії - адже вона втримала багаторазові експериментальні перевірки і стала підґрунтям для подальших наукових розробок. Про це йтиметься у наступних параграфах.<br><br>Стисло про головне<br><br>Йонні розчини на відміну від молекулярних проводять електричний струм. Умови існування електричного струму - різниця потенціалів і наявність вільних носіїв електричного заряду (електронів або йонів).<br>Електропровідність розчинів можна випробувати за допомогою простого приладу, електричне коло якого складається з джерела струму, і вмикача, двох електродів та індикатора струму, наприклад лампи. Якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера.<br>У розчинах йонних речовин носії електричного заряду - йони. Це заряджені одно- або багатоатомні частинки. Позитивні йони називають катіонами, а негативні - аніонами. На відміну від електронейтральних частинок (атомів, молекул), йони здатні рухатись в електричному полі. Під дією електричного струму катіони рухаються до негативного полюса - катода, а аніони - до позитивного полюса - анода. За складом йони поділяють на прості (Na+, Сl-) і складні (NO-3, NH+4, РО3-4).<br>Електричний струм проводять водні розчини речовин із йонним або коваалентним сильно полярним типом хімічного зв'язку. Під час розчинення йонних речовин унаслідок руйнування кристалічних ґраток у розтин потраплять йони. У разі розчинення речовин із ковалентним сильно полярним зв'язком йони утворюються у результаті хімічної взаємодії молекул розчинюваної речовини із розчинником. В обох випадках утворені йони існують у розчині у вигляді гідратів.<br>Речовини, водні розчини яких проводять електричний струм, називають електролітами. Солі, луги, кислоти - електроліти. Розчини неелектролітів електричного струму не проводять.<br>Процес повного або часткового розпаду електролітів на йони під впливом полярних молекул води - електролітична дисоціація. Процес дисоціації оборотний. Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.<br>Гіпотеза про розпад електролітів на йони унаслідок хімічної взаємодії розчинника і розчинюваної речовини набула ознак теорії, адже вона витримала багаторазові експериментальні перевірки. Творці теорії електролітичної дисоціації - С. Арреніус, І.О. Каблуков, В.О. КістяківСЬКИЙ.<br><br><br> <br>Застосуйте свої знання й уміння<br><br>1. Виберіть ознаку, за якою речовини класифікують на електроліти та неелектроліти:<br>А Температура плавлення; Б Густина; В Електропровідність; Г Електропровідність розчинів.<br>2. Назвіть типи хімічних зв'язків, характерні для електролітів. <br>3. Наведіть кілька прикладів електролітів - представників різних класів неорганічних сполук.<br>4. Назвіть частинки, які у розчині електроліту рухатимуться до катода.<br>5. Виберіть аніон:<br>А Вr-; Б Мg; В С02; Г Сu2+ ; Де-<br>6. Виберіть катіон:<br>А СО2-3"; Б Li+; В NН3; Г S2- ;Д 11р.<br>7. Проаналізуйте зміст етикеток на пляшках різних мінеральних вод. Розподіліть зазначені на них йони у відповідні колонки таблиці:<br> <br>Катіони Аніони<br> <br>8. Запишіть хімічні формули речовин, у розчинах яких містяться гідратовані йони: а) Сu2+ і N03-; б) Fе3+ і SО2-4; в) Li+ і ОН-; г) Н+ і Н2Р04-.<br>9. Поясніть, чи зміниться електропровідність води, якщо крізь неї пропускати: а) азот; б) карбон(ІУ) оксид; в) кисень; г) гідроген бромід.<br>Скарбничка досвіду<br>1. Дізнайтеся, використовуючи різноманітні джерела інформації, про відкриття Г. Деві, яке він вважав найважливішим. Чи згодні ви з науковцем?<br>2. Виготовте прилад для дослідження електропровідності. Вам знадобиться джерело постійного струму напругою близько 6 В - плоска батарейка для ліхтарика або радіоприймача. Замість однієї такої батарейки можна використати 3-4 маленькі батарейки. їх треба з'єднати послідовно (позитивний полюс однієї батарейки припаяти мідним дротом до негативного полюса іншої).<br>Електроди датчика електропровідності виготовте з центральних графітова стержнів від двох старих батарейок. Пильнуйте, аби не зруйнувати металеві наконечники! До них припаяйте (або прикріпіть) мідні, очищені від ізоляції дроти 20-30 см завдовжки. Аби електроди не стикалися й були віддалені один від одного на кілька міліметрів, на один вугільний електрод надягніть 2-3 кільця із дроту з товстою ізоляцією. Прикладіть до електрода із дротяними колечками другий електрод і скріпіть їх ізольованим дротом, ізоляційною стрічкою або гумовими колечками.<br>Як мікродатчик електропровідності для роботи з дуже малими кількостями розчинів можна використати штекер від стереофонічних навушників. Стержень такого штекера складається із трьох послідовно розташованих і ізольованих одна від одної циліндричних шайб. Якщо крайні з них застосувати як електроди, до яких приєднати провідники, то після занурення штекера у розчин за допомогою електролампочки можна реєструвати показник електропровідності розчину.<br>Дріт одного електрода приєднайте до лампочки напругою 6 В, Іншим дротом з'єднайте лампочку з батарейкою. Кінці другого дроту від батарейки й дроту від вугільного електрода приєднайте до вимикача.<br>Занурте датчик у розчин й увімкніть електричний струм. Спостерігайте за тим, чи загоряється електролампочка. Після випробування кожного розчину розмикайте електричне коло й двічі промивайте електроди у дистильованій воді (її можна придбати у відділах господарчих товарів або в аптеці). Випробуйте електропровідність таких об'єктів: води (дистильованої, талої, водопровідної, мінеральної); столового оцту; кристалічних цукру, кухонної солі, питної соди, лимонної, аскорбінової (вітамін С) й ацетилсаліцилової (аспірин) кислот і розчинів із різними масовими частками цих речовин; розчину сульфацил-натрію (альбуцид), рідини для зняття манікюрного лаку; гліцерину та його водного розчину тощо. За результатами досліджень підготуйте презентації.
| + | <br> <u>Електроліти та неелектроліти. Електролітична дисоціація</u><br> |
| | | | |
| - | ''<br>Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів ''
| + | <br> |
| | | | |
| | + | • ''[[Ступінь_дисоціації._Сильні_і_слабкі_електроліти|Електроліти ]]та неелектроліти'' ви вивчатимете не лише на уроках [[Хімія|хімії]], а й у курсі [[Фізика_9_клас|фізики 9-го класу]]. Характеризуючи системи з кількох речовин (мал. 3.2), ми класифікували[[Значення_розчинів_у_природі_та_житті_людини._Поняття_про_дисперсні_системи,_колоїдні_та_істинні_розчини._Насичені_й_ненасичені_розчини|істинні розчини]] на молекулярні та йонні.<br> |
| | | | |
| - | <sub>Матеріали з хімії, планування з хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 9 класу</sub> | + | '''Завдання'''<br> |
| | | | |
| | + | ''Пригадайте, які структурні частинки містяться у вузлах кристалічних ґраток сахарози (цукру) та натрій хлориду (кухонної солі). За малюнком 9.1 поясніть відмінність між молекулярним і йонним розчинами.''<br> |
| | + | |
| | + | [[Image:60 chemistry.jpg|Схематичне зображення розчинів цукру та кухонної солі. фото]] |
| | + | |
| | + | Ви вже знаєте, як можна розрізнити істинні та [[Значення_розчинів_у_природі_та_житті_людини._Поняття_про_дисперсні_системи,_колоїдні_та_істинні_розчини._Насичені_й_ненасичені_розчини|колоїдні розчини]] (пригадайте, як саме). А чи існує простий і надійний спосіб відрізнити молекулярний розчин від ионного?<br> |
| | + | |
| | + | У XIX ст. англійські науковці Гемфрі Деві та Майкл Фарадей (мал. 9.2) досліджували різноманітні властивості розчинів, зокрема їхню здатність проводити [[Електричний_струм._Дії_електричного_струму|електричний струм]].<br> |
| | + | |
| | + | [[Image:61 1 chemistry.jpg|Гемфрі Деві та Майкл Фарадей. фото]] |
| | + | |
| | + | [[Image:61 2 chemistry.jpg|Дослідження електропровідності розчинів. фото]] |
| | + | |
| | + | У шкільній лабораторії ці досліди можна виконати за допомогою простого приладу (мал. 9.3,1). Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера (мал. 9.3,2).<br> |
| | + | |
| | + | '''Завдання'''<br> |
| | + | |
| | + | ''Використовуючи знання з фізики, назвіть елементи зображеного на малюнку 9.3,1 електричного кола. Які його компоненти розташовані за межами малюнка? Схематично зобразіть це електричне коло повністю.''<br> |
| | + | |
| | + | З курсу [[Фізика_і_астрономія|фізики ]]вам відомо, що однією з умов існування електричного струму є наявність носіїв електричного заряду - електронів або [[Презентація_уроку_«Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи»|йонів ]](назвіть ще одну умову існування електричного струму). Отже, якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Очевидно, що у розчинах йонних речовин носії електричного заряду - йони. Ви вже знаєте, що йони - заряджені одно- або багатоатомні частинки. Механізм утворення йонів через втрату або приєднання атомами електронів вам також відомий. На відміну від електронейтральних частинок ([[Атоми_і_хімічні_елементи._Акселеративна_вправа|атомів]], [[Будова_речовини._Атоми_і_молекули._Будова_атома|молекул]]), йони здатні рухатись в електричному полі. Саме тому у 1834 р. Майкл Фарадей запропонував для цих частинок назву, яка походить від грецького «іоп» - той, що йде. Пригадайте: за знаками зарядів йони класифікують на катіони та аніони. За складом йони поділяють на прості й складні.<br> |
| | + | |
| | + | '''Завдання'''<br> |
| | + | |
| | + | ''Використовуючи таблицю «Розчинність основ, кислот і солей у воді» (див. додаток), наведіть кілька прикладів простих і складних йонів.''<br> |
| | + | |
| | + | Результати дослідження електропровідності деяких речовин та їхніх розчинів наведено у таблиці 9.1. Проаналізуймо її зміст, аби з'ясувати, чи пов’язана електропровідність розчинів із типом хімічного зв’язку у досліджуваних речовинах.<br> |
| | + | |
| | + | [[Image:62 chemistry.jpg|Електропровідність. фото]] |
| | + | |
| | + | Отже, електричний струм проводять водні розчини речовин із йонним або ковалентним сильно полярним типом хімічного зв'язку.<br> |
| | + | |
| | + | Речовини, водні розчини яких проводять електричний струм, називають електролітами*.<br> |
| | + | |
| | + | Натомість розчини неелектролітів не проводять електричного струму. Чому розчини одних речовин проводять електричний струм, а розчини інших - ні? З малюнка 9.3,1 (Б) легко зрозуміти, чому електричного струму не проводить водний розчин цукру. Адже у ньому відсутні носії електричного заряду.<br> |
| | + | |
| | + | [[Image:63 1x chemistry.jpg|Диполь води. фото]]<br> |
| | + | |
| | + | Залишається з'ясувати причину [[Струм_у_напівпровідниках._Електропровідність_напівпровідників._Залежність_струму_в_напівпровідниках_від_температури._Термістори|електропровідності]] хлоридної кислоти водного розчину гідроген хлориду. Сухий гідроген хлорид електричного струму не проводить, бо не містить вільних носіїв електричних зарядів. Молекули цієї сполуки - диполі. Під час розчинення гідроген хлориду виникають диполь-дипольні взаємодії між його молекулами та диполями води. Під їхньою дією ковалентний полярний зв'язок у молекулі гідроген хлориду (мал. 9.4, А) поляризується настільки сильно, що спільна електронна пара повністю переходить (мал. 9.4, Б) від атома Гідрогену до атома Хлору - відбувається йонізація (мал. 9.4, В). Внаслідок цього процесу утворюються гідратовані йони (мал. 9.4, Г) - катіони Гідрогену й аніони Хлору.<br> |
| | + | |
| | + | Отже, [[Реакції_обміну_між_електролітами|електроліти ]]- речовини з йонним або ковалентним сильно полярним типом хімічного зв'язку (див. схему). |
| | + | |
| | + | [[Image:63 2 chemistry.jpg]] |
| | + | |
| | + | • Під час топлення кристалічні ґратки йонних сполук руйнуються - з'являються вільні носії електричних зарядів. Тому розтопи електролітів також проводять електричний струм.<br> |
| | + | |
| | + | '''Завдання'''<br> |
| | + | |
| | + | ''Виберіть формули речовин, водні розчини яких проводять електричний струм: А KCl; Б HNO<sub>3</sub>; B О<sub>2</sub>; Г KOH; Д СО.''<br> |
| | + | |
| | + | Електролітична дисоціація у водних розчинах - це повний або частковий процес розпаду електроліту на йони під впливом полярних молекул води.<br> |
| | + | |
| | + | Основу теорії електролітичної дисоціації, згідно з якою електроліти в розчинах розпадаються на йони, заклав у 1883-1887 роках шведський хімік Сванте Арреніус (мал. 9.5). Однак він не врахував роль молекул розчинника і вважав, що у водному розчині перебувають вільні йони.<br> |
| | + | |
| | + | Дослідження Арреніуса продовжили інші вчені, зокрема І.О. Каблуков (мал 9.6) і В.О. Краківський (мал. 9.7). Вони спиралися на уявлення Д.І. Менделєєва про хімічний характер взаємодії між розчинником і розчинюваною речовиною.<br> |
| | + | |
| | + | Незалежно один від одного ці науковці дійшли однакових висновків А саме: електроліти під час розчинення у воді розпадаються на позитивні и негативні йони. Дисоціація електролітів зумовлена взаємодією диполів води зі структурними частинками електролітів. Йони у розчинах електролітів гідратовані. Під дією електричного струму позитивні йони катіони) рухаються до негативного полюса - катода, а негативні йони (аніони) - до позитивного полюса - анода. Процес дисоціації оборотний<br> |
| | + | |
| | + | [[Image:64 chemistry.jpg|Сванте Август Арреніус, Іван Олексійович Каблуков та Володимир Олександрович Кістяківський. фото]] |
| | + | |
| | + | Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.<br> |
| | + | |
| | + | Гіпотеза про хімічну взаємодію розчинника і розчинюваної речовини причину розпаду електролітів на йони набула ознак теорії - адже вона втримала багаторазові експериментальні перевірки і стала підґрунтям для подальших наукових розробок. Про це йтиметься у наступних параграфах.<br> |
| | + | |
| | + | '''Стисло про головне'''<br> |
| | + | |
| | + | Йонні розчини на відміну від молекулярних проводять електричний струм. Умови існування електричного струму - різниця потенціалів і наявність вільних носіїв електричного заряду (електронів або йонів).<br> |
| | + | |
| | + | Електропровідність розчинів можна випробувати за допомогою простого приладу, електричне коло якого складається з джерела струму, і вмикача, двох електродів та індикатора струму, наприклад лампи. Якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера.<br> |
| | + | |
| | + | У розчинах йонних речовин носії електричного заряду - йони. Це заряджені одно- або багатоатомні частинки. Позитивні йони називають катіонами, а негативні - аніонами. На відміну від електронейтральних частинок (атомів, молекул), йони здатні рухатись в електричному полі. Під дією електричного струму катіони рухаються до негативного полюса - катода, а аніони - до позитивного полюса - анода. За складом йони поділяють на прості (Na<sup>+</sup>, Сl<sup>-</sup>) і складні (NO<sup>-</sup><sub>3</sub>, NH<sup>+</sup><sub>4</sub>, РО<sup>3-</sup><sub>4</sub>).<br> |
| | + | |
| | + | Електричний струм проводять водні розчини речовин із йонним або коваалентним сильно полярним типом хімічного зв'язку. Під час розчинення йонних речовин унаслідок руйнування кристалічних ґраток у розтин потраплять йони. У разі розчинення речовин із ковалентним сильно полярним зв'язком йони утворюються у результаті хімічної взаємодії молекул розчинюваної речовини із розчинником. В обох випадках утворені йони існують у розчині у вигляді гідратів.<br> |
| | + | |
| | + | Речовини, водні розчини яких проводять електричний струм, називають електролітами. Солі, луги, кислоти - електроліти. Розчини неелектролітів електричного струму не проводять.<br> |
| | + | |
| | + | Процес повного або часткового розпаду електролітів на йони під впливом полярних молекул води - електролітична дисоціація. Процес дисоціації оборотний. Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.<br> |
| | + | |
| | + | Гіпотеза про розпад електролітів на йони унаслідок хімічної взаємодії розчинника і розчинюваної речовини набула ознак теорії, адже вона витримала багаторазові експериментальні перевірки. Творці теорії електролітичної дисоціації - С. Арреніус, І.О. Каблуков, В.О. Кістяківський. |
| | + | |
| | + | '''Застосуйте свої знання й уміння''' |
| | + | |
| | + | ''1. Виберіть ознаку, за якою речовини класифікують на електроліти та неелектроліти:<br>А Температура плавлення; Б Густина; В Електропровідність; Г Електропровідність розчинів.'' |
| | + | |
| | + | ''2. Назвіть типи хімічних зв'язків, характерні для електролітів.'' |
| | + | |
| | + | ''3. Наведіть кілька прикладів електролітів - представників різних класів неорганічних сполук.'' |
| | + | |
| | + | ''4. Назвіть частинки, які у розчині електроліту рухатимуться до катода.'' |
| | + | |
| | + | ''5. Виберіть аніон: <sub> </sub><br>А Вr<sup>-</sup>; Б Мg; В С0<sub>2</sub>; Г Сu<sup>2+</sup> ; Д е<sup>-</sup> .'' |
| | + | |
| | + | ''6. Виберіть катіон:<br>А СО<sup>2-</sup><sub>3</sub>; Б Li<sup>+</sup>; В NН<sub>3</sub>; Г S<sup>2-</sup> ;Д <sup>1</sup><sub>1</sub>р.'' |
| | + | |
| | + | ''7. Проаналізуйте зміст етикеток на пляшках різних мінеральних вод. Розподіліть зазначені на них йони у відповідні колонки таблиці:'' |
| | + | |
| | + | {| cellspacing="1" cellpadding="1" border="1" width="200" |
| | + | |- |
| | + | | ''Катіони <br>'' |
| | + | | '' Аніони'' |
| | + | |- |
| | + | | ''<br>'' |
| | + | | ''<br>'' |
| | + | |} |
| | + | |
| | + | ''8. Запишіть хімічні формули речовин, у розчинах яких містяться гідратовані йони: а) Сu<sup>2+</sup> і N0<sup>-</sup><sub>3</sub>; б) Fе<sup>3+</sup> і SО<sup>2-</sup><sub>4</sub>; в) Li<sup>+</sup> і ОН<sup>-</sup>; г) Н<sup>+</sup> і Н<sub>2</sub>Р0<sup>-</sup><sub>4.</sub>'' |
| | + | |
| | + | ''9. Поясніть, чи зміниться електропровідність води, якщо крізь неї пропускати: а) азот; б) карбон(ІУ) оксид; в) кисень; г) гідроген бромід.'' |
| | + | |
| | + | '''Скарбничка досвіду'''<br>''1. Дізнайтеся, використовуючи різноманітні джерела інформації, про відкриття Г. Деві, яке він вважав найважливішим. Чи згодні ви з науковцем?'' |
| | + | |
| | + | ''2. Виготовте прилад для дослідження електропровідності. Вам знадобиться джерело постійного струму напругою близько 6 В - плоска батарейка для ліхтарика або радіоприймача. Замість однієї такої батарейки можна використати 3-4 маленькі батарейки. їх треба з'єднати послідовно (позитивний полюс однієї батарейки припаяти мідним дротом до негативного полюса іншої).'' |
| | + | |
| | + | ''Електроди датчика електропровідності виготовте з центральних графітова стержнів від двох старих батарейок. Пильнуйте, аби не зруйнувати металеві наконечники! До них припаяйте (або прикріпіть) мідні, очищені від ізоляції дроти 20-30 см завдовжки. Аби електроди не стикалися й були віддалені один від одного на кілька міліметрів, на один вугільний електрод надягніть 2-3 кільця із дроту з товстою ізоляцією. Прикладіть до електрода із дротяними колечками другий електрод і скріпіть їх ізольованим дротом, ізоляційною стрічкою або гумовими колечками.'' |
| | + | |
| | + | ''Як мікродатчик електропровідності для роботи з дуже малими кількостями розчинів можна використати штекер від стереофонічних навушників. Стержень такого штекера складається із трьох послідовно розташованих і ізольованих одна від одної циліндричних шайб. Якщо крайні з них застосувати як електроди, до яких приєднати провідники, то після занурення штекера у розчин за допомогою електролампочки можна реєструвати показник електропровідності розчину.'' |
| | + | |
| | + | ''Дріт одного електрода приєднайте до лампочки напругою 6 В. Іншим дротом з'єднайте лампочку з батарейкою. Кінці другого дроту від батарейки й дроту від вугільного електрода приєднайте до вимикача.'' |
| | + | |
| | + | ''Занурте датчик у розчин й увімкніть електричний струм. Спостерігайте за тим, чи загоряється електролампочка. Після випробування кожного розчину розмикайте електричне коло й двічі промивайте електроди у дистильованій воді (її можна придбати у відділах господарчих товарів або в аптеці). Випробуйте електропровідність таких об'єктів: води (дистильованої, талої, водопровідної, мінеральної); столового оцту; кристалічних цукру, кухонної солі, питної соди, лимонної, аскорбінової (вітамін С) й ацетилсаліцилової (аспірин) кислот і розчинів із різними масовими частками цих речовин; розчину сульфацил-натрію (альбуцид), рідини для зняття манікюрного лаку; гліцерину та його водного розчину тощо. За результатами досліджень підготуйте презентації.'' |
| | + | |
| | + | ''<br>Г. А. Лашевська, [[Хімія_9_клас|Хімія, 9 клас]]<br>Вислано читачами з інтернет-сайтів '' |
| | + | |
| | + | <br> <sub>Матеріали з хімії, планування [[Хімія|з хімії]], завдання та відповіді по класам, [[Гіпермаркет Знань - перший в світі!|плани конспектів]] уроків [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| | + | |
| | + | <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | <br> | + | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | + | <br> Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| | | | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 10:36, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Електроліти та неелектроліти
ЕЛЕКТРОЛІТИ ТА НЕЕЛЕКТРОЛІТИ
Електроліти та неелектроліти. Електролітична дисоціація
• Електроліти та неелектроліти ви вивчатимете не лише на уроках хімії, а й у курсі фізики 9-го класу. Характеризуючи системи з кількох речовин (мал. 3.2), ми класифікувалиістинні розчини на молекулярні та йонні.
Завдання
Пригадайте, які структурні частинки містяться у вузлах кристалічних ґраток сахарози (цукру) та натрій хлориду (кухонної солі). За малюнком 9.1 поясніть відмінність між молекулярним і йонним розчинами.
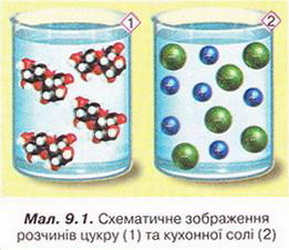
Ви вже знаєте, як можна розрізнити істинні та колоїдні розчини (пригадайте, як саме). А чи існує простий і надійний спосіб відрізнити молекулярний розчин від ионного?
У XIX ст. англійські науковці Гемфрі Деві та Майкл Фарадей (мал. 9.2) досліджували різноманітні властивості розчинів, зокрема їхню здатність проводити електричний струм.

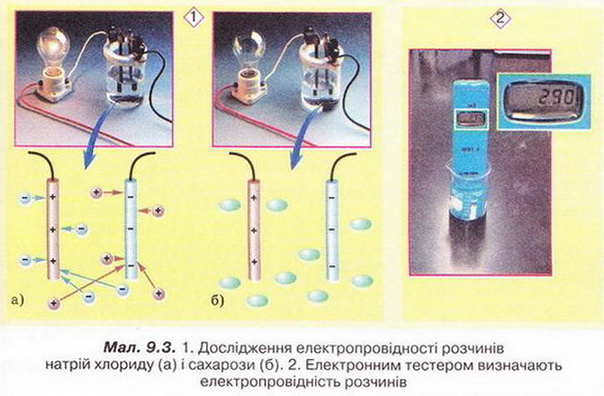
У шкільній лабораторії ці досліди можна виконати за допомогою простого приладу (мал. 9.3,1). Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера (мал. 9.3,2).
Завдання
Використовуючи знання з фізики, назвіть елементи зображеного на малюнку 9.3,1 електричного кола. Які його компоненти розташовані за межами малюнка? Схематично зобразіть це електричне коло повністю.
З курсу фізики вам відомо, що однією з умов існування електричного струму є наявність носіїв електричного заряду - електронів або йонів (назвіть ще одну умову існування електричного струму). Отже, якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Очевидно, що у розчинах йонних речовин носії електричного заряду - йони. Ви вже знаєте, що йони - заряджені одно- або багатоатомні частинки. Механізм утворення йонів через втрату або приєднання атомами електронів вам також відомий. На відміну від електронейтральних частинок (атомів, молекул), йони здатні рухатись в електричному полі. Саме тому у 1834 р. Майкл Фарадей запропонував для цих частинок назву, яка походить від грецького «іоп» - той, що йде. Пригадайте: за знаками зарядів йони класифікують на катіони та аніони. За складом йони поділяють на прості й складні.
Завдання
Використовуючи таблицю «Розчинність основ, кислот і солей у воді» (див. додаток), наведіть кілька прикладів простих і складних йонів.
Результати дослідження електропровідності деяких речовин та їхніх розчинів наведено у таблиці 9.1. Проаналізуймо її зміст, аби з'ясувати, чи пов’язана електропровідність розчинів із типом хімічного зв’язку у досліджуваних речовинах.
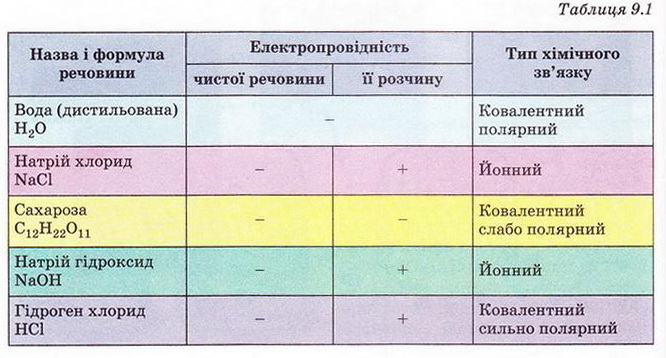
Отже, електричний струм проводять водні розчини речовин із йонним або ковалентним сильно полярним типом хімічного зв'язку.
Речовини, водні розчини яких проводять електричний струм, називають електролітами*.
Натомість розчини неелектролітів не проводять електричного струму. Чому розчини одних речовин проводять електричний струм, а розчини інших - ні? З малюнка 9.3,1 (Б) легко зрозуміти, чому електричного струму не проводить водний розчин цукру. Адже у ньому відсутні носії електричного заряду.
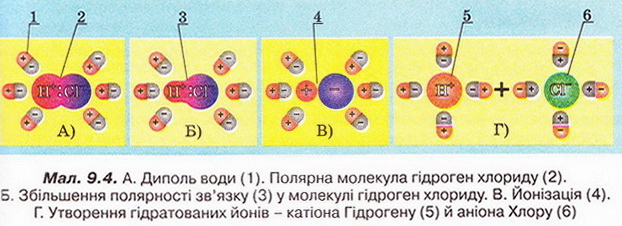
Залишається з'ясувати причину електропровідності хлоридної кислоти водного розчину гідроген хлориду. Сухий гідроген хлорид електричного струму не проводить, бо не містить вільних носіїв електричних зарядів. Молекули цієї сполуки - диполі. Під час розчинення гідроген хлориду виникають диполь-дипольні взаємодії між його молекулами та диполями води. Під їхньою дією ковалентний полярний зв'язок у молекулі гідроген хлориду (мал. 9.4, А) поляризується настільки сильно, що спільна електронна пара повністю переходить (мал. 9.4, Б) від атома Гідрогену до атома Хлору - відбувається йонізація (мал. 9.4, В). Внаслідок цього процесу утворюються гідратовані йони (мал. 9.4, Г) - катіони Гідрогену й аніони Хлору.
Отже, електроліти - речовини з йонним або ковалентним сильно полярним типом хімічного зв'язку (див. схему).

• Під час топлення кристалічні ґратки йонних сполук руйнуються - з'являються вільні носії електричних зарядів. Тому розтопи електролітів також проводять електричний струм.
Завдання
Виберіть формули речовин, водні розчини яких проводять електричний струм: А KCl; Б HNO3; B О2; Г KOH; Д СО.
Електролітична дисоціація у водних розчинах - це повний або частковий процес розпаду електроліту на йони під впливом полярних молекул води.
Основу теорії електролітичної дисоціації, згідно з якою електроліти в розчинах розпадаються на йони, заклав у 1883-1887 роках шведський хімік Сванте Арреніус (мал. 9.5). Однак він не врахував роль молекул розчинника і вважав, що у водному розчині перебувають вільні йони.
Дослідження Арреніуса продовжили інші вчені, зокрема І.О. Каблуков (мал 9.6) і В.О. Краківський (мал. 9.7). Вони спиралися на уявлення Д.І. Менделєєва про хімічний характер взаємодії між розчинником і розчинюваною речовиною.
Незалежно один від одного ці науковці дійшли однакових висновків А саме: електроліти під час розчинення у воді розпадаються на позитивні и негативні йони. Дисоціація електролітів зумовлена взаємодією диполів води зі структурними частинками електролітів. Йони у розчинах електролітів гідратовані. Під дією електричного струму позитивні йони катіони) рухаються до негативного полюса - катода, а негативні йони (аніони) - до позитивного полюса - анода. Процес дисоціації оборотний

Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.
Гіпотеза про хімічну взаємодію розчинника і розчинюваної речовини причину розпаду електролітів на йони набула ознак теорії - адже вона втримала багаторазові експериментальні перевірки і стала підґрунтям для подальших наукових розробок. Про це йтиметься у наступних параграфах.
Стисло про головне
Йонні розчини на відміну від молекулярних проводять електричний струм. Умови існування електричного струму - різниця потенціалів і наявність вільних носіїв електричного заряду (електронів або йонів).
Електропровідність розчинів можна випробувати за допомогою простого приладу, електричне коло якого складається з джерела струму, і вмикача, двох електродів та індикатора струму, наприклад лампи. Якщо у посудину з досліджуваним розчином занурити електроди приладу й увімкнути електричний струм, то за наявності у розчині вільних носіїв електричного заряду лампа загоряється. Безпечно, швидко й точно вимірюють електропровідність за допомогою електронного тестера.
У розчинах йонних речовин носії електричного заряду - йони. Це заряджені одно- або багатоатомні частинки. Позитивні йони називають катіонами, а негативні - аніонами. На відміну від електронейтральних частинок (атомів, молекул), йони здатні рухатись в електричному полі. Під дією електричного струму катіони рухаються до негативного полюса - катода, а аніони - до позитивного полюса - анода. За складом йони поділяють на прості (Na+, Сl-) і складні (NO-3, NH+4, РО3-4).
Електричний струм проводять водні розчини речовин із йонним або коваалентним сильно полярним типом хімічного зв'язку. Під час розчинення йонних речовин унаслідок руйнування кристалічних ґраток у розтин потраплять йони. У разі розчинення речовин із ковалентним сильно полярним зв'язком йони утворюються у результаті хімічної взаємодії молекул розчинюваної речовини із розчинником. В обох випадках утворені йони існують у розчині у вигляді гідратів.
Речовини, водні розчини яких проводять електричний струм, називають електролітами. Солі, луги, кислоти - електроліти. Розчини неелектролітів електричного струму не проводять.
Процес повного або часткового розпаду електролітів на йони під впливом полярних молекул води - електролітична дисоціація. Процес дисоціації оборотний. Поряд з розпадом кристалів або молекул на йони може відбуватися асоціація йонів.
Гіпотеза про розпад електролітів на йони унаслідок хімічної взаємодії розчинника і розчинюваної речовини набула ознак теорії, адже вона витримала багаторазові експериментальні перевірки. Творці теорії електролітичної дисоціації - С. Арреніус, І.О. Каблуков, В.О. Кістяківський.
Застосуйте свої знання й уміння
1. Виберіть ознаку, за якою речовини класифікують на електроліти та неелектроліти:
А Температура плавлення; Б Густина; В Електропровідність; Г Електропровідність розчинів.
2. Назвіть типи хімічних зв'язків, характерні для електролітів.
3. Наведіть кілька прикладів електролітів - представників різних класів неорганічних сполук.
4. Назвіть частинки, які у розчині електроліту рухатимуться до катода.
5. Виберіть аніон:
А Вr-; Б Мg; В С02; Г Сu2+ ; Д е- .
6. Виберіть катіон:
А СО2-3; Б Li+; В NН3; Г S2- ;Д 11р.
7. Проаналізуйте зміст етикеток на пляшках різних мінеральних вод. Розподіліть зазначені на них йони у відповідні колонки таблиці:
8. Запишіть хімічні формули речовин, у розчинах яких містяться гідратовані йони: а) Сu2+ і N0-3; б) Fе3+ і SО2-4; в) Li+ і ОН-; г) Н+ і Н2Р0-4.
9. Поясніть, чи зміниться електропровідність води, якщо крізь неї пропускати: а) азот; б) карбон(ІУ) оксид; в) кисень; г) гідроген бромід.
Скарбничка досвіду
1. Дізнайтеся, використовуючи різноманітні джерела інформації, про відкриття Г. Деві, яке він вважав найважливішим. Чи згодні ви з науковцем?
2. Виготовте прилад для дослідження електропровідності. Вам знадобиться джерело постійного струму напругою близько 6 В - плоска батарейка для ліхтарика або радіоприймача. Замість однієї такої батарейки можна використати 3-4 маленькі батарейки. їх треба з'єднати послідовно (позитивний полюс однієї батарейки припаяти мідним дротом до негативного полюса іншої).
Електроди датчика електропровідності виготовте з центральних графітова стержнів від двох старих батарейок. Пильнуйте, аби не зруйнувати металеві наконечники! До них припаяйте (або прикріпіть) мідні, очищені від ізоляції дроти 20-30 см завдовжки. Аби електроди не стикалися й були віддалені один від одного на кілька міліметрів, на один вугільний електрод надягніть 2-3 кільця із дроту з товстою ізоляцією. Прикладіть до електрода із дротяними колечками другий електрод і скріпіть їх ізольованим дротом, ізоляційною стрічкою або гумовими колечками.
Як мікродатчик електропровідності для роботи з дуже малими кількостями розчинів можна використати штекер від стереофонічних навушників. Стержень такого штекера складається із трьох послідовно розташованих і ізольованих одна від одної циліндричних шайб. Якщо крайні з них застосувати як електроди, до яких приєднати провідники, то після занурення штекера у розчин за допомогою електролампочки можна реєструвати показник електропровідності розчину.
Дріт одного електрода приєднайте до лампочки напругою 6 В. Іншим дротом з'єднайте лампочку з батарейкою. Кінці другого дроту від батарейки й дроту від вугільного електрода приєднайте до вимикача.
Занурте датчик у розчин й увімкніть електричний струм. Спостерігайте за тим, чи загоряється електролампочка. Після випробування кожного розчину розмикайте електричне коло й двічі промивайте електроди у дистильованій воді (її можна придбати у відділах господарчих товарів або в аптеці). Випробуйте електропровідність таких об'єктів: води (дистильованої, талої, водопровідної, мінеральної); столового оцту; кристалічних цукру, кухонної солі, питної соди, лимонної, аскорбінової (вітамін С) й ацетилсаліцилової (аспірин) кислот і розчинів із різними масовими частками цих речовин; розчину сульфацил-натрію (альбуцид), рідини для зняття манікюрного лаку; гліцерину та його водного розчину тощо. За результатами досліджень підготуйте презентації.
Г. А. Лашевська, Хімія, 9 клас
Вислано читачами з інтернет-сайтів
Матеріали з хімії, планування з хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|

















