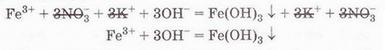|
|
|
| (4 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Хімія: Йонні рівняння''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Йонні рівняння'''<br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Йонні рівняння.</metakeywords> |
| | | | |
| - | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Йонні рівняння.</metakeywords>ЙОННІ РІВНЯННЯ
| |
| | | | |
| - | <br>
| |
| | | | |
| - | • Йонні рівняння, записані у скороченій формі, відбивають суть хімічної реакції. Ви пересвідчилися в цьому, виконуючи лабораторні досліди. Також ви навчилися використовувати таблицю «Розчинність кислот, основ і солей у воді» (див. додаток) для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів, записувати рівняння реакцій у повній і скороченій йонних формах. Закріпімо ці знання й уміння, виконавши зворотне завдання: доберімо пари речовин, взаємодію між якими у розчині описує скорочене йонне рівняння.<br> | + | ЙОННІ РІВНЯННЯ |
| | + | |
| | + | • ''Йонні [[22._Розрахунки_за_хімічними_рівняннями_обٰєму_речовини|рівняння]],'' записані у скороченій формі, відбивають суть[[Хімічні_реакції_та_явища,_що_їх_супроводжують.|хімічної реакції.]] Ви пересвідчилися в цьому, виконуючи лабораторні досліди. Також ви навчилися використовувати таблицю «Розчинність кислот, основ і солей у воді» (див. додаток) для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів, записувати рівняння реакцій у повній і скороченій йонних формах. Закріпімо ці знання й уміння, виконавши зворотне завдання: доберімо пари речовин, взаємодію між якими у розчині описує скорочене йонне рівняння.<br> |
| | | | |
| | Приміром, взаємодія у розчині катіонів Феруму(III) та гідроксид-аніонів веде до утворення бурого драглистого осаду ферум(ІІІ) гідроксиду (мал. 12.5): | | Приміром, взаємодія у розчині катіонів Феруму(III) та гідроксид-аніонів веде до утворення бурого драглистого осаду ферум(ІІІ) гідроксиду (мал. 12.5): |
| | | | |
| - | Fe<sup>3+ </sup>+ 3OH<sup>-</sup> = Fe(OH)<sub>3</sub>[[Image:Znak2.jpg|10x19px]]<br> | + | Fe<sup>3+ </sup>+ 3OH<sup>-</sup> = Fe(OH)<sub>3</sub>[[Image:Znak2.jpg|10x19px|Znak2.jpg]]<br> |
| | | | |
| - | Які саме речовини треба взяти для проведення цієї реакції? Звернімося до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток), аби з’ясувати, які сполуки Феруму(ІІІ) розчинні у воді. Розчинними є хлорид, бромід, сульфат і нітрат Феруму(ІІІ). Аналогічно доберімо розчинну основу. Можна використати розчини гідроксидів Калію, Натрію, Барію тощо. Єдине обмеження – другий продукт реакції має бути розчинним. Тож умові завдання не відповідатиме взаємодія у розчині ферум(ІІІ) сульфату з барій гідроксидом. Адже барій сульфат також нерозчинний. І хоча реакція відбудеться, але жоден йон у повному йонному рівнянні не скоротиться (пересвідчіться у цьому, склавши повне йонне рівняння). Аби перевірити наші передбачення, запишімо у повній та скороченій йонних формах рівняння реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині:<br><br>Одержане скорочене йонне рівняння однакове з тим, що було в умові завдання. Тож утворення драглистого бурого осаду ферум(ІІІ) гідроксиду зумовлене взаємодією у розчині катіонів Феруму(ІІІ) й гідроксид-аніонів.
| + | [[Image:Chemistry 86.jpg|Взаємодія розчину лугу із розчином солі Феруму. фото]] |
| | | | |
| - | <u>Завдання</u>
| + | Які саме [[3._Кількість_речовини._Моль_—_одиниця_кількості_речовини._Число_Авогадро|речовини ]]треба взяти для проведення цієї реакції? Звернімося до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток), аби з’ясувати, які сполуки Феруму(ІІІ) розчинні у воді. Розчинними є хлорид, бромід, сульфат і нітрат Феруму(ІІІ). Аналогічно доберімо розчинну основу. Можна використати розчини гідроксидів Калію, Натрію, Барію тощо. Єдине обмеження – другий продукт реакції має бути розчинним. Тож умові завдання не відповідатиме взаємодія у розчині ферум(ІІІ) сульфату з барій гідроксидом. Адже барій сульфат також нерозчинний. І хоча реакція відбудеться, але жоден йон у повному йонному рівнянні не скоротиться (пересвідчіться у цьому, склавши повне йонне рівняння). Аби перевірити наші передбачення, запишімо у повній та скороченій йонних формах рівняння реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині: |
| | | | |
| - | Виберіть пари речовин, взаємодії яких у розчині відповідає скорочене йонне рівняння:
| + | [[Image:Chemistry 86 1.jpg|формула. фото]]<br>Одержане скорочене йонне рівняння однакове з тим, що було в умові завдання. Тож утворення драглистого бурого осаду ферум(ІІІ) гідроксиду зумовлене взаємодією у розчині катіонів Феруму(ІІІ) й гідроксид-аніонів. |
| | | | |
| - | SO<sub>3</sub><sup>2-</sup> + 2H<sup>+</sup> = SO<sub>2</sub>[[Image:Znak3x.jpg]]+ H<sub>2</sub>O:
| + | '''Завдання''' |
| | | | |
| - | A Na<sub>2</sub>SO<sub>3</sub> і HCl; Б Ag<sub>2</sub>SO<sub>3</sub> і HCl; В Na<sub>2</sub>SO<sub>4</sub> і HCl; Г K<sub>2</sub>SO<sub>3</sub> і H<sub>2</sub>SO<sub>4</sub>; Д ZnSO<sub>3</sub> і H<sub>2</sub>SO<sub>4</sub>.
| + | ''Виберіть пари речовин, взаємодії яких у розчині відповідає скорочене йонне рівняння:'' |
| | | | |
| - | <u>Стисло про головне</u> | + | ''SO<sub>3</sub><sup>2-</sup> + 2H<sup>+</sup> = SO<sub>2</sub>[[Image:Znak3x.jpg]]+ H<sub>2</sub>O:'' |
| | + | |
| | + | ''A Na<sub>2</sub>SO<sub>3</sub> і HCl; Б Ag<sub>2</sub>SO<sub>3</sub> і HCl; В Na<sub>2</sub>SO<sub>4</sub> і HCl; Г K<sub>2</sub>SO<sub>3</sub> і H<sub>2</sub>SO<sub>4</sub>; Д ZnSO<sub>3</sub> і H<sub>2</sub>SO<sub>4</sub>.'' |
| | + | |
| | + | Стисло про головне |
| | | | |
| | Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. | | Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. |
| Строка 33: |
Строка 37: |
| | Для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів використовують таблицю «Розчинність кислот, основ і солей у воді». | | Для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів використовують таблицю «Розчинність кислот, основ і солей у воді». |
| | | | |
| - | <u>Застосуйте свої знання й уміння</u>
| + | Застосуйте свої знання й уміння |
| | + | |
| | + | ''1. Запишіть у повній і скороченій йонних формах рівняння реакцій між:<br>а) натрій карбонатом і кальцій хлоридом; б) хлоридною кислотою та магній карбонатом; в) нітратною кислотою та барій гідроксидом.'' |
| | + | |
| | + | ''2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині:<br>А Мg<sup>2+</sup> і NО[[Image:Znak4 1.jpg]]; Б Мg<sup>2+</sup> і Ва<sup>2+</sup>; В Ва<sup>2+</sup> і SО<sup>2-</sup><sub>4</sub>; Г NО[[Image:Znak4 1.jpg]] і SО<sup>2-</sup><sub>4</sub>.'' |
| | + | |
| | + | ''3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині:<br>А К<sup>+</sup> і NO[[Image:Znak4 1.jpg]]; Б H+ і N0[[Image:Znak4 1.jpg]]; В Н<sup>+</sup> і ОН<sup>-</sup>; Г К<sup>+</sup> і ОН<sup>-</sup>.'' |
| | + | |
| | + | ''4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією:<br>а) катіонів Плюмбуму(ІІ) і хлорид-аніонів; б) катіонів Гідрогену і гідроксид-аніонів; в) катіонів Гідрогену і силікат-аніонів; г) катіонів Гідрогену і купрум(ІІ) гідроксиду; д) катіонів Гідрогену і сульфід-анюнів.'' |
| | + | |
| | + | ''5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині: <br>А Са<sup>2+ </sup>і РО<sup>3-</sup><sub>4</sub>; Б Fе<sup>3+ </sup>і ОН<sup>-</sup>; В СО<sup>2-</sup><sub>3</sub> і Сl<sup>-</sup>; Г NО<sup>-</sup><sub>3</sub> і Ва<sup>2+</sup>.'' |
| | + | |
| | + | ''6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння.'' |
| | + | |
| | + | [[Image:Chemistry 88.jpg|Аніонит та катіони. фото]] |
| | + | |
| | + | ''7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах.'' |
| | + | |
| | + | [[Image:Chemistry 88 1.jpg|Реакція йонного обміну за участю аргентум нітрату. фото]] |
| | + | |
| | + | ''8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь.'' |
| | + | |
| | + | ''9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС0<sub>3</sub>) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою.'' |
| | + | |
| | + | '''Скарбничка досвіду''' |
| | + | |
| | + | ''1. У хімічному кабінеті під керівництвом учителя хімії визначте кислотність виданих зразків меду. Виготовте розчини з масовою часткою меду 10%. У хімічні стакани відмірте порції 10 %-ного водного розчину меду об'ємами по 100мл, добавте до кожної з них по 5 крапель 1 %-ного спиртового розчину, фенолфталеїну й по порції 0,1 %-ного розчину натрій гідроксиду об'ємом 5 МЛ.'' |
| | | | |
| - | 1. Запишіть у повній і скороченій йонних формах рівняння реакцій між:<br>а) натрій карбонатом і кальцій хлоридом; б) хлоридною кислотою та магній карбонатом; в) нітратною кислотою та барій гідроксидом.<br>2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині:<br>А Мg<sup>2+</sup> і NО[[Image:Znak4_1.jpg]]; Б Мg<sup>2+</sup> і Ва<sup>2+</sup>; В Ва<sup>2+</sup> і SО<sup>2-</sup><sub>4</sub>; Г NО[[Image:Znak4x.jpg]] і SО<sup>2-</sup><sub>4</sub>.<br>3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині:<br>А К<sup>+</sup> і NO<sup>-</sup><sub>3</sub>; Б H+ і N0<sup>-</sup><sub><sup></sup>3</sub>; В Н<sup>+</sup> і ОН<sup>-</sup>; Г К<sup>+</sup> і ОН<sup>-</sup>.<br>4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією:<br>а) катіонів Плюмбуму(ІІ) і хлорид-аніонів; б) катіонів Гідрогену і гідроксид-аніонів; в) катіонів Гідрогену і силікат-аніонів; г) катіонів Гідрогену і купрум(ІІ) гідроксиду; д) катіонів Гідрогену і сульфід-анюнів.<br>5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині: <br>А Са<sup>2+ </sup>і РО<sup>3-</sup><sub>4</sub>; Б Fе<sup>3+ </sup>і ОН<sup>-</sup>; В СО<sup>2-</sup><sub>3</sub> і Сl<sup>-</sup>; Г NО<sup>-</sup><sub>3</sub> і Ва<sup>2+</sup>.<br>6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння.<br>7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах.<br>8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь.<br>9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС0<sub>3</sub>) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою.
| + | ''Поясніть, у якому випадку мед має підвищену кислотність: якщо розчин залишився безбарвним, чи за появи малинового забарвлення. Відповідь аргументуйте рівнянням реакції, запишіть його у повній і скороченій йонних формах.'' |
| | | | |
| - | <u>Скарбничка досвіду</u>
| + | ''2. Поміркуйте, яку широко застосовану у кулінарії сполуку можна використати у домашніх умовах для виявлення надмірної кислотності меду. Складіть план експерименту й обговоріть його з учителем хімії. Виконайте дослід у домашніх умовах.'' |
| | | | |
| - | 1. У хімічному кабінеті під керівництвом учителя хімії визначте кислотність виданих зразків меду. Виготовте розчини з масовою часткою меду 10%. У хімічні стакани відмірте порції 10 %-ного водного розчину меду об'ємами по 100мл, добавте до кожної з них по 5 крапель 1 %-ного спиртового розчину, фенолфталеїну й по порції 0,1 %-ного розчину натрій гідроксиду об'ємом 5 МЛ.<br>Поясніть, у якому випадку мед має підвищену кислотність: якщо розчин залишився безбарвним, чи за появи малинового забарвлення. Відповідь аргументуйте рівнянням реакції, запишіть його у повній і скороченій йонних формах.<br>2. Поміркуйте, яку широко застосовану у кулінарії сполуку можна використати у домашніх умовах для виявлення надмірної кислотності меду. Складіть план експерименту й обговоріть його з учителем хімії. Виконайте дослід у домашніх умовах.<br>3. Дізнайтеся, використовуючи різноманітні джерела інформації, про застосування йонного обміну для опріснення води.<br>За результатами здійснених досліджень підготуйте презентації.
| + | ''3. Дізнайтеся, використовуючи різноманітні джерела інформації, про застосування йонного обміну для опріснення води.<br>За результатами здійснених досліджень підготуйте презентації.'' |
| | | | |
| | <br> | | <br> |
| | | | |
| - | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | + | ''Г. А. Лашевська, [[Хімія_9_клас|Хімія, 9 клас]]<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <sub>Планування з хімії, підручники та книги онлайн, курси та завдання з хімії для 9 класу</sub> | + | <sub>Планування [[Хімія|з хімії]], підручники та книги онлайн, [[Гіпермаркет Знань - перший в світі!|курси]] та завдання [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | | | |
Текущая версия на 11:10, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Йонні рівняння
ЙОННІ РІВНЯННЯ
• Йонні рівняння, записані у скороченій формі, відбивають сутьхімічної реакції. Ви пересвідчилися в цьому, виконуючи лабораторні досліди. Також ви навчилися використовувати таблицю «Розчинність кислот, основ і солей у воді» (див. додаток) для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів, записувати рівняння реакцій у повній і скороченій йонних формах. Закріпімо ці знання й уміння, виконавши зворотне завдання: доберімо пари речовин, взаємодію між якими у розчині описує скорочене йонне рівняння.
Приміром, взаємодія у розчині катіонів Феруму(III) та гідроксид-аніонів веде до утворення бурого драглистого осаду ферум(ІІІ) гідроксиду (мал. 12.5):
Fe3+ + 3OH- = Fe(OH)3

Які саме речовини треба взяти для проведення цієї реакції? Звернімося до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток), аби з’ясувати, які сполуки Феруму(ІІІ) розчинні у воді. Розчинними є хлорид, бромід, сульфат і нітрат Феруму(ІІІ). Аналогічно доберімо розчинну основу. Можна використати розчини гідроксидів Калію, Натрію, Барію тощо. Єдине обмеження – другий продукт реакції має бути розчинним. Тож умові завдання не відповідатиме взаємодія у розчині ферум(ІІІ) сульфату з барій гідроксидом. Адже барій сульфат також нерозчинний. І хоча реакція відбудеться, але жоден йон у повному йонному рівнянні не скоротиться (пересвідчіться у цьому, склавши повне йонне рівняння). Аби перевірити наші передбачення, запишімо у повній та скороченій йонних формах рівняння реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині:
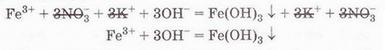
Одержане скорочене йонне рівняння однакове з тим, що було в умові завдання. Тож утворення драглистого бурого осаду ферум(ІІІ) гідроксиду зумовлене взаємодією у розчині катіонів Феруму(ІІІ) й гідроксид-аніонів.
Завдання
Виберіть пари речовин, взаємодії яких у розчині відповідає скорочене йонне рівняння:
SO32- + 2H+ = SO2 + H2O: + H2O:
A Na2SO3 і HCl; Б Ag2SO3 і HCl; В Na2SO4 і HCl; Г K2SO3 і H2SO4; Д ZnSO3 і H2SO4.
Стисло про головне
Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями.
Йонними рівняннями можуть бути зображені будь-які реакції, що збуваються за участю електролітів у розчинах. Якщо вони не супроводжуються зміною зарядів йонів (не змінюються ступені окиснення елементів), то їх називають реакціями йонного обміну.
Аби скласти рівняння реакції у йонній формі, зважають на те, що електроліти у розчині дисоціюють на йони. За таблицею «Розчинність кислот, основ і солей у воді» (див. додаток) визначають, які з-поміж реагентів є сильними електролітами. їхні формули записують у йонній формі. Визначають, які з цих йонів взаємодіятимуть між собою з огляду на знаки їхніх зарядів. Електростатичні сили зумовлюватимуть притягування різнойменних і відштовхування однойменно заряджених іонів. Продукти реакції, які є сильними електролітами, записують у йонній формі. Формули слабких електролітів і газуватих речовин, які залишають сферу реакції, записують традиційно. У повній йонній формі рівнянь коефіцієнти перед формулами кожного з йонів визначають з урахуванням індексів у формулах електролітів та коефіцієнтів перед ними.
Аби одержати скорочене йонне рівняння, формули йонів, які не беруть участі у реакції, у лівій й правій частинах повного йонного рівняння скорочують. Скорочене йонне рівняння відбиває суть реакції обміну між електролітами у розчині. Воно показує, які йони взаємодіють і яка речовина є продуктом реакції.
Умови необоротності реакції між електролітами у розчині - утворення осаду, виділення газу, утворення води або іншої малодисоційованої речовини. Якщо виконується хоча б одна з цих умов, реакція відбувається до кінця. Якщо ж ні, то внаслідок змішування розчинів утворюється суміш йонів.
Для прогнозування можливості перебігу реакцій йонного обміну у розчинах електролітів використовують таблицю «Розчинність кислот, основ і солей у воді».
Застосуйте свої знання й уміння
1. Запишіть у повній і скороченій йонних формах рівняння реакцій між:
а) натрій карбонатом і кальцій хлоридом; б) хлоридною кислотою та магній карбонатом; в) нітратною кислотою та барій гідроксидом.
2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині:
А Мg2+ і NО ; Б Мg2+ і Ва2+; В Ва2+ і SО2-4; Г NО ; Б Мg2+ і Ва2+; В Ва2+ і SО2-4; Г NО і SО2-4. і SО2-4.
3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині:
А К+ і NO ; Б H+ і N0 ; Б H+ і N0 ; В Н+ і ОН-; Г К+ і ОН-. ; В Н+ і ОН-; Г К+ і ОН-.
4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією:
а) катіонів Плюмбуму(ІІ) і хлорид-аніонів; б) катіонів Гідрогену і гідроксид-аніонів; в) катіонів Гідрогену і силікат-аніонів; г) катіонів Гідрогену і купрум(ІІ) гідроксиду; д) катіонів Гідрогену і сульфід-анюнів.
5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині:
А Са2+ і РО3-4; Б Fе3+ і ОН-; В СО2-3 і Сl-; Г NО-3 і Ва2+.
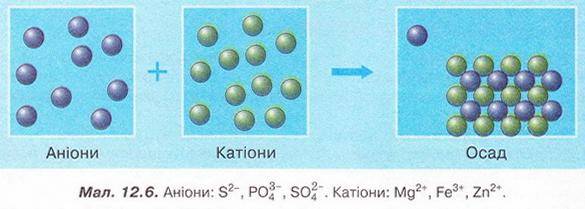
6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння.
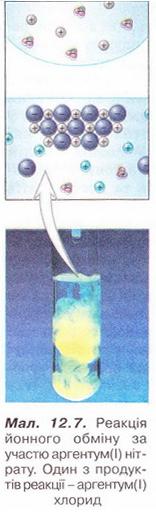
7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах.
8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь.
9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС03) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою.
Скарбничка досвіду
1. У хімічному кабінеті під керівництвом учителя хімії визначте кислотність виданих зразків меду. Виготовте розчини з масовою часткою меду 10%. У хімічні стакани відмірте порції 10 %-ного водного розчину меду об'ємами по 100мл, добавте до кожної з них по 5 крапель 1 %-ного спиртового розчину, фенолфталеїну й по порції 0,1 %-ного розчину натрій гідроксиду об'ємом 5 МЛ.
Поясніть, у якому випадку мед має підвищену кислотність: якщо розчин залишився безбарвним, чи за появи малинового забарвлення. Відповідь аргументуйте рівнянням реакції, запишіть його у повній і скороченій йонних формах.
2. Поміркуйте, яку широко застосовану у кулінарії сполуку можна використати у домашніх умовах для виявлення надмірної кислотності меду. Складіть план експерименту й обговоріть його з учителем хімії. Виконайте дослід у домашніх умовах.
3. Дізнайтеся, використовуючи різноманітні джерела інформації, про застосування йонного обміну для опріснення води.
За результатами здійснених досліджень підготуйте презентації.
Г. А. Лашевська, Хімія, 9 клас
Вислано читачами з інтернет-сайтів
Планування з хімії, підручники та книги онлайн, курси та завдання з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|