|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Застосування сульфатної кислоти і сульфатів''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Застосування сульфатної кислоти і сульфатів'''<br> |
| - | | + | |
| - | ЗАСТОСУВАННЯ СУЛЬФАТНОЇ КИСЛОТИ І СУЛЬФАТІВ. ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА ВІД ЗАБРУДНЕННЯ ВИКИДАМИ СУЛЬФУРОВМІСНИХ РЕЧОВИН
| + | |
| | | | |
| | <br> <u>Застосування сульфатної кислоти і сульфатів</u><br> | | <br> <u>Застосування сульфатної кислоти і сульфатів</u><br> |
| | | | |
| - | [[Оксиди_неметалічних_елементів._Сульфатна_кислота_і_сульфати|Сульфатна кислота]] є важливим продуктом [[Тема_54._Хімічна_промисловість_та_електроенергетика|хімічної промисловості]]. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у [[Література_до_теми_"Металургійна_промисловість._Чорна_металургія"|металургії ]]в процесі добування міді, нікелю, урану та інших металів. Використовується також як осушувач газів.<br> | + | [[Оксиди неметалічних елементів. Сульфатна кислота і сульфати|Сульфатна кислота]] є важливим продуктом [[Тема 54. Хімічна промисловість та електроенергетика|хімічної промисловості]]. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у [[Література до теми |металургії в]] процесі добування міді, нікелю, урану та інших металів. Використовується також як осушувач газів.<br> |
| | | | |
| | Серед сульфатів велике практичне значення мають мідний і залізний купороси СuS0<sub>4</sub> • 5Н<sub>2</sub>0 і FeS0<sub>4</sub> • 7Н<sub>2</sub>0. Вони використовуються в сільському господарстві для боротьби із шкідниками рослин, у виробництві фарб, для просочення деревини як антисептичний засіб. | | Серед сульфатів велике практичне значення мають мідний і залізний купороси СuS0<sub>4</sub> • 5Н<sub>2</sub>0 і FeS0<sub>4</sub> • 7Н<sub>2</sub>0. Вони використовуються в сільському господарстві для боротьби із шкідниками рослин, у виробництві фарб, для просочення деревини як антисептичний засіб. |
| Строка 27: |
Строка 25: |
| | Цей процес відбувається у колчеданних печах, з яких виходить випалювальний газ. Він містить, окрім діоксиду сульфуру S0<sub>2</sub>, ще кисень, азот, водяну пару та інші домшки. Його очищають, висушують і подають на другу стадію виробництва у контактний апарат. | | Цей процес відбувається у колчеданних печах, з яких виходить випалювальний газ. Він містить, окрім діоксиду сульфуру S0<sub>2</sub>, ще кисень, азот, водяну пару та інші домшки. Його очищають, висушують і подають на другу стадію виробництва у контактний апарат. |
| | | | |
| - | Друга стадія — [[63._Визначення_ступеня_окиснення_атома_елемента_за_хімічною_формулою_сполуки|окиснення]] діоксиду сульфуру і добування триоксиду сульфуру: | + | Друга стадія — [[63. Визначення ступеня окиснення атома елемента за хімічною формулою сполуки|окиснення]] діоксиду сульфуру і добування триоксиду сульфуру: |
| | | | |
| - | <sub> V2O5</sub> | + | <sub> V2O5</sub> |
| | | | |
| | 2S0<sub>2</sub> + 0<sub>2</sub> ⇔2SО<sub>3 </sub> ΔH = -197,9 кДж. | | 2S0<sub>2</sub> + 0<sub>2</sub> ⇔2SО<sub>3 </sub> ΔH = -197,9 кДж. |
| Строка 41: |
Строка 39: |
| | Отже, процес окиснення S0<sub>2 </sub>в S0<sub>3</sub> здійснюється склад но, бо ця реакція оборотна й екзотермічна. Умови її здійснення визначаються в основному згідно з принципом Ле Шательє. | | Отже, процес окиснення S0<sub>2 </sub>в S0<sub>3</sub> здійснюється склад но, бо ця реакція оборотна й екзотермічна. Умови її здійснення визначаються в основному згідно з принципом Ле Шательє. |
| | | | |
| - | • ''Сформулюйте принцип Ле Шательє так, як ви його розумієте. Яких умов окиснення S0<sub>2</sub> в S0<sub>3 </sub>слід додержувати, щоб збільшити вихід триоксиду сульфуру? Обгрунтуйте ці умови.'' | + | • ''Сформулюйте принцип Ле Шательє так, як ви його розумієте. Яких умов окиснення S0<sub>2</sub> в S0<sub>3 </sub>слід додержувати, щоб збільшити вихід триоксиду сульфуру? Обгрунтуйте ці умови.'' |
| | | | |
| | Третя стадія виробництва — поглинання триоксиду сульфуру утворення сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. | | Третя стадія виробництва — поглинання триоксиду сульфуру утворення сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. |
| Строка 49: |
Строка 47: |
| | S0<sub>3</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>4</sub>; ΔH = -130,6 кДж | | S0<sub>3</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>4</sub>; ΔH = -130,6 кДж |
| | | | |
| - | Чистою водою поглинати триоксид сульфуру S0<sub>3</sub> не можна, оскільки утворюється дуже стійкий «туман» з дрібних крапель сульфатної кислоти, який погано конденсується. | + | Чистою водою поглинати триоксид сульфуру S0<sub>3</sub> не можна, оскільки утворюється дуже стійкий «туман» з дрібних крапель сульфатної кислоти, який погано конденсується. |
| | | | |
| | Кінцевий продукт виробництва — олеум (розчин S0<sub>3</sub> у моногідраті). Його розбавляють водою до сульфатної кислоти потрібної концентрації.<br> | | Кінцевий продукт виробництва — олеум (розчин S0<sub>3</sub> у моногідраті). Його розбавляють водою до сульфатної кислоти потрібної концентрації.<br> |
| | | | |
| - | [[Image:2-6.jpg|350px| Виробництво сульфатної кислоти. фото]] | + | [[Image:2-6.jpg|350px|Виробництво сульфатної кислоти. фото]] |
| | | | |
| | ''Мал. 1.'' ''Виробництво сульфатної кислоти'' | | ''Мал. 1.'' ''Виробництво сульфатної кислоти'' |
| | | | |
| - | • ''Поясніть, як можна, виходячи з концентрованої сульфатної кислоти, дістати її розбавлений розчин. Обґрунтуйте дії, необхідні при цьому.'' | + | • ''Поясніть, як можна, виходячи з концентрованої сульфатної кислоти, дістати її розбавлений розчин. Обґрунтуйте дії, необхідні при цьому.'' |
| | | | |
| | <u>Охорона праці та навколишнього середовища у виробництві сульфатної кислоти</u> | | <u>Охорона праці та навколишнього середовища у виробництві сульфатної кислоти</u> |
| | | | |
| - | Захист [[Людина_і_біосфера._Зміна_середовища_в_наслідок_діяльності_людини|біосфери]] від забруднення викидами хімічних виробництв — найважливіша проблема сучасності. У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду S0<sub>2</sub> і триоксиду сульфуру S0<sub>3</sub> та викидання їх в атмосферу, що спричинює кислотні дощі. Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців. Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття. Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури. | + | Захист [[Людина і біосфера. Зміна середовища в наслідок діяльності людини|біосфери]] від забруднення викидами хімічних виробництв — найважливіша проблема сучасності. У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду S0<sub>2</sub> і триоксиду сульфуру S0<sub>3</sub> та викидання їх в атмосферу, що спричинює кислотні дощі. Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців. Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття. Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури. |
| | | | |
| | Щоб запобігти утворенню кислотних дощів і забезпечити охорону здоров'я працівників, намагаються не допускати викидання оксиду сульфуру (ІV) S0<sub>2</sub> в атмосферу і в цехи заводу. З цією метою своєчасно ремонтують апаратуру, встановлюють фільтри, поглиначі, вентиляцію, суворо додержують технологічного режиму, використовують засоби індивідуального захисту працівників, удосконалюють й автоматизують виробничі процеси, герметизують устаткуваньня та апаратуру, впроваджують принцип безвідхідності та ефективні методи очищення відхідних газів. З них тепер вловлюють S0<sub>2</sub> і знову повертають його у виробництво. Застосовують також методи добування цінних побічних продуктів з промислових відходів. | | Щоб запобігти утворенню кислотних дощів і забезпечити охорону здоров'я працівників, намагаються не допускати викидання оксиду сульфуру (ІV) S0<sub>2</sub> в атмосферу і в цехи заводу. З цією метою своєчасно ремонтують апаратуру, встановлюють фільтри, поглиначі, вентиляцію, суворо додержують технологічного режиму, використовують засоби індивідуального захисту працівників, удосконалюють й автоматизують виробничі процеси, герметизують устаткуваньня та апаратуру, впроваджують принцип безвідхідності та ефективні методи очищення відхідних газів. З них тепер вловлюють S0<sub>2</sub> і знову повертають його у виробництво. Застосовують також методи добування цінних побічних продуктів з промислових відходів. |
| Строка 67: |
Строка 65: |
| | Над проблемою повної утилізації та переробки відходів виробництва сульфатної кислоти нині працюють інженери техніки. Адже реалізація принципу безвідхідності дає змогу не тільки істотно збільшувати вихід кислоти, підвищувати ефективність виробництва, а й охороняти здоров 'я людей зберігати чистоту навколишнього середовища. | | Над проблемою повної утилізації та переробки відходів виробництва сульфатної кислоти нині працюють інженери техніки. Адже реалізація принципу безвідхідності дає змогу не тільки істотно збільшувати вихід кислоти, підвищувати ефективність виробництва, а й охороняти здоров 'я людей зберігати чистоту навколишнього середовища. |
| | | | |
| - | '''ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ ''' | + | '''ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ ''' |
| - | | + | |
| - | ''1. Напишіть рівняння реакцій, які відбуваються в процесі формування сульфатної кислоти в техніці. Обґрунтуйте оптимальні умови їх здійснення. ''
| + | |
| | | | |
| - | ''2. Поясніть терміни «моногідрат» і «олеум». '' | + | ''1. Напишіть рівняння реакцій, які відбуваються в процесі формування сульфатної кислоти в техніці. Обґрунтуйте оптимальні умови їх здійснення. '' |
| | | | |
| - | ''3. Як ви гадаєте, чому перед надходження суміші газів у контактний апарат її ретельно очищують? '' | + | ''2. Поясніть терміни «моногідрат» і «олеум». '' |
| | | | |
| - | ''4. Яку масу моногідрату можна добути з 5 т сірчаного колчедану, масова частка Сульфуру в якому 45%? '' | + | ''3. Як ви гадаєте, чому перед надходження суміші газів у контактний апарат її ретельно очищують? '' |
| | | | |
| - | ''5. Обчисліть масу розчину сульфатної кислоти з масовою часткою H<sub>2</sub>S0<sub>4</sub> 20 %, який можна добути з 50 кг олеуму з масовою часткою SO<sub>3</sub> 10 %.'' | + | ''4. Яку масу моногідрату можна добути з 5 т сірчаного колчедану, масова частка Сульфуру в якому 45%? '' |
| | | | |
| | + | ''5. Обчисліть масу розчину сульфатної кислоти з масовою часткою H<sub>2</sub>S0<sub>4</sub> 20 %, який можна добути з 50 кг олеуму з масовою часткою SO<sub>3</sub> 10 %.'' |
| | | | |
| | + | <br> |
| | | | |
| - | ''Н.М. Буринська, Л.П. Величко, [[Хімія_10_клас|Хімія, 10 клас ]]'' | + | ''Н.М. Буринська, Л.П. Величко, [[Хімія 10 клас|Хімія, 10 клас]]'' |
| | | | |
| | ''Вислано читачами з інтернет-сайтів '' | | ''Вислано читачами з інтернет-сайтів '' |
| | | | |
| - | <sub></sub> | + | <sub></sub> |
| | | | |
| | <sub>Планування уроків [[Хімія|з хімії]], відповіді на [[Гіпермаркет Знань - перший в світі!|тести]], завдання та відповіді по класам, домашнє завдання та робота [[Хімія 10 клас|з хімії для 10 класу]]</sub> | | <sub>Планування уроків [[Хімія|з хімії]], відповіді на [[Гіпермаркет Знань - перший в світі!|тести]], завдання та відповіді по класам, домашнє завдання та робота [[Хімія 10 клас|з хімії для 10 класу]]</sub> |
Версия 16:28, 20 августа 2012
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Застосування сульфатної кислоти і сульфатів
Застосування сульфатної кислоти і сульфатів
Сульфатна кислота є важливим продуктом хімічної промисловості. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у металургії в процесі добування міді, нікелю, урану та інших металів. Використовується також як осушувач газів.
Серед сульфатів велике практичне значення мають мідний і залізний купороси СuS04 • 5Н20 і FeS04 • 7Н20. Вони використовуються в сільському господарстві для боротьби із шкідниками рослин, у виробництві фарб, для просочення деревини як антисептичний засіб.
Купороси — технічна назва кристалогідратів сульфатів деяких важких металів (міді, заліза, цинку, нікелю), тобто це солі, кристали яких містять кристалізаційну воду.
Гіпс СаS04 • 2Н20 і сульфат кальцію СаS04 використовують у будівництві, медицині та інших галузях.
Сульфат натрію Na2S04 застосовують у виробництві скла. Він входить до складу природною мінералу Nа2S04 • 10Н2О глауберової солі, яка використовується в медицині як проносний засіб.
Сульфати калію К2S04 і амонію (NН4)2S04 використовують як добрива.
Сульфат барію ВаS04 застосовують у виробництві паперу, гуми та білої мінеральної фарби, а також у медицині для рентгеноскопії шлунку («Барієва каша»)
Найбільш сучасний спосіб добування сульфатної кислоти у промисловості — це контактний. Як сировина використовується пірит FeS2 (залізний, або сірчаний, колчедан.
Перша стадія процесу — випалювання колчедану і добування діоксиду сульфуру:
4FeS2 + 11О2 = 2Fe203 + 8S02↑; ΔH= -13476 кДж.
Цей процес відбувається у колчеданних печах, з яких виходить випалювальний газ. Він містить, окрім діоксиду сульфуру S02, ще кисень, азот, водяну пару та інші домшки. Його очищають, висушують і подають на другу стадію виробництва у контактний апарат.
Друга стадія — окиснення діоксиду сульфуру і добування триоксиду сульфуру:
V2O5
2S02 + 02 ⇔2SО3 ΔH = -197,9 кДж.
Окиснення відбувається в контактному апараті за наявності каталізатора і високої температури.
Але ви можете запитати, навіщо тут висока температура, якщо реакція екзотермічна. Адже ми знаємо, що згідно з принципом Ле Шательє зміщенню рівноваги у бік утворення S03 сприятимуть низька температура і високий тиск.
Це справедливо, але річ у тім, що високий тиск застосувати майже неможливо, бо S02 одразу перейде у рідкий стан. І низькі температури використати не можна, бо швидкість реакції буде надто малою. Тому й застосовують каталізатор V205, щоб пришвидшити процес, а каталізатор сам стає активним лише при 450 °С. Ось чому, незважаючи на екзотермічність реакції, використовують ще додаткове нагрівання. Теплоту, яка виділяється під час реакції, відводять і використовують для нагрівання випалювального газу, який встигає охолонути, проходячи складну систему очисних споруд перед надходженням у контактний апарат (див. схему виробництва сульфатної кислоти на вклейці).
Отже, процес окиснення S02 в S03 здійснюється склад но, бо ця реакція оборотна й екзотермічна. Умови її здійснення визначаються в основному згідно з принципом Ле Шательє.
• Сформулюйте принцип Ле Шательє так, як ви його розумієте. Яких умов окиснення S02 в S03 слід додержувати, щоб збільшити вихід триоксиду сульфуру? Обгрунтуйте ці умови.
Третя стадія виробництва — поглинання триоксиду сульфуру утворення сульфатної кислоти H2S04.
Добутий у контактному апараті триоксид сульфуру S03 надходить у поглинальну башту — абсорбер, де поглинається концентрованою сульфатною кислотою (масова частка H2S04 96—98 %). В абсорбері S03 взаємодіє з водою, що міститься у концентрованому розчині сульфатної кислоти, утворюючи безводну, 100 %-ву сульфатну кислоту, яка надається моногідратом:
S03 + Н20 = H2S04; ΔH = -130,6 кДж
Чистою водою поглинати триоксид сульфуру S03 не можна, оскільки утворюється дуже стійкий «туман» з дрібних крапель сульфатної кислоти, який погано конденсується.
Кінцевий продукт виробництва — олеум (розчин S03 у моногідраті). Його розбавляють водою до сульфатної кислоти потрібної концентрації.
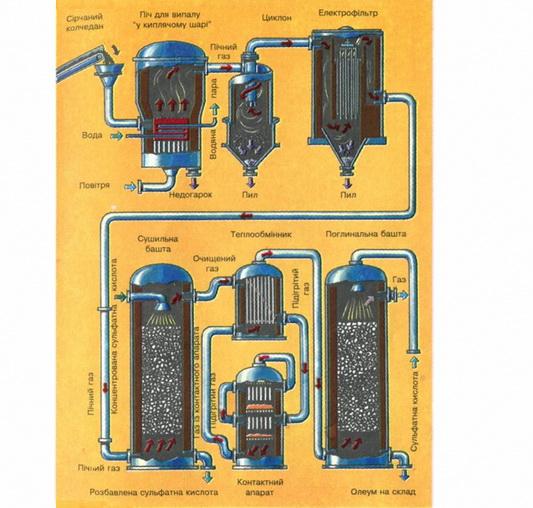
Мал. 1. Виробництво сульфатної кислоти
• Поясніть, як можна, виходячи з концентрованої сульфатної кислоти, дістати її розбавлений розчин. Обґрунтуйте дії, необхідні при цьому.
Охорона праці та навколишнього середовища у виробництві сульфатної кислоти
Захист біосфери від забруднення викидами хімічних виробництв — найважливіша проблема сучасності. У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду S02 і триоксиду сульфуру S03 та викидання їх в атмосферу, що спричинює кислотні дощі. Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців. Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття. Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.
Щоб запобігти утворенню кислотних дощів і забезпечити охорону здоров'я працівників, намагаються не допускати викидання оксиду сульфуру (ІV) S02 в атмосферу і в цехи заводу. З цією метою своєчасно ремонтують апаратуру, встановлюють фільтри, поглиначі, вентиляцію, суворо додержують технологічного режиму, використовують засоби індивідуального захисту працівників, удосконалюють й автоматизують виробничі процеси, герметизують устаткуваньня та апаратуру, впроваджують принцип безвідхідності та ефективні методи очищення відхідних газів. З них тепер вловлюють S02 і знову повертають його у виробництво. Застосовують також методи добування цінних побічних продуктів з промислових відходів.
Над проблемою повної утилізації та переробки відходів виробництва сульфатної кислоти нині працюють інженери техніки. Адже реалізація принципу безвідхідності дає змогу не тільки істотно збільшувати вихід кислоти, підвищувати ефективність виробництва, а й охороняти здоров 'я людей зберігати чистоту навколишнього середовища.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Напишіть рівняння реакцій, які відбуваються в процесі формування сульфатної кислоти в техніці. Обґрунтуйте оптимальні умови їх здійснення.
2. Поясніть терміни «моногідрат» і «олеум».
3. Як ви гадаєте, чому перед надходження суміші газів у контактний апарат її ретельно очищують?
4. Яку масу моногідрату можна добути з 5 т сірчаного колчедану, масова частка Сульфуру в якому 45%?
5. Обчисліть масу розчину сульфатної кислоти з масовою часткою H2S04 20 %, який можна добути з 50 кг олеуму з масовою часткою SO3 10 %.
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Вислано читачами з інтернет-сайтів
Планування уроків з хімії, відповіді на тести, завдання та відповіді по класам, домашнє завдання та робота з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











