|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Масса атома, Относительная атомная масса</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Масса атома, Относительная атомная масса, атомы, Оксиген, элемент, периодической системе, газы</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Масса атома. Относительная атомная масса<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Масса атома. Относительная атомная масса<br> ''' |
| | | | |
| - | <br> Тут будет текст | + | <br> '''Масса атома. Относительная атомная масса'''<br><br><u>'''Материал параграфа поможет вам выяснить:'''</u> |
| | | | |
| | + | ''> в чем различие между массой атома и относительной [[Атомна одиниця маси. Відносна атомна маса хімічних елементів|'''атомной массой''']];<br>> почему удобно пользоваться относительными атомными массами;<br>> где найти значение относительной атомной массы элемента.''<br><br><u>'''Это интересно'''</u> |
| | | | |
| | + | Масса электрона составляет приблизительно 9 • 10 <sup>-28</sup> г.<br><br><u>'''Масса атома. '''</u> |
| | | | |
| - | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' | + | Важной характеристикой атома является его масса. Почти вся масса атома сконцентрирована в ядре. Электроны имеют настолько малую массу, что ею обычно пренебрегают. |
| | + | |
| | + | Взвесить '''[[42. Будова атома: ядро і електронна оболонка. Склад атомних ядер. Протонне число. Нуклонне число. Сучасне формулювання періодичного закону|атомы]]''' на весах невозможно, поскольку они чрезвычайно малы. Их массы были определены с помощью расчетов. |
| | + | |
| | + | Масса атома Урана — самого тяжелого среди всех атомов, которые встречаются на Земле, составляет приблизительно <br><br>'''0,000 000 000 000 000 000 000 4 г.'''<br><br>Записывать и читать это число непросто; можно ошибиться, пропустив ноль или добавив лишний. Существует другой способ его записи — в виде произведения: 4 • 10<sup>-22 </sup> (22 — количество нулей в предыдущем числе)<sup>1</sup>. |
| | + | |
| | + | Точное значение массы атома Урана — 3,952 • 10<sup>-22</sup> г, а атома Гидрогена, самого легкого среди всех атомов, — 1,673 • 10 <sup>-24</sup> г. |
| | + | |
| | + | Оперировать очень малыми числами неудобно. Поэтому вместо «абсолютных» масс атомов используют их относительные массы.<br><br><u>'''Относительная атомная масса.'''</u> |
| | + | |
| | + | О массе любого атома можно судить, сравнивая ее с массой друго атома. Раньше для сравнения брали самый легкий атом — атом Гидрогена. Сейчас массы атомов |
| | + | |
| | + | ''<sup>1</sup> Подробно о записи таких чисел вы узнаете на уроках алгебры в старших классах.''<br><br><u>'''Это интересно'''</u> |
| | + | |
| | + | До 1961 г. массы атомов сравнивали с 1/16 массы атома [[Відео до уроку: Поширеність та колообіг Оксигену в природі. Застосування кисню, його біологічна роль|'''Оксигена''']]. |
| | + | |
| | + | сравнивают с 1/12 — массы атома Карбона (он почти в 12 раз тяжелее атома Гидрогена). Эту маленькую массу назвали атомной единицей массы (сокращенно — а. е. м.):<br><br>1 а. е. м. = 1/12m<sub>a</sub>(С) = 1/12 • 1,994 • 10<sup>-23</sup> г = 1,662 • 10<sup>-24</sup> г.<br><br>Масса атома Гидрогена почти совпадает с атомной единицей массы: m<sub>а</sub>(Н)~ 1а. е. м. Масса атома Урана больше ее в<br><br>[[Image:18.09-012.jpg|180px|Формула]]<br><br>То есть<br>m<sub>a</sub>(U) ~ 238 а. е. м.<br><br>Число, которое получают делением массы атома элемента на атомную единицу массы, называют относительной атомной массой элемента. Эту величину обозначают A <sub>r</sub>(E):<br><br>[[Image:18.09-013.jpg|240px|Формула]]<br><br>Индекс возле буквы А — первая буква в латинском слове relativus — относительный. |
| | + | |
| | + | Относительная атомная масса элемента показывает, во сколько раз масса атома '''[[Презентація уроку «Атоми, молекули, йони. Хімічні елементи, їхні назви і символи»|элемента]]''' больше 1/12 массы атома Карбона.<br><br>'''m<sub>а</sub>(Н) = 1,673 • 10 <sup>-2</sup>4 г''' |
| | + | |
| | + | '''m<sub>a</sub>(H)= 1 а. е. м.''' |
| | + | |
| | + | '''A<sub>r</sub>(H) = 1'''<br><br>Относительная атомная масса элемента не имеет размерности. |
| | + | |
| | + | Первую таблицу относительных атомных масс составил почти 200 лет назад английский ученый Дж. Дальтон. |
| | + | |
| | + | На основании изложенного материала можно сделать такие выводы: |
| | + | |
| | + | • относительные атомные массы пропорциональны массам атомов;<br>• соотношения масс атомов такие же, как и относительных атомных масс. |
| | + | |
| | + | Значения относительных атомных масс химических элементов записаны в [[Перiодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Будова атома і види хімічного зв’язку.|'''периодической системе''']]. <br>'''<br>Джон Дальтон (1766— 1844)'''<br><br>[[Image:18.09-014.jpg|180px|Джон Дальтон]]<br><br>Выдающийся английский [http://xvatit.com/vuzi/ '''физик'''] и химик. Член Лондонского королевского общества (Английской академии наук). Первым выдвинул гипотезу о разных массах и размерах атомов, определил относительные атомные массы многих элементов и составил первую таблицу их значений (1803). Предложил символы элементов и обозначения химических соединений. |
| | + | |
| | + | Сделав свыше 200 000 метеорологических наблюдений, изучив состав и свойства воздуха, открыл законы парциальных (частичных) давлений [[8. Відносна густина газів|'''газов''']]''' ''' (1801), теплового расширения газов (1802), растворимости газов в жидкостях (1803).<br><br>[[Image:18.09-015.jpg|180px|Клетка элемента Урана]]<br>''Рис. 35. Клетка элемента Урана''<br><br>Они определены с очень высокой точностью; соответствующие числа являются в основном пяти- и шестизначными (рис. 35). |
| | + | |
| | + | В обычных химических расчетах значения относительных атомных масс принято округлять до целых чисел. Так, для Гидрогена и Урана<br><br>A<sub>r</sub>(H) = 1,0079 ~ 1;<br>A<sub>r</sub>(U) = 238,029 ~ 238.<br><br>Лишь значение относительной атомной массы Хлора округляют до десятых:<br><br>A<sub>r</sub>(Cl) = 35,453 ~ 35,5.<br><br>► Найдите в периодической системе значения относительных атомных масс Лития, Карбона, Оксигена, Неона и округлите их до целых чисел. |
| | + | |
| | + | ► Во сколько раз массы атомов Карбона, Оксигена, Неона и Магния больше массы атома Гелия? Для вычислений используйте округленные значения относительных атомных масс. |
| | + | |
| | + | '''Обратите внимание''': элементы размещены в пeриодической системе в порядке возрастания атомных масс.<br><br><u>'''Выводы'''</u> |
| | + | |
| | + | Атомы имеют чрезвычайно малую массу. |
| | + | |
| | + | Для удобства вычислений используют относительные массы атомов. |
| | + | |
| | + | Относительная атомная масса элемента является отношением массы атома элемента к — массы атома Карбона. |
| | + | |
| | + | Значения относительных атомных масс указаны в периодической системе химических элементов.<br><br>'''?'''<br>''48. В чем различие между понятиями «масса атома» и относительная атомная масса»?<br>49. Что такое атомная единица массы?<br>50. Что означают записи A<sub>r</sub> и A<sub>r</sub>?<br>51. Какой атом легче — Карбона или Титана? Во сколько раз?<br>52. Что имеет большую массу: атом Флуора или два атома Лития; два атома Магния или три атома Сульфура?<br>53. Найдите в периодической системе три-четыре пары элементов, соотношение масс атомов которых составляет: а) 1 : 2; б) 1 : 3.<br>54. Вычислите относительную атомную массу Гелия, если масса атома этого элемента равна 6,647 - 10<sup>-24</sup> г.<br>55. Рассчитайте массу атома Бериллия.'' |
| | + | |
| | + | <br> |
| | + | |
| | + | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
Текущая версия на 10:12, 18 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Масса атома. Относительная атомная масса
Масса атома. Относительная атомная масса
Материал параграфа поможет вам выяснить:
> в чем различие между массой атома и относительной атомной массой;
> почему удобно пользоваться относительными атомными массами;
> где найти значение относительной атомной массы элемента.
Это интересно
Масса электрона составляет приблизительно 9 • 10 -28 г.
Масса атома.
Важной характеристикой атома является его масса. Почти вся масса атома сконцентрирована в ядре. Электроны имеют настолько малую массу, что ею обычно пренебрегают.
Взвесить атомы на весах невозможно, поскольку они чрезвычайно малы. Их массы были определены с помощью расчетов.
Масса атома Урана — самого тяжелого среди всех атомов, которые встречаются на Земле, составляет приблизительно
0,000 000 000 000 000 000 000 4 г.
Записывать и читать это число непросто; можно ошибиться, пропустив ноль или добавив лишний. Существует другой способ его записи — в виде произведения: 4 • 10-22 (22 — количество нулей в предыдущем числе)1.
Точное значение массы атома Урана — 3,952 • 10-22 г, а атома Гидрогена, самого легкого среди всех атомов, — 1,673 • 10 -24 г.
Оперировать очень малыми числами неудобно. Поэтому вместо «абсолютных» масс атомов используют их относительные массы.
Относительная атомная масса.
О массе любого атома можно судить, сравнивая ее с массой друго атома. Раньше для сравнения брали самый легкий атом — атом Гидрогена. Сейчас массы атомов
1 Подробно о записи таких чисел вы узнаете на уроках алгебры в старших классах.
Это интересно
До 1961 г. массы атомов сравнивали с 1/16 массы атома Оксигена.
сравнивают с 1/12 — массы атома Карбона (он почти в 12 раз тяжелее атома Гидрогена). Эту маленькую массу назвали атомной единицей массы (сокращенно — а. е. м.):
1 а. е. м. = 1/12ma(С) = 1/12 • 1,994 • 10-23 г = 1,662 • 10-24 г.
Масса атома Гидрогена почти совпадает с атомной единицей массы: mа(Н)~ 1а. е. м. Масса атома Урана больше ее в
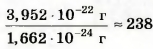
То есть
ma(U) ~ 238 а. е. м.
Число, которое получают делением массы атома элемента на атомную единицу массы, называют относительной атомной массой элемента. Эту величину обозначают A r(E):
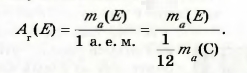
Индекс возле буквы А — первая буква в латинском слове relativus — относительный.
Относительная атомная масса элемента показывает, во сколько раз масса атома элемента больше 1/12 массы атома Карбона.
mа(Н) = 1,673 • 10 -24 г
ma(H)= 1 а. е. м.
Ar(H) = 1
Относительная атомная масса элемента не имеет размерности.
Первую таблицу относительных атомных масс составил почти 200 лет назад английский ученый Дж. Дальтон.
На основании изложенного материала можно сделать такие выводы:
• относительные атомные массы пропорциональны массам атомов;
• соотношения масс атомов такие же, как и относительных атомных масс.
Значения относительных атомных масс химических элементов записаны в периодической системе.
Джон Дальтон (1766— 1844)

Выдающийся английский физик и химик. Член Лондонского королевского общества (Английской академии наук). Первым выдвинул гипотезу о разных массах и размерах атомов, определил относительные атомные массы многих элементов и составил первую таблицу их значений (1803). Предложил символы элементов и обозначения химических соединений.
Сделав свыше 200 000 метеорологических наблюдений, изучив состав и свойства воздуха, открыл законы парциальных (частичных) давлений газов (1801), теплового расширения газов (1802), растворимости газов в жидкостях (1803).
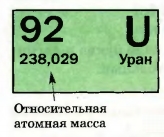
Рис. 35. Клетка элемента Урана
Они определены с очень высокой точностью; соответствующие числа являются в основном пяти- и шестизначными (рис. 35).
В обычных химических расчетах значения относительных атомных масс принято округлять до целых чисел. Так, для Гидрогена и Урана
Ar(H) = 1,0079 ~ 1;
Ar(U) = 238,029 ~ 238.
Лишь значение относительной атомной массы Хлора округляют до десятых:
Ar(Cl) = 35,453 ~ 35,5.
► Найдите в периодической системе значения относительных атомных масс Лития, Карбона, Оксигена, Неона и округлите их до целых чисел.
► Во сколько раз массы атомов Карбона, Оксигена, Неона и Магния больше массы атома Гелия? Для вычислений используйте округленные значения относительных атомных масс.
Обратите внимание: элементы размещены в пeриодической системе в порядке возрастания атомных масс.
Выводы
Атомы имеют чрезвычайно малую массу.
Для удобства вычислений используют относительные массы атомов.
Относительная атомная масса элемента является отношением массы атома элемента к — массы атома Карбона.
Значения относительных атомных масс указаны в периодической системе химических элементов.
?
48. В чем различие между понятиями «масса атома» и относительная атомная масса»?
49. Что такое атомная единица массы?
50. Что означают записи Ar и Ar?
51. Какой атом легче — Карбона или Титана? Во сколько раз?
52. Что имеет большую массу: атом Флуора или два атома Лития; два атома Магния или три атома Сульфура?
53. Найдите в периодической системе три-четыре пары элементов, соотношение масс атомов которых составляет: а) 1 : 2; б) 1 : 3.
54. Вычислите относительную атомную массу Гелия, если масса атома этого элемента равна 6,647 - 10-24 г.
55. Рассчитайте массу атома Бериллия.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|