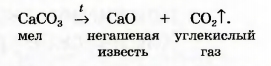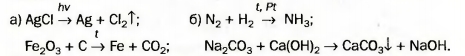|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Схема химической реакции, Закон сохранения массы вещества при химической реакции, Химическое уравнение</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Схема химической реакции, Закон сохранения массы вещества при химической реакции, Химическое уравнение, молекулы, вещества, химические элементы, масса</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Схема химической реакции. Закон сохранения массы вещества при химической реакции. Химическое уравнение<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Схема химической реакции. Закон сохранения массы вещества при химической реакции. Химическое уравнение<br> ''' |
| | | | |
| - | <br> Тут будет текст | + | <br> '''Схема химической реакции. Закон сохранения массы веществ при химической реакции. Химическое уравнение'''<br><br><u>'''Материал параграфа поможет вам:'''</u> |
| | | | |
| | + | ''> выяснить, что такое схема химической реакции;<br>> понять суть закона сохранения массы веществ при химической реакции;<br>> превращать схемы реакций в '''[[Хiмічні рівняння|химические уравнения]]'''.''<br><br><u>'''Схема химической реакции.'''</u> |
| | | | |
| | + | Существует несколько способов записи химических реакций. Co «словесной» схемой реакции вы ознакомились в § 13. |
| | | | |
| - | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' | + | Приводим еще один пример: |
| | + | |
| | + | '''сера + кислород —> сернистый газ.''' |
| | + | |
| | + | Эта запись дает мало [http://xvatit.com/it/fishki-ot-itshki/ '''информации''']; она не указывает на химический состав реагентов и продуктов. |
| | + | |
| | + | Этого недостатка лишен другой способ записи — химическая схема реакции. В ней вместо названий веществ содержатся химические формулы<sup>1</sup>: |
| | + | |
| | + | '''S + O<sub>2</sub> —> SO<sub>2</sub>.''' |
| | + | |
| | + | Химическую схему в дальнейшем будем называть просто схемой реакции. |
| | + | |
| | + | Над стрелкой часто указывают условия, при которых происходит реакция: нагревание [[Image:19.09-01.jpg]], повышенное давление [[Image:19.09-02.jpg]], освещение [[Image:19.09-03.jpg]], наличие дополнительных веществ [[Image:19.09-04.jpg]]. |
| | + | |
| | + | ''<sup>1</sup>Для серы здесь и далее будем использовать формулу S, а не Ss, которую в действительности имеют [[Тема 34. Тіла, речовини , молекули|'''молекулы''']] вещества.'' |
| | + | |
| | + | Если продуктом реакции является газ, то после его формулы записывают стрелку, направленную вверх [[Image:19.09-05.jpg]], а если образуется осадок, — стрелку, направленную вниз [[Image:19.09-06.jpg]]. В случаях, когда и продукт, и реагент — газы или нерастворимые '''[[Відео до уроку: Речовини. Чисті речовини і суміші|вещества]]''', вертикальные стрелки не ставят. Иногда под формулами реагентов и продуктов пишут их названия. |
| | + | |
| | + | Пример схемы реакции с дополнительными обозначениями и названиями веществ:<br><br>[[Image:19.09-07.jpg|320px|Пример схемы реакции]]<br><br>Вам необходимо научиться не только записывать схемы реакций, но и комментировать их. Последнюю схему реакции комментируют так: при нагревании мела образуются негашеная известь и углекислый газ. |
| | + | |
| | + | ► Какими химическими элементами образовано исходное вещество и продукты этой реакции? |
| | + | |
| | + | Схема реакции дает возможность сделать важный вывод: все '''[[Презентація уроку «Атоми, молекули, йони. Хімічні елементи, їхні назви і символи»|химические элементы]]''' во время реакции сохраняются.<br><u>'''<br>Закон сохранения массы веществ при химической реакции. '''</u> |
| | + | |
| | + | Общеизвестно, что после сжигания бумаги остается пепел, масса которого намного меньше массы бумаги. Если же сильно нагревать (прокаливать) порошок меди или медный предмет на воздухе, то обнаружим противоположное масса вещества будет возрастать (металл покроется черным налетом). |
| | + | |
| | + | Осуществим оба химических превращения в закрытых сосудах. Результаты опытов будут другими. Взвесив закрытые сосуды с веществами до и после каждого эксперимента, обнаружим, что суммарная масса веществ в результате реакций неизменяется. Это впервые установил в середине XVIII в. русский ученый М. В. Ломоносов. He зная об открытии Ломоносова, к аналогичному выводу пришел в 1789 г. французский ученый А.-Л. Лавуазье.<br><br><u>'''Это интересно'''</u><br><br>[[Image:19.09-08.jpg|240px|Пример схемы реакции]]<br><br>'''Михаил Васильевич Ломоносов (1711—1765)''' |
| | + | |
| | + | <br>[[Image:19.09-09.jpg|180px|Михаил Васильевич Ломоносов]]<br><br>Выдающийся русский ученый, первый русский академик Петербургской академии наук. Разработал одну из теорий строения веществ (40-е годы XVIII в.). Открыл и сформулировал законы сохранения массы веществ и движения (1748— 1760). Изучал химические свойства металлов, анализировал состав минералов, разработал способы получения минеральных красок, цветного стекла. Внес существенный вклад в развитие «химического языка». Автор книг по истории России, поэт, художник, геолог, географ, инженер, педагог. Один из основателей первого в России Московского [http://xvatit.com/vuzi/ '''университета''']. |
| | + | |
| | + | Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Он формулируется так: |
| | + | |
| | + | масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. |
| | + | |
| | + | Объясним, почему [[Відносна молекулярна маса речовини, її обчислення за хiмічною формулою|'''массы''']] пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания. |
| | + | |
| | + | В процессе горения бумаги принимает участие кислород, который содержится в воздухе (рис. 48, а). |
| | + | |
| | + | Следовательно, в реакцию вступают два вещества. Кроме пепла, образуются углекислый газ и вода (в виде пара), которые попадают в воздух и рассеиваются. |
| | + | |
| | + | <br>[[Image:19.09-010.jpg|550px|Реакции бумаги (а) и меди (б) с кислородом]]<br>''Рис. 48. Реакции бумаги (а) и меди (б) с кислородом''<br><br>'''Антуан-Лоран Лавуазье (1743—1794)''' |
| | + | |
| | + | [[Image:19.09-011.jpg|180px|Антуан-Лоран Лавуазье]] |
| | + | |
| | + | Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение — это реакция вещества с кислородом, а вода — соединение Гидрогена с Оксигеном (1774— 1777). |
| | + | |
| | + | Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химических реакциях.<br><br>[[Image:19.09-012.jpg|550px|Опыт, подтверждающий закон Ломоносова — Лавуазье:а — начало опыта; б — окончание опыта]]<br>''Рис. 49. Опыт, подтверждающий закон Ломоносова — Лавуазье:а — начало опыта; б — окончание опыта''<br><br>Их масса превышает массу кислорода. Поэтому масса пепла меньше массы бумаги. |
| | + | |
| | + | При нагревании меди кислород воздуха «соединяется» с ней (рис. 48, б). Металл превращается в вещество черного цвета (его формула — CuO, а на звание — купрум(П) оксид). Очевидно, что масса продукта реакции должна превышать массу меди. |
| | + | |
| | + | ► Прокомментируйте опыт, изображенный на рисунке 49, и сделайте вывод.<br><br><u>'''Закон как форма научных знаний. '''</u> |
| | + | |
| | + | Открытие законов в химии, физике, других науках происходит после проведения учеными многих экспериментов и анализа полученных результатов. |
| | + | |
| | + | Закон — это обобщение объективных, независимых от человека связей между явлениями, свойствами и т. д. |
| | + | |
| | + | Закон сохранения массы веществ при химической реакции — важнейший закон химии. Он распространяется на все превращения веществ, которые происходят и в лаборатории, и в природе. |
| | + | |
| | + | Химические законы дают возможность прогнозировать свойства веществ и протекание химических реакций, регулировать процессы в химической технологии. |
| | + | |
| | + | Для того чтобы объяснить закон, выдвигают гипотезы, которые проверяют с помощью соответствующих экспериментов. Если одна из гипотез подтверждается, на ее основе создают теорию. В старших классах вы ознакомитесь с несколькими теориями, которые разработали ученые-химики.<br><br><u>'''Химическое уравнение. '''</u> |
| | + | |
| | + | Общая масса веществ при химической реакции не изменяется потому, что атомы химических элементов во время реакции не возникают и не исчезают, а происходит только их перегруппировка. Другими словами, <br>количество атомов каждого элемента до реакции равно количеству его атомов после реакции. На это указывают схемы реакций, приведенные в начале параграфа. Заменим в них стрелки между левыми и правыми частями на знаки равенства:<br><br>[[Image:19.09-013.jpg|320px|Химическое уравнение]]<br><br>Такие записи называют химическими уравнениями. |
| | + | |
| | + | '''Химическое уравнение — это запись химической реакции с помощью формул реагентов и продуктов, которая согласуется с законом сохранения массы веществ.''' |
| | + | |
| | + | Существует много схем реакций^ которые не соответствуют закону Ломоносова — Лавуазье. |
| | + | |
| | + | Например, схема реакции образования воды: |
| | + | |
| | + | '''H<sub>2</sub> + O<sub>2 </sub>—> H<sub>2</sub>O.''' |
| | + | |
| | + | В обеих частях схемы содержится одинаковое количество атомов Гидрогена, но разное количество атомов Оксигена. |
| | + | |
| | + | Превратим эту схему в химическое уравнение. |
| | + | |
| | + | Для того чтобы в правой части было 2 атома Оксигена, поставим перед формулой воды коэффициент 2:<br> |
| | + | |
| | + | '''H<sub>2</sub> + O<sub>2 </sub>—> H<sub>2</sub>O.''' |
| | + | |
| | + | Теперь справа стало четыре атома Гидрогена. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение: |
| | + | |
| | + | '''2Н<sub>2</sub> + O<sub>2</sub> = 2Н<sub>2</sub>0.''' |
| | + | |
| | + | Таким образом, чтобы превратить схему реак ции в химическое уравнение, нужно подобрать коэффициенты для каждого вещества ( в случае необходимости), записать их перед химическими формулами и заменить стрелку на знак равенства. |
| | + | |
| | + | Возможно, кто-то из вас составит такое уравнение: 4Н<sub>2</sub> + 20<sub>2</sub> = 4Н<sub>2</sub>0. В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать.<br><br><u>'''Это интересно'''</u> |
| | + | |
| | + | Химическое уравнение имеет много общего с математическим. |
| | + | |
| | + | Ниже представлены различные способы записи рассмотренной реакции.<br><br>[[Image:19.09-014.jpg|550px|Различные способы записи рассмотренной реакции]]<br><br>► Превратите схему реакции Cu + O<sub>2</sub> —> CuO в химическое уравнение. |
| | + | |
| | + | Выполним более сложное задание: превратим в химическое уравнение схему реакции |
| | + | |
| | + | [[Image:19.09-015.jpg|240px|Химическое уравнение]] |
| | + | |
| | + | В левой части схемы — I атом Алюминия, а в правой — 2. Поставим перед формулой металла коэффициент 2: |
| | + | |
| | + | [[Image:19.09-016.jpg|240px|Химическое уравнение]] |
| | + | |
| | + | Атомов Сульфура справа в три раза больше, чем слева. Запишем в левой части перед формулой соединения Сульфура коэффициент 3: |
| | + | |
| | + | [[Image:19.09-017.jpg|240px|Химическое уравнение]] |
| | + | |
| | + | Теперь в левой части количество атомов Гидрогена равно 3 • 2 = 6, а в правой — только 2. Для того чтобы и справа их было 6, поставим перед формулой водорода коэффициент 3 (6 : 2 = 3): |
| | + | |
| | + | [[Image:19.09-018.jpg|240px|Химическое уравнение]] |
| | + | |
| | + | Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 3 • 4 = 4 * 3. Заменим стрелку на знак равенства: |
| | + | |
| | + | [[Image:19.09-019.jpg|240px|Химическое уравнение]]<br><br><u>'''Выводы'''</u> |
| | + | |
| | + | Химические реакции записывают с помощью схем реакций и химических уравнений. |
| | + | |
| | + | Схема реакции содержит формулы реагентов и продуктов, а химическое уравнение — еще и коэффициенты. |
| | + | |
| | + | Химическое уравнение согласуется с законом сохранения массы веществ Ломоносова — Лавуазье: |
| | + | |
| | + | масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. |
| | + | |
| | + | Атомы химических элементов во время реакций не появляются и не исчезают, а происходит лишь их перегруппировка.<br><br>'''?'''<br>''105. Чем отличается химическое уравнение от схемы реакции?'' |
| | + | |
| | + | ''106. Расставьте пропущенные коэффициенты в записях реакций:'' |
| | + | |
| | + | ''[[Image:19.09-020.jpg|480px|Химическое уравнение]]'' |
| | + | |
| | + | ''107. Превратите в химические уравнения такие схемы реакций:'' |
| | + | |
| | + | ''[[Image:19.09-021.jpg|480px|Химическое уравнение]]'' |
| | + | |
| | + | ''108. Составьте формулы продуктов реакций и соответствующие химические уравнения:'' |
| | + | |
| | + | ''[[Image:19.09-022.jpg|480px|Химическое уравнение]]'' |
| | + | |
| | + | ''109. Вместо точек запишите формулы простых веществ и составьте хими ческие уравнения:'' |
| | + | |
| | + | ''[[Image:19.09-023.jpg|480px|Химическое уравнение]]'' |
| | + | |
| | + | ''Примите во внимание, что бор и углерод состоят из атомов; фтор, хлор, водород и кислород — из двухатомных молекул, а фосфор (белый) — из четырехатомных молекул.'' |
| | + | |
| | + | ''110. Прокомментируйте схемы реакций и превратите их в химические уравнения:'' |
| | + | |
| | + | ''[[Image:19.09-024.jpg|480px|Химическое уравнение]]'' |
| | + | |
| | + | ''111. Какая масса негашеной извести образовалась при длительном прока ливании 25 г мела, если известно, что выделилось 11 г углекислого газа?'' |
| | + | |
| | + | <br> |
| | + | |
| | + | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
Текущая версия на 10:01, 19 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Схема химической реакции. Закон сохранения массы вещества при химической реакции. Химическое уравнение
Схема химической реакции. Закон сохранения массы веществ при химической реакции. Химическое уравнение
Материал параграфа поможет вам:
> выяснить, что такое схема химической реакции;
> понять суть закона сохранения массы веществ при химической реакции;
> превращать схемы реакций в химические уравнения.
Схема химической реакции.
Существует несколько способов записи химических реакций. Co «словесной» схемой реакции вы ознакомились в § 13.
Приводим еще один пример:
сера + кислород —> сернистый газ.
Эта запись дает мало информации; она не указывает на химический состав реагентов и продуктов.
Этого недостатка лишен другой способ записи — химическая схема реакции. В ней вместо названий веществ содержатся химические формулы1:
S + O2 —> SO2.
Химическую схему в дальнейшем будем называть просто схемой реакции.
Над стрелкой часто указывают условия, при которых происходит реакция: нагревание  , повышенное давление , повышенное давление  , освещение , освещение  , наличие дополнительных веществ , наличие дополнительных веществ  . .
1Для серы здесь и далее будем использовать формулу S, а не Ss, которую в действительности имеют молекулы вещества.
Если продуктом реакции является газ, то после его формулы записывают стрелку, направленную вверх  , а если образуется осадок, — стрелку, направленную вниз , а если образуется осадок, — стрелку, направленную вниз  . В случаях, когда и продукт, и реагент — газы или нерастворимые вещества, вертикальные стрелки не ставят. Иногда под формулами реагентов и продуктов пишут их названия. . В случаях, когда и продукт, и реагент — газы или нерастворимые вещества, вертикальные стрелки не ставят. Иногда под формулами реагентов и продуктов пишут их названия.
Пример схемы реакции с дополнительными обозначениями и названиями веществ:
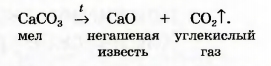
Вам необходимо научиться не только записывать схемы реакций, но и комментировать их. Последнюю схему реакции комментируют так: при нагревании мела образуются негашеная известь и углекислый газ.
► Какими химическими элементами образовано исходное вещество и продукты этой реакции?
Схема реакции дает возможность сделать важный вывод: все химические элементы во время реакции сохраняются.
Закон сохранения массы веществ при химической реакции.
Общеизвестно, что после сжигания бумаги остается пепел, масса которого намного меньше массы бумаги. Если же сильно нагревать (прокаливать) порошок меди или медный предмет на воздухе, то обнаружим противоположное масса вещества будет возрастать (металл покроется черным налетом).
Осуществим оба химических превращения в закрытых сосудах. Результаты опытов будут другими. Взвесив закрытые сосуды с веществами до и после каждого эксперимента, обнаружим, что суммарная масса веществ в результате реакций неизменяется. Это впервые установил в середине XVIII в. русский ученый М. В. Ломоносов. He зная об открытии Ломоносова, к аналогичному выводу пришел в 1789 г. французский ученый А.-Л. Лавуазье.
Это интересно
Михаил Васильевич Ломоносов (1711—1765)

Выдающийся русский ученый, первый русский академик Петербургской академии наук. Разработал одну из теорий строения веществ (40-е годы XVIII в.). Открыл и сформулировал законы сохранения массы веществ и движения (1748— 1760). Изучал химические свойства металлов, анализировал состав минералов, разработал способы получения минеральных красок, цветного стекла. Внес существенный вклад в развитие «химического языка». Автор книг по истории России, поэт, художник, геолог, географ, инженер, педагог. Один из основателей первого в России Московского университета.
Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Он формулируется так:
масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Объясним, почему массы пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания.
В процессе горения бумаги принимает участие кислород, который содержится в воздухе (рис. 48, а).
Следовательно, в реакцию вступают два вещества. Кроме пепла, образуются углекислый газ и вода (в виде пара), которые попадают в воздух и рассеиваются.
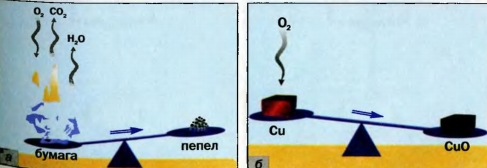
Рис. 48. Реакции бумаги (а) и меди (б) с кислородом
Антуан-Лоран Лавуазье (1743—1794)

Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение — это реакция вещества с кислородом, а вода — соединение Гидрогена с Оксигеном (1774— 1777).
Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химических реакциях.

Рис. 49. Опыт, подтверждающий закон Ломоносова — Лавуазье:а — начало опыта; б — окончание опыта
Их масса превышает массу кислорода. Поэтому масса пепла меньше массы бумаги.
При нагревании меди кислород воздуха «соединяется» с ней (рис. 48, б). Металл превращается в вещество черного цвета (его формула — CuO, а на звание — купрум(П) оксид). Очевидно, что масса продукта реакции должна превышать массу меди.
► Прокомментируйте опыт, изображенный на рисунке 49, и сделайте вывод.
Закон как форма научных знаний.
Открытие законов в химии, физике, других науках происходит после проведения учеными многих экспериментов и анализа полученных результатов.
Закон — это обобщение объективных, независимых от человека связей между явлениями, свойствами и т. д.
Закон сохранения массы веществ при химической реакции — важнейший закон химии. Он распространяется на все превращения веществ, которые происходят и в лаборатории, и в природе.
Химические законы дают возможность прогнозировать свойства веществ и протекание химических реакций, регулировать процессы в химической технологии.
Для того чтобы объяснить закон, выдвигают гипотезы, которые проверяют с помощью соответствующих экспериментов. Если одна из гипотез подтверждается, на ее основе создают теорию. В старших классах вы ознакомитесь с несколькими теориями, которые разработали ученые-химики.
Химическое уравнение.
Общая масса веществ при химической реакции не изменяется потому, что атомы химических элементов во время реакции не возникают и не исчезают, а происходит только их перегруппировка. Другими словами,
количество атомов каждого элемента до реакции равно количеству его атомов после реакции. На это указывают схемы реакций, приведенные в начале параграфа. Заменим в них стрелки между левыми и правыми частями на знаки равенства:

Такие записи называют химическими уравнениями.
Химическое уравнение — это запись химической реакции с помощью формул реагентов и продуктов, которая согласуется с законом сохранения массы веществ.
Существует много схем реакций^ которые не соответствуют закону Ломоносова — Лавуазье.
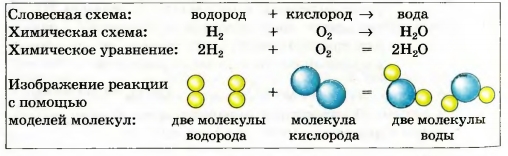
Например, схема реакции образования воды:
H2 + O2 —> H2O.
В обеих частях схемы содержится одинаковое количество атомов Гидрогена, но разное количество атомов Оксигена.
Превратим эту схему в химическое уравнение.
Для того чтобы в правой части было 2 атома Оксигена, поставим перед формулой воды коэффициент 2:
H2 + O2 —> H2O.
Теперь справа стало четыре атома Гидрогена. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение:
2Н2 + O2 = 2Н20.
Таким образом, чтобы превратить схему реак ции в химическое уравнение, нужно подобрать коэффициенты для каждого вещества ( в случае необходимости), записать их перед химическими формулами и заменить стрелку на знак равенства.
Возможно, кто-то из вас составит такое уравнение: 4Н2 + 202 = 4Н20. В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать.
Это интересно
Химическое уравнение имеет много общего с математическим.
Ниже представлены различные способы записи рассмотренной реакции.
► Превратите схему реакции Cu + O2 —> CuO в химическое уравнение.
Выполним более сложное задание: превратим в химическое уравнение схему реакции

В левой части схемы — I атом Алюминия, а в правой — 2. Поставим перед формулой металла коэффициент 2:
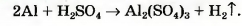
Атомов Сульфура справа в три раза больше, чем слева. Запишем в левой части перед формулой соединения Сульфура коэффициент 3:
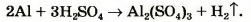
Теперь в левой части количество атомов Гидрогена равно 3 • 2 = 6, а в правой — только 2. Для того чтобы и справа их было 6, поставим перед формулой водорода коэффициент 3 (6 : 2 = 3):
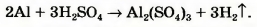
Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 3 • 4 = 4 * 3. Заменим стрелку на знак равенства:
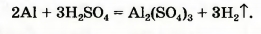
Выводы
Химические реакции записывают с помощью схем реакций и химических уравнений.
Схема реакции содержит формулы реагентов и продуктов, а химическое уравнение — еще и коэффициенты.
Химическое уравнение согласуется с законом сохранения массы веществ Ломоносова — Лавуазье:
масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Атомы химических элементов во время реакций не появляются и не исчезают, а происходит лишь их перегруппировка.
?
105. Чем отличается химическое уравнение от схемы реакции?
106. Расставьте пропущенные коэффициенты в записях реакций:

107. Превратите в химические уравнения такие схемы реакций:

108. Составьте формулы продуктов реакций и соответствующие химические уравнения:

109. Вместо точек запишите формулы простых веществ и составьте хими ческие уравнения:

Примите во внимание, что бор и углерод состоят из атомов; фтор, хлор, водород и кислород — из двухатомных молекул, а фосфор (белый) — из четырехатомных молекул.
110. Прокомментируйте схемы реакций и превратите их в химические уравнения:
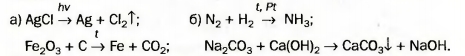
111. Какая масса негашеной извести образовалась при длительном прока ливании 25 г мела, если известно, что выделилось 11 г углекислого газа?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|