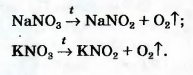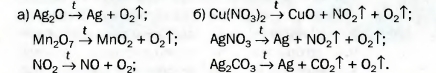|
|
|
| (3 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Получение кислорода</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Получение кислорода, газ, температура, химических реакциях, химическое уравнение, вещество</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Получение кислорода<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Получение кислорода<br> ''' |
| | | | |
| - | Получение кислорода<br><br>В этом параграфе речь идет:<br><br>> об открытии кислорода;<br>> о получении кислорода в промышленности и лаборатории;<br>> о реакциях разложения.<br><br>Открытие кислорода. <br><br>Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A . Л. Лавуазье исследовал кислород и дал ему название oxygen.<br><br>Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).<br><br>Рис. 53. Обнаружение кислорода: а — тлеющая лучинка на воздухе; <br>б — возгорание лучинки в кислороде<br><br>Получение кислорода в промышленности.<br><br>Неисчерпаемым источником кислорода являтся воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет —196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).<br><br>Рис. 54. Получение кислорода нагреванием меркурий(II) оксида<br><br>Получение кислорода в лаборатории. Лабораторные методы получения кислорода основаны на химических реакциях.<br><br>Дж. Пристли получал этот газ из соединения, название которого — меркурий(П) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет.<br><br>В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий(П) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке.<br><br>Соответствующее химическое уравнение:<br><br>карт<br> t<br>2HgO = 2Hg + O2T.<br><br>Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. <br>Они, как правило, происходят при нагревании.<br><br>Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.<br><br>Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:<br><br>• калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством)<br><br>карт<br><br>2KMn04 = K2MnO4 + MnO2 + O2T;<br><br>• калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле)<br><br>карт<br>t, MnO2<br>2КСЮ3 = 2КС1 + 302Т.<br><br>Небольшое количество катализатора — манган(1У) оксида MnO2 — добавляют к калий хлорату для того, чтобы разложение соединения происходило с выделением кислорода1.<br><br>Лабораторный опыт № 8<br><br>Получение кислорода разложением гидроген пероксида H2O2<br><br>Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное <br>название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), что бы она едва тлела. <br>Насыпьте в пробирку с раствором гидроген оксида немного катализатора — черного порошка манган(1У)оксида. Наблюдайте бурное выделение газа. С помощью тлеющей лучинки убедитесь в том, что этот газ — кислород.<br><br>Составьте уравнение реакции разложения гидроген пероксида, которым продуктом реакции является вода.<br><br>В лаборатории кислород можно также получить разложением натрий нитрата NaNO3 или калий нитрата KNO32. Соединения при нагревании сначала плавятся, а затем разлагаются:<br><br>карт<br>NaNO3 -> NaNO2 + O2T; <br>KNO, A KNO9 + О,Т.<br><br>1При нагревании соединения без катализатора происходит другая реакция<br><br>4КСЮ3 = KCl + ЗКСЮ4.<br><br>2Эти вещества используют в качестве удобрений. Их общее название — селитры.<br><br>карт<br>Схема 7. Лабораторные методы получения кислорода<br><br>► Превратите схемы реакций в химические уравнения.<br><br>Сведения о том, как получают кислород в лаборатории, собраны в <br>схеме 7.<br><br>Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:<br><br><br>карт<br>эл. ток<br>ZH2O = 2Н2Т + O2T.<br><br><br>В природе кислород образуется вследствие фотосинтеза в зеленых <br>листьях растений. Упрощенная схема этого процесса такова:<br><br>карт<br><br>Выводы<br><br>Кислород был открыт в конце XVIII в. несколькими учеными.<br><br><br>Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.<br><br>?<br><br>129. Как получают кислород в промышленности? Почему для этого не используют калий перманганат или гидроген пероксид?<br><br>130. Какие реакции называют реакциями разложения?<br><br>131. Превратите в химические уравнения такие схемы реакций:<br><br>карт<br><br>a) Ag2O А Ag + O2T; б) Cu(NO3)2 A CuO + NO2T + O2T;<br>Mn2O7 A MnO2 + O2T; AgNO3 А Ag + NO2T + O2T;<br>NO2 —^ NO + O2J Ag2CO3 —> Ag + CO2T + O2T.<br><br>132. Что такое катализатор? Как он может влиять на протекание хими<br>ческих реакций? (Для ответа используйте также материал § 15.)<br><br>133. На рисунке 55 изображен момент разложения белого твердого вещества, которое имеет формулу Cd(NO3)2. Внимательно рассмотрите рисунок и опишите все, что происходит во время реакции. Почему вспыхивает тлеющая лучинка? Составьте соответствующее химическое уравнение.<br><br>134. Массовая доля Оксигена в остатке после нагревания калий нитрата KNO3 составила 40 %. Полностью ли разложилось это соединение?<br><br>Рис. 55. Разложение вещества при нагревании
| + | <br> '''Получение кислорода<br><br>'''<u>'''В этом параграфе речь идет:'''</u> |
| | + | |
| | + | ''> об открытии кислорода;<br>> о получении кислорода в промышленности и лаборатории;<br>> о реакциях разложения.''<br><br><u>'''Открытие кислорода.'''</u> |
| | + | |
| | + | [[Оксиген. Кисень, склад його молекули, фізичні властивості|'''Кислород''']] был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A . Л. Лавуазье исследовал кислород и дал ему название oxygen. |
| | + | |
| | + | Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим [[8. Відносна густина газів|'''газом''']], ярко вспыхивает (рис. 53).<br> |
| | + | |
| | + | [[Image:19.09-030.jpg|480px|Обнаружение кислорода: а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде]]<br>''Рис. 53. Обнаружение кислорода: а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде''<br><br><u>'''Получение кислорода в промышленности.'''</u> |
| | + | |
| | + | Неисчерпаемым источником кислорода являтся воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем [[Температура|'''температуру''']] сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет —196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).<br> |
| | + | |
| | + | [[Image:19.09-031.jpg|240px|Получение кислорода нагреванием меркурий(II) оксида]]<br>''Рис. 54. Получение кислорода нагреванием меркурий(II) оксида''<br><br>Получение кислорода в лаборатории. Лабораторные методы получения кислорода основаны на '''[[Відео до уроку: Хімічні реакції та явища, що їх супроводжують.|химических реакциях]]'''. |
| | + | |
| | + | Дж. Пристли получал этот газ из соединения, название которого — меркурий(II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет. |
| | + | |
| | + | В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий(||) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке.<br><br>Соответствующее '''[[Хiмічні рівняння|химическое уравнение]]''': |
| | + | |
| | + | [[Image:19.09-032.jpg|180px|Химическое уравнение]] |
| | + | |
| | + | Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании. |
| | + | |
| | + | '''Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.''' |
| | + | |
| | + | Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения: |
| | + | |
| | + | • калий перманганат KMnO<sub>4</sub> (бытовое название марганцовка; '''[[Відео до уроку: Речовини. Чисті речовини і суміші|вещество]]''' является распространенным дезинфицирующим средством) |
| | + | |
| | + | [[Image:19.09-033.jpg|320px|Химическое уравнение]] |
| | + | |
| | + | • калий хлорат KClO<sub>3</sub> (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле) |
| | + | |
| | + | [[Image:19.09-034.jpg|240px|Химическое уравнение]] |
| | + | |
| | + | Небольшое количество катализатора — манган (IV) оксида MnO<sub>2</sub> — добавляют к калий хлорату для того, чтобы разложение соединения происходило с выделением кислорода<sup>1</sup>.<br><br>'''Лабораторный опыт № 8'''<br><br><u>'''Получение кислорода разложением гидроген пероксида H<sub>2</sub>O<sub>2</sub>'''</u> |
| | + | |
| | + | Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), что бы она едва тлела. <br>Насыпьте в пробирку с раствором гидроген оксида немного катализатора — черного порошка манган (IV) оксида. Наблюдайте бурное выделение газа. С помощью тлеющей лучинки убедитесь в том, что этот газ — кислород. |
| | + | |
| | + | Составьте уравнение реакции разложения гидроген пероксида, которым продуктом реакции является вода. |
| | + | |
| | + | В лаборатории кислород можно также получить разложением натрий нитрата NaNO<sub>3</sub> или калий нитрата KNO<sub>3</sub><sup><sub></sub>2</sup>. Соединения при нагревании сначала плавятся, а затем разлагаются: |
| | + | |
| | + | <u>[[Image:19.09-035.jpg|180px|Химическое уравнение]]<br>''<br>''</u>''<sup>1</sup>При нагревании соединения без катализатора происходит другая реакция'' |
| | + | |
| | + | [[Image:19.09-036.jpg|180px|Химическое уравнение]] |
| | + | |
| | + | ''<sup>2</sup>Эти вещества используют в качестве удобрений. Их общее название — селитры.''<br><br>[[Image:19.09-037.jpg|240px|Лабораторные методы получения кислорода]]<br>''Схема 7. Лабораторные методы получения кислорода''<br><br>► Превратите схемы реакций в химические уравнения. |
| | + | |
| | + | Сведения о том, как получают кислород в лаборатории, собраны в схеме 7. |
| | + | |
| | + | Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: |
| | + | |
| | + | <u>[[Image:19.09-038.jpg|180px|Химическое уравнение]]<br><br></u>В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова: |
| | + | |
| | + | <u>[[Image:19.09-039.jpg|420px|Химическое уравнение]]<br><br>'''Выводы'''</u> |
| | + | |
| | + | Кислород был открыт в конце XVIII в. несколькими [http://xvatit.com/vuzi/ '''учеными''']. |
| | + | |
| | + | Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.<br><br>'''?''' |
| | + | |
| | + | ''129. Как получают кислород в промышленности? Почему для этого не используют калий перманганат или гидроген пероксид?'' |
| | + | |
| | + | ''130. Какие реакции называют реакциями разложения?'' |
| | + | |
| | + | ''131. Превратите в химические уравнения такие схемы реакций:'' |
| | + | |
| | + | ''[[Image:19.09-040.jpg|480px|Химическое уравнение]]<br><br>132. Что такое катализатор? Как он может влиять на протекание химических реакций? (Для ответа используйте также материал § 15.)'' |
| | + | |
| | + | ''133. На рисунке 55 изображен момент разложения белого твердого вещества, которое имеет формулу Cd(NO3)2. Внимательно рассмотрите рисунок и опишите все, что происходит во время реакции. Почему вспыхивает тлеющая лучинка? Составьте соответствующее химическое уравнение.'' |
| | + | |
| | + | ''134. Массовая доля Оксигена в остатке после нагревания калий нитрата KNO<sub>3</sub> составила 40 %. Полностью ли разложилось это соединение?'' |
| | + | |
| | + | ''[[Image:19.09-041.jpg|240px|Разложение вещества при нагревании]]'' |
| | + | |
| | + | ''Рис. 55. Разложение вещества при нагревании'' |
| | | | |
| | <br> | | <br> |
Текущая версия на 11:51, 19 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Получение кислорода
Получение кислорода
В этом параграфе речь идет:
> об открытии кислорода;
> о получении кислорода в промышленности и лаборатории;
> о реакциях разложения.
Открытие кислорода.
Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A . Л. Лавуазье исследовал кислород и дал ему название oxygen.
Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).

Рис. 53. Обнаружение кислорода: а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Получение кислорода в промышленности.
Неисчерпаемым источником кислорода являтся воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет —196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).

Рис. 54. Получение кислорода нагреванием меркурий(II) оксида
Получение кислорода в лаборатории. Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий(II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет.
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий(||) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке.
Соответствующее химическое уравнение:
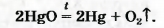
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
• калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством)
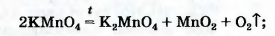
• калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле)
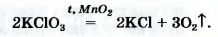
Небольшое количество катализатора — манган (IV) оксида MnO2 — добавляют к калий хлорату для того, чтобы разложение соединения происходило с выделением кислорода1.
Лабораторный опыт № 8
Получение кислорода разложением гидроген пероксида H2O2
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), что бы она едва тлела.
Насыпьте в пробирку с раствором гидроген оксида немного катализатора — черного порошка манган (IV) оксида. Наблюдайте бурное выделение газа. С помощью тлеющей лучинки убедитесь в том, что этот газ — кислород.
Составьте уравнение реакции разложения гидроген пероксида, которым продуктом реакции является вода.
В лаборатории кислород можно также получить разложением натрий нитрата NaNO3 или калий нитрата KNO32. Соединения при нагревании сначала плавятся, а затем разлагаются:
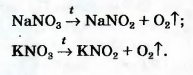
1При нагревании соединения без катализатора происходит другая реакция
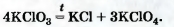
2Эти вещества используют в качестве удобрений. Их общее название — селитры.
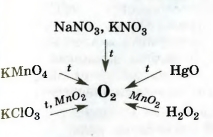
Схема 7. Лабораторные методы получения кислорода
► Превратите схемы реакций в химические уравнения.
Сведения о том, как получают кислород в лаборатории, собраны в схеме 7.
Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
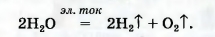
В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова:

Выводы
Кислород был открыт в конце XVIII в. несколькими учеными.
Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.
?
129. Как получают кислород в промышленности? Почему для этого не используют калий перманганат или гидроген пероксид?
130. Какие реакции называют реакциями разложения?
131. Превратите в химические уравнения такие схемы реакций:
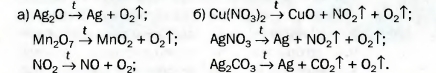
132. Что такое катализатор? Как он может влиять на протекание химических реакций? (Для ответа используйте также материал § 15.)
133. На рисунке 55 изображен момент разложения белого твердого вещества, которое имеет формулу Cd(NO3)2. Внимательно рассмотрите рисунок и опишите все, что происходит во время реакции. Почему вспыхивает тлеющая лучинка? Составьте соответствующее химическое уравнение.
134. Массовая доля Оксигена в остатке после нагревания калий нитрата KNO3 составила 40 %. Полностью ли разложилось это соединение?
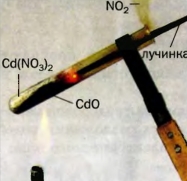
Рис. 55. Разложение вещества при нагревании
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|