|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Феррум, Железо, Экспериментируем дома, Ржавление железа, Для любознательных, О чугуне, и стали</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Феррум, Железо, Экспериментируем дома, Ржавление железа, Для любознательных, О чугуне, и стали, атомную массу, Оксиген, Ионы, температура, металл, кислород</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Феррум. Железо. Экспериментируем дома. Ржавление железа. Для любознательных. О чугуне и стали<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Феррум. Железо. Экспериментируем дома. Ржавление железа. Для любознательных. О чугуне и стали<br> ''' |
| | | | |
| - | <br> Феррум. Железо<br><br>В этом параграфе речь идет:<br><br>> о химическом элементе Ферруме и его распространенности в природе;<br>> о железе и его свойствах;<br>> о защите железа от коррозии;<br>> о применении железа.<br><br>Феррум. Это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума играют особую роль в живой природе.<br><br>► Охарактеризуйте положение Феррума в периодической системе, укажите относительную атомную массу элемента, порядковый номер, заряд ядра атома и количество электронов в атоме.<br><br>Атом Феррума может потерять 2 электрона и превратиться в ион Fe2+. Возможна потеря атомом еще и третьего электрона. В этом случае образуется <br>ион Fe3+. Ионы Fe2+ содержатся в соединениях Ферру ма(П), a Fe3+ — в соединениях Феррума(Ш).<br><br>► Составьте формулы соответствующих оксидов Феррума.<br><br>Распространенность Феррума в природе. По распространенности в земной коре Феррум разделяет с Кальцием 6—7-е места (в каждой тысяче атомов <br>содержится по 18 атомов этих элементов).<br><br>Известно много природных соединений Феррума. Соединения Феррума с Оксигеном — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из <br>крупнейших в мире.<br><br>Это интересно<br><br>По утверждениям ученых, железо вместе с никелем образуют ядро нашей <br>планеты.<br><br>Это интересно<br><br>В организме взрослого человека содержится 3—5 г Феррума.<br><br>Кроме соединений Феррума, в природе иногда встречается метеоритное железо.<br><br>Небольшое количество Феррума содержится в природной воде (в виде ионов Fe2+). При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума.<br><br>В живых существах Феррума очень мало. Ионы Fe2+ входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к <br>живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный <br>цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.<br><br>Железо. Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда <br>человек использовал метеоритное железо, а позднее научился получать металл из руды.<br><br>Физические свойства железа. Железо — серовато-серебристый пластичный металл, который плавится при температуре 1539 °С, притягивается <br>магнитом. Образует много сплавов с различными металлами.<br><br>Лабораторный опыт № 10 <br><br>Изучение физических свойств железа<br><br>Рассмотрите выданные вам железные предметы — гвозди, скрепки или кнопки. Опишите внешний вид металла.<br><br>Поместите железный предмет в стакан с водой. Железо тяжелее или легче воды? Растворяется ли этот металл в воде?<br><br>Выясните, притягивается ли железо магнитом.<br><br>Закрепите железный предмет в щипцах или пробиркодержателе и нагревайте в пламени спиртовки (сухого горючего). Удается ли расплавить железо в таких условиях?<br><br>Запишите результаты экспериментов.<br><br>Химические свойства. Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот металл самовозгорается на воздухе. Довольно чистое <br>железо (например, метеоритное) не ржавеет.<br><br>В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами1.<br><br>Реакции с неметаллами. <br><br>При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно <br>сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла. <br><br>Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла):<br> t<br>3Fe + 202 = Fe3O4.<br><br>Рис. 67. Горение стальной пружинки в кислороде<br><br>Формулу продукта реакции можно записать и так: FeO • Fe2O3. Эта запись свидетельствует о том, что вещество является соединением двух оксидов Феррума, а не их смесью. Химическое название соединения — феррум(П, III) оксид, а тривиальное — железная окалина. Железо сгорает и в газе хлоре (рис. 68):<br><br>1 Реакции между металлами не происходят. <br><br>Рис. 68. Горение железа в хлоре<br><br> t<br>2Fe + ЗС12 = 2FeCl3.<br> феррум(Ш) хлорид<br><br>Если нагреть смесь порошков железа и серы, то при определенной температуре начинается реакция, которая происходит с выделением значительного количества теплоты. Продуктом реакции является соединение Феррума(П):<br> t<br>Fe + S = FeS.<br> феррум(П) сульфид<br><br>Реакция с водой. Железо при высокой температуре может взаимодействовать с водой (раскаленный металл реагирует с водяным паром):<br> t<br>3Fe + 4Н20 = Fe3O4 + 4Н2.<br><br>Раньше с помощью этой реакции получали в промышленности водород.<br><br>Ржавление (коррозия) железа. <br><br>С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желтобурый налет — ржавчина. Разрушение железа под <br>действием воды и кислорода называют ржавлением, или коррозией.<br><br>Использовав для ржавчины формулу Fe(OH)3, запишем уравнение реакции:<br><br>4Fe + 6Н20 + 302 = 4Fe(OH)3.<br><br>Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).<br><br><br>Рис. 69. Коррозия железа: а — бочка, которую «съела» ржавчина; б — ржавая <br>проволока, на которой закреплена оцинкованная железная сетка<br><br><br>Полностью исключает коррозию замена железа нержавеющей сталью — сплавом железа с хромом и никелем.<br><br>Применение железа. Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из Схема 10. стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, промышленное оборудование и т. п. (схема 10).<br><br>Схема 10. Применение железа <br><br>карт<br><br>Выводы<br><br>Феррум — металлический элемент; его простое вещество — металл железо.<br><br>Кроме атомов Феррума, существуют ионы Fe2+ и Fe3+, которые входят в состав соединений Феррума(П) и Феррума(Ш).<br><br>Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.<br><br>Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода.<br><br>Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией.<br><br>Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем.<br><br>Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях.<br><br>?<br>158. Подготовьте небольшой доклад на одну из таких тем: а) «Биологиче<br>ская роль Феррума»; б) «Элемент Феррум на планете Земля»; в) «Важ<br>нейшие сплавы железа».<br>159. Сколько электронов содержат ионы Fe2+ и Fe3+?<br>160. Напишите формулы соединений Феррума с Флуором, которые содер<br>жат ионы Fe2+ и Fe3+.<br>161. Вычислите массовые доли Феррума в соединениях: a) FeO; б) Fe2O3;<br>в) Fe3O4.<br>162. Превратите схемы реакций в химические уравнения:<br> t t <br>FeO + O2 —> Fe2O3; Fe2O3 + Fe —> Fe3O4.<br><br>163. Замените названия веществ химическими формулами и превратите<br>схемы реакций в химические уравнения:<br> t<br>а) феррум(П) оксид + кислород —> феррум(Н, III) оксид;<br> t<br>б) феррум(П, III) оксид + железо —> феррум(П) оксид.<br><br>164. Какая масса железа прореагировала с 8 г серы, если образовалось 22 г соединения FeS?<br><br>165. В сплаве железа с марганцем массовая доля марганца равна 10 %, а <br>примесей — 2%. Вычислите массу железа, которая содержится в 20 г <br>сплава.<br><br>166. При нагревании 11,2 г железа с 6,4 г серы образовалось 13,2 г фер- <br>рум(И) сульфида. Какой вывод можно сделать на основании результа<br>тов эксперимента?<br><br>167. в нержавеющей стали на каждые 10 атомов Феррума приходится<br>3 атома Хрома и I атом Никеля. Вычислите массовые доли металлов <br>в этой стали.<br><br>Экспериментируем дома<br><br>Ржавление железа<br><br>Докажем, что ржавление железа происходит при одновременном <br>участии воды (водяного пара) и кислорода, а также ускоряется в <br>растворе поваренной соли.<br><br>Для опыта возьмите пять одинаковых чистых гвоздей длиной 2— 3 см, <br>кнопок или скрепок и четыре аптечные бутылочки емкостью 100 мл с <br>пробками.<br><br>В первую бутылочку налейте водопроводной воды до половины <br>объема, в другую — столько же свежепрокипяченной и охлажденной <br>воды, в третью — такой же объем раствора поваренной соли в водопроводной воде, а в четвертую — воды слоем в 2— 3 мм.<br><br>В первые три бутылочки с жидкостью погрузите по одному железному предмету, а в четвертой подвесьте предмет на нитке, чтобы он не <br>касался воды. Все бутылочки закройте пробками. Пятый предмет положите возле бутылочек на чистый лист бумаги.<br><br>Дважды в день рассматривайте железные предметы. Какой из них начинает ржаветь первым, а какой — последним? На всех ли предметах появляется ржавчина?<br><br>Объясните результаты эксперимента и сделайте выводы. Примите <br>во внимание, что из воды во время кипения выделяется растворен<br>ный воздух, а над водой всегда существует водяной пар.<br><br>Для любознательных<br><br>О чугуне и стали<br><br>И чугун, и сталь можно упрощенно считать железом, содержащим примеси. Оба <br>вещества различаются прежде всего внешним видом (сравните чугунную сковороду со стальной). Чугун — сероватый, со слабым металлическим блеском, а сталь — светлая и блестящая.<br><br>Примесей в чугуне больше, чем в обычной стали. Они придают чугуну твердость, хрупкость. А сталь нехрупкая и поддается механической обработке.<br><br>Чугун получают из железной руды с помощью химических реакций, а сталь — переплавкой чугуна в определенных условиях (рис. 70). Отрасль промышленности по производству чугуна и стали называют черной металлургией. По объему ее продукции Украина занимает одно из ведущих мест в мире.<br><br>Рис. 70. Разливка стали<br>
| + | <br> '''Феррум. Железо<br><br>'''<u>'''В этом параграфе речь идет:'''</u><br> |
| | + | |
| | + | ''> о химическом элементе Ферруме и его распространенности в природе;<br>> о'''[[Железо (Химия 9 класс)| железе]]''' и его свойствах;<br>> о защите железа от коррозии;<br>> о применении железа.'' |
| | + | |
| | + | <br> '''<u>Феррум.</u>'''''<b><br></b>'' |
| | + | |
| | + | Это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума [http://xvatit.com/relax/ '''играют'''] особую роль в живой природе.<br> |
| | + | |
| | + | ► Охарактеризуйте положение Феррума в периодической системе, укажите относительную '''[[Атомна одиниця маси. Відносна атомна маса хімічних елементів|атомную массу]]''' элемента, порядковый номер, заряд ядра атома и количество электронов в атоме.<br> |
| | + | |
| | + | Атом Феррума может потерять 2 электрона и превратиться в ион Fe<sup>2+</sup>. Возможна потеря атомом еще и третьего электрона. В этом случае образуется ион Fe<sup>3+</sup>. Ионы Fe2+ содержатся в соединениях Феррума(II), a Fe<sup>3+ </sup>— в соединениях Феррума(III).<br> |
| | + | |
| | + | ► Составьте формулы соответствующих оксидов Феррума.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | '''<u>Распространенность Феррума в природе</u>'''<u>. </u> |
| | + | |
| | + | По распространенности в земной коре '''[[Ферум. Залізо. Фiзичні властивості заліза. Поширеність Феруму в природі|Ферум]]''' разделяет с Кальцием 6—7-е места (в каждой тысяче атомов содержится по 18 атомов этих элементов).<br> |
| | + | |
| | + | Известно много природных соединений Феррума. Соединения Феррума с '''[[Відео до уроку: Поширеність та колообіг Оксигену в природі. Застосування кисню, його біологічна роль|Оксигеном]]''' — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из крупнейших в мире.<br><br><u>'''Это интересно'''</u><br> |
| | + | |
| | + | По утверждениям ученых, железо вместе с никелем образуют ядро нашей планеты.<br><br><u>'''Это интересно'''</u><br> |
| | + | |
| | + | В организме взрослого человека содержится 3—5 г Феррума.<br> |
| | + | |
| | + | Кроме соединений Феррума, в природе иногда встречается метеоритное железо.<br> |
| | + | |
| | + | Небольшое количество Феррума содержится в природной воде (в виде ионов Fe2+). При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума.<br> |
| | + | |
| | + | В живых существах Феррума очень мало. '''[[Ілюстрації до теми «Будова атома. Електрон. Йон»|Ионы]]''' Fe<sup>2+</sup> входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | <u>'''Железо.'''</u> |
| | + | |
| | + | Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда человек использовал метеоритное железо, а позднее научился получать металл из руды. |
| | + | |
| | + | <br> |
| | + | |
| | + | <u>'''Физические свойства железа.'''</u> |
| | + | |
| | + | Железо — серовато-серебристый пластичный металл, который плавится при '''[[Температура|температуре]]''' 1539 °С, притягивается магнитом. Образует много сплавов с различными металлами.<br><br>'''Лабораторный опыт № 10 <br><br>'''<u>'''Изучение физических свойств железа'''</u> |
| | + | |
| | + | Рассмотрите выданные вам железные предметы — гвозди, скрепки или кнопки. Опишите внешний вид металла. |
| | + | |
| | + | Поместите железный предмет в стакан с водой. Железо тяжелее или легче воды? Растворяется ли этот металл в воде? |
| | + | |
| | + | Выясните, притягивается ли железо магнитом. |
| | + | |
| | + | Закрепите железный предмет в щипцах или пробиркодержателе и нагревайте в пламени спиртовки (сухого горючего). Удается ли расплавить железо в таких условиях? |
| | + | |
| | + | Запишите результаты экспериментов.<br><br><u>'''Химические свойства. '''</u> |
| | + | |
| | + | Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот '''[[Відео до уроку: Багатоманітність речовин. Прості й складні речовини. Метали й неметали|металл]]''' самовозгорается на воздухе. Довольно чистое железо (например, метеоритное) не ржавеет. |
| | + | |
| | + | В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами1.<br><br><u>'''Реакции с неметаллами.'''</u> |
| | + | |
| | + | При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла. |
| | + | |
| | + | Пружинка сгорает в [[Оксиген. Кисень, склад його молекули, фізичні властивості|'''кислороде''']], разбрасывая искры во все стороны (это напоминает сварку металла):<br>''' t<br>3Fe + 20<sub>2</sub> = Fe<sub>3</sub>O<sub>4</sub>.''' |
| | + | |
| | + | <br> |
| | + | |
| | + | [[Image:19.09-056.jpg|550px|Горение стальной пружинки в кислороде]]<br>''Рис. 67. Горение стальной пружинки в кислороде''<br><br>Формулу продукта реакции можно записать и так: FeO • Fe<sub>2</sub>O<sub>3</sub>. Эта запись свидетельствует о том, что вещество является соединением двух оксидов Феррума, а не их смесью. Химическое название соединения — феррум(II, III) оксид, а тривиальное — железная окалина. Железо сгорает и в газе хлоре (рис. 68): |
| | + | |
| | + | ''<sup>1</sup> Реакции между металлами не происходят. ''<br> |
| | + | |
| | + | [[Image:19.09-057.jpg|120px|Горение железа в хлоре]]<br>''Рис. 68. Горение железа в хлоре''<br><br>''' t<br>2Fe + ЗСI<sub>2</sub> = 2FeCl<sub>3</sub>.<br> феррум(III) хлорид'''<br><br>Если нагреть смесь порошков железа и серы, то при определенной температуре начинается реакция, которая происходит с выделением значительного количества теплоты. Продуктом реакции является соединение Феррума(II): |
| | + | |
| | + | ''' t<br>Fe + S = FeS.<br> феррум(II) сульфид'''<br><br>Реакция с водой. Железо при высокой температуре может взаимодействовать с водой (раскаленный металл реагирует с водяным паром):<br>''' t<br>3Fe + 4Н<sub>2</sub>0 = Fe<sub>3</sub>O<sub>4</sub> + 4Н<sub>2</sub>.''' |
| | + | |
| | + | Раньше с помощью этой реакции получали в промышленности водород.<br><br><u>'''Ржавление (коррозия) железа.'''</u> |
| | + | |
| | + | С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желтобурый налет — ржавчина. Разрушение железа под <br>действием воды и кислорода называют ржавлением, или коррозией. |
| | + | |
| | + | Использовав для ржавчины формулу Fe(OH)<sub>3</sub>, запишем уравнение реакции: |
| | + | |
| | + | '''4Fe + 6Н<sub>2</sub>0 + 30<sub>2</sub> = 4Fe(OH)<sub>3</sub>.''' |
| | + | |
| | + | Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).<br><br>[[Image:19.09-058.jpg|320px|Коррозия железа]]<br>''Рис. 69. Коррозия железа: а — бочка, которую «съела» ржавчина; б — ржавая проволока, на которой закреплена оцинкованная железная сетка''<br><br>Полностью исключает коррозию замена железа нержавеющей сталью — сплавом железа с хромом и никелем. |
| | + | |
| | + | <br> |
| | + | |
| | + | <u>'''Применение железа.'''</u> |
| | + | |
| | + | Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из Схема 10. стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, промышленное оборудование и т. п. (схема 10).<br><br>''Схема 10. Применение железа '' |
| | + | |
| | + | [[Image:19.09-059.jpg|550px|Применение железа]]<br><br><u>'''Выводы'''</u> |
| | + | |
| | + | Феррум — металлический элемент; его простое вещество — металл железо. |
| | + | |
| | + | Кроме атомов Феррума, существуют ионы Fe<sub>2</sub>+ и Fe<sub>3</sub>+, которые входят в состав соединений Феррума(II) и Феррума(III). |
| | + | |
| | + | Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами. |
| | + | |
| | + | Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода. |
| | + | |
| | + | Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией. |
| | + | |
| | + | Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем. |
| | + | |
| | + | Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях.<br><br>'''?'''<br>''158. Подготовьте небольшой доклад на одну из таких тем: а) «Биологическая роль Феррума»; б) «Элемент Феррум на планете Земля»; в) «Важнейшие сплавы железа».'' |
| | + | |
| | + | ''159. Сколько электронов содержат ионы Fe<sup>2+</sup> и Fe<sup>3+</sup>?'' |
| | + | |
| | + | ''160. Напишите формулы соединений Феррума с Флуором, которые содержат ионы Fe<sup>2+</sup> и Fe<sup>3+</sup>.'' |
| | + | |
| | + | ''161. Вычислите массовые доли Феррума в соединениях: a) FeO; б) Fe<sub>2</sub>O<sub>3</sub>; в) Fe<sub>3</sub>O<sub>4</sub>.<br>162. Превратите схемы реакций в химические уравнения:<br> t t <br>FeO + O<sub>2</sub> —> Fe<sub>2</sub>O<sub>3</sub>; Fe<sub>2</sub>O<sub>3</sub> + Fe —> Fe<sub>3</sub>O<sub>4</sub>.<br><br>163. Замените названия веществ химическими формулами и превратите схемы реакций в химические уравнения:<br> t<br>а) феррум(II) оксид + кислород —> феррум(II, III) оксид;'' |
| | + | |
| | + | '' t<br>б) феррум(II, III) оксид + железо —> феррум(II) оксид.<br><br>164. Какая масса железа прореагировала с 8 г серы, если образовалось 22 г соединения FeS?'' |
| | + | |
| | + | ''165. В сплаве железа с марганцем массовая доля марганца равна 10 %, а примесей — 2%. Вычислите массу железа, которая содержится в 20 г сплава.'' |
| | + | |
| | + | ''166. При нагревании 11,2 г железа с 6,4 г серы образовалось 13,2 г феррум(II) сульфида. Какой вывод можно сделать на основании результатов эксперимента?'' |
| | + | |
| | + | ''167. в нержавеющей стали на каждые 10 атомов Феррума приходится 3 атома Хрома и I атом Никеля. Вычислите массовые доли металлов в этой стали.''<br><br><u>'''Экспериментируем дома'''</u>'''<br><br>Ржавление железа''' |
| | + | |
| | + | Докажем, что ржавление железа происходит при одновременном участии воды (водяного пара) и кислорода, а также ускоряется в растворе поваренной соли. |
| | + | |
| | + | Для опыта возьмите пять одинаковых чистых гвоздей длиной 2— 3 см, кнопок или скрепок и четыре аптечные бутылочки емкостью 100 мл с пробками. |
| | + | |
| | + | В первую бутылочку налейте водопроводной воды до половины объема, в другую — столько же свежепрокипяченной и охлажденной воды, в третью — такой же объем раствора поваренной соли в водопроводной воде, а в четвертую — воды слоем в 2— 3 мм. |
| | + | |
| | + | В первые три бутылочки с жидкостью погрузите по одному железному предмету, а в четвертой подвесьте предмет на нитке, чтобы он не касался воды. Все бутылочки закройте пробками. Пятый предмет положите возле бутылочек на чистый лист бумаги. |
| | + | |
| | + | Дважды в день рассматривайте железные предметы. Какой из них начинает ржаветь первым, а какой — последним? На всех ли предметах появляется ржавчина? |
| | + | |
| | + | Объясните результаты эксперимента и сделайте выводы. Примите во внимание, что из воды во время кипения выделяется растворенный воздух, а над водой всегда существует водяной пар.<br><br><u>'''Для любознательных'''</u>'''<br><br>О чугуне и стали''' |
| | + | |
| | + | И чугун, и сталь можно упрощенно считать железом, содержащим примеси. Оба вещества различаются прежде всего внешним видом (сравните чугунную сковороду со стальной). Чугун — сероватый, со слабым металлическим блеском, а сталь — светлая и блестящая. |
| | + | |
| | + | Примесей в чугуне больше, чем в обычной стали. Они придают чугуну твердость, хрупкость. А сталь нехрупкая и поддается механической обработке. |
| | + | |
| | + | Чугун получают из железной руды с помощью химических реакций, а сталь — переплавкой чугуна в определенных условиях (рис. 70). Отрасль промышленности по производству чугуна и стали называют черной металлургией. По объему ее продукции Украина занимает одно из ведущих мест в мире.<br> |
| | + | |
| | + | [[Image:19.09-060.jpg|240px|Разливка стали]]<br>''Рис. 70. Разливка стали''<br> |
| | | | |
| | <br> ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' | | <br> ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' |
Текущая версия на 13:50, 19 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Феррум. Железо. Экспериментируем дома. Ржавление железа. Для любознательных. О чугуне и стали
Феррум. Железо
В этом параграфе речь идет:
> о химическом элементе Ферруме и его распространенности в природе;
> о железе и его свойствах;
> о защите железа от коррозии;
> о применении железа.
Феррум.
Это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума играют особую роль в живой природе.
► Охарактеризуйте положение Феррума в периодической системе, укажите относительную атомную массу элемента, порядковый номер, заряд ядра атома и количество электронов в атоме.
Атом Феррума может потерять 2 электрона и превратиться в ион Fe2+. Возможна потеря атомом еще и третьего электрона. В этом случае образуется ион Fe3+. Ионы Fe2+ содержатся в соединениях Феррума(II), a Fe3+ — в соединениях Феррума(III).
► Составьте формулы соответствующих оксидов Феррума.
Распространенность Феррума в природе.
По распространенности в земной коре Ферум разделяет с Кальцием 6—7-е места (в каждой тысяче атомов содержится по 18 атомов этих элементов).
Известно много природных соединений Феррума. Соединения Феррума с Оксигеном — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из крупнейших в мире.
Это интересно
По утверждениям ученых, железо вместе с никелем образуют ядро нашей планеты.
Это интересно
В организме взрослого человека содержится 3—5 г Феррума.
Кроме соединений Феррума, в природе иногда встречается метеоритное железо.
Небольшое количество Феррума содержится в природной воде (в виде ионов Fe2+). При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума.
В живых существах Феррума очень мало. Ионы Fe2+ входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.
Железо.
Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда человек использовал метеоритное железо, а позднее научился получать металл из руды.
Физические свойства железа.
Железо — серовато-серебристый пластичный металл, который плавится при температуре 1539 °С, притягивается магнитом. Образует много сплавов с различными металлами.
Лабораторный опыт № 10
Изучение физических свойств железа
Рассмотрите выданные вам железные предметы — гвозди, скрепки или кнопки. Опишите внешний вид металла.
Поместите железный предмет в стакан с водой. Железо тяжелее или легче воды? Растворяется ли этот металл в воде?
Выясните, притягивается ли железо магнитом.
Закрепите железный предмет в щипцах или пробиркодержателе и нагревайте в пламени спиртовки (сухого горючего). Удается ли расплавить железо в таких условиях?
Запишите результаты экспериментов.
Химические свойства.
Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот металл самовозгорается на воздухе. Довольно чистое железо (например, метеоритное) не ржавеет.
В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами1.
Реакции с неметаллами.
При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла.
Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла):
t
3Fe + 202 = Fe3O4.

Рис. 67. Горение стальной пружинки в кислороде
Формулу продукта реакции можно записать и так: FeO • Fe2O3. Эта запись свидетельствует о том, что вещество является соединением двух оксидов Феррума, а не их смесью. Химическое название соединения — феррум(II, III) оксид, а тривиальное — железная окалина. Железо сгорает и в газе хлоре (рис. 68):
1 Реакции между металлами не происходят.
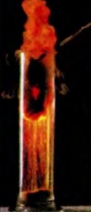
Рис. 68. Горение железа в хлоре
t
2Fe + ЗСI2 = 2FeCl3.
феррум(III) хлорид
Если нагреть смесь порошков железа и серы, то при определенной температуре начинается реакция, которая происходит с выделением значительного количества теплоты. Продуктом реакции является соединение Феррума(II):
t
Fe + S = FeS.
феррум(II) сульфид
Реакция с водой. Железо при высокой температуре может взаимодействовать с водой (раскаленный металл реагирует с водяным паром):
t
3Fe + 4Н20 = Fe3O4 + 4Н2.
Раньше с помощью этой реакции получали в промышленности водород.
Ржавление (коррозия) железа.
С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желтобурый налет — ржавчина. Разрушение железа под
действием воды и кислорода называют ржавлением, или коррозией.
Использовав для ржавчины формулу Fe(OH)3, запишем уравнение реакции:
4Fe + 6Н20 + 302 = 4Fe(OH)3.
Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).

Рис. 69. Коррозия железа: а — бочка, которую «съела» ржавчина; б — ржавая проволока, на которой закреплена оцинкованная железная сетка
Полностью исключает коррозию замена железа нержавеющей сталью — сплавом железа с хромом и никелем.
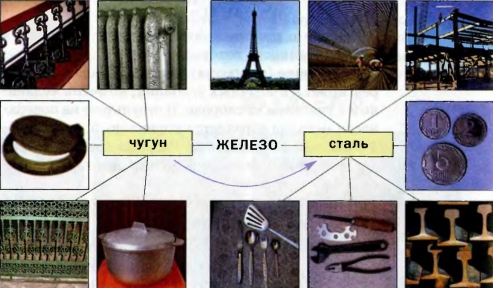
Применение железа.
Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из Схема 10. стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, промышленное оборудование и т. п. (схема 10).
Схема 10. Применение железа
Выводы
Феррум — металлический элемент; его простое вещество — металл железо.
Кроме атомов Феррума, существуют ионы Fe2+ и Fe3+, которые входят в состав соединений Феррума(II) и Феррума(III).
Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.
Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода.
Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией.
Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем.
Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях.
?
158. Подготовьте небольшой доклад на одну из таких тем: а) «Биологическая роль Феррума»; б) «Элемент Феррум на планете Земля»; в) «Важнейшие сплавы железа».
159. Сколько электронов содержат ионы Fe2+ и Fe3+?
160. Напишите формулы соединений Феррума с Флуором, которые содержат ионы Fe2+ и Fe3+.
161. Вычислите массовые доли Феррума в соединениях: a) FeO; б) Fe2O3; в) Fe3O4.
162. Превратите схемы реакций в химические уравнения:
t t
FeO + O2 —> Fe2O3; Fe2O3 + Fe —> Fe3O4.
163. Замените названия веществ химическими формулами и превратите схемы реакций в химические уравнения:
t
а) феррум(II) оксид + кислород —> феррум(II, III) оксид;
t
б) феррум(II, III) оксид + железо —> феррум(II) оксид.
164. Какая масса железа прореагировала с 8 г серы, если образовалось 22 г соединения FeS?
165. В сплаве железа с марганцем массовая доля марганца равна 10 %, а примесей — 2%. Вычислите массу железа, которая содержится в 20 г сплава.
166. При нагревании 11,2 г железа с 6,4 г серы образовалось 13,2 г феррум(II) сульфида. Какой вывод можно сделать на основании результатов эксперимента?
167. в нержавеющей стали на каждые 10 атомов Феррума приходится 3 атома Хрома и I атом Никеля. Вычислите массовые доли металлов в этой стали.
Экспериментируем дома
Ржавление железа
Докажем, что ржавление железа происходит при одновременном участии воды (водяного пара) и кислорода, а также ускоряется в растворе поваренной соли.
Для опыта возьмите пять одинаковых чистых гвоздей длиной 2— 3 см, кнопок или скрепок и четыре аптечные бутылочки емкостью 100 мл с пробками.
В первую бутылочку налейте водопроводной воды до половины объема, в другую — столько же свежепрокипяченной и охлажденной воды, в третью — такой же объем раствора поваренной соли в водопроводной воде, а в четвертую — воды слоем в 2— 3 мм.
В первые три бутылочки с жидкостью погрузите по одному железному предмету, а в четвертой подвесьте предмет на нитке, чтобы он не касался воды. Все бутылочки закройте пробками. Пятый предмет положите возле бутылочек на чистый лист бумаги.
Дважды в день рассматривайте железные предметы. Какой из них начинает ржаветь первым, а какой — последним? На всех ли предметах появляется ржавчина?
Объясните результаты эксперимента и сделайте выводы. Примите во внимание, что из воды во время кипения выделяется растворенный воздух, а над водой всегда существует водяной пар.
Для любознательных
О чугуне и стали
И чугун, и сталь можно упрощенно считать железом, содержащим примеси. Оба вещества различаются прежде всего внешним видом (сравните чугунную сковороду со стальной). Чугун — сероватый, со слабым металлическим блеском, а сталь — светлая и блестящая.
Примесей в чугуне больше, чем в обычной стали. Они придают чугуну твердость, хрупкость. А сталь нехрупкая и поддается механической обработке.
Чугун получают из железной руды с помощью химических реакций, а сталь — переплавкой чугуна в определенных условиях (рис. 70). Отрасль промышленности по производству чугуна и стали называют черной металлургией. По объему ее продукции Украина занимает одно из ведущих мест в мире.

Рис. 70. Разливка стали
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|















