Версия 13:12, 8 декабря 2009Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Хімія: Основні фізичні та хімічні властивості неметалів
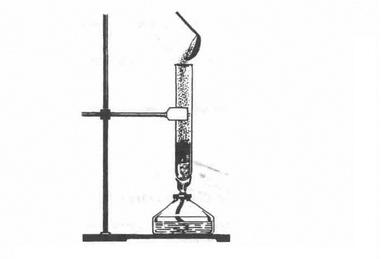
Кисень 02 і озон 03 — алотропні форми елемента Оксигену. Порівняння властивостей кисню 02 й озону 03 засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо): 8Ag + 203 = 4Ag20 + 02↑ Таблиця 1. Властивості кисню й озону
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива. Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість. Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар. Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі. Ви вже знаєте, що кисень — дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами і багатьма складними речовинами, виявляючи властивості сильного окисника. • Які сполуки утворюються під час взаємодії з киснем: а) водню б) алюмінію; в) метану СН4? Напишіть рівняння реакцій, зазначте у кожному з випадків ступінь окиснення елементів окисник і відновник. Хімічна активність сірки також доволі висока. При нагріванні вона реагує майже з усіма елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окисника, так і відновника (порівняйте з киснем), бо для неї характерні як позитиви ступені окиснення (+4, +6), так і негативний (-2). 1. Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (окрім золота), утворюючи сульфіди. Так, якщо всипати порошок міді у розплавлену сірку (мал. 3), то відбувається реакція з утворенням чорного сульфіду купруму (І) і виділенням великої кількості теплоти: 2Cu + S = Cu2S Після початку реакції спиртівку відставляють. • Сірка безпосередньо сполучається з залізом, цинком, натрієм, алюмінієм. Напишіть рівняння цих реакцій і зазначне назви речовин, що утворилися. 2. Взаємодія з неметалами. Сірка безпосередньо взаємоді з усіма неметалами (окрім йоду й азоту). Реакції відбуваються при нагріванні: S + 02 = S02↑ H2 + S = H2S↑ Мал. 3. Взаємодія міді і сірки
Фізичні властивості азоту За звичайних умов азот — газ без кольору і запаху. Молекули його неполярні, тому взаємодія між ними слабка, вона не може перешкодити їхньому xaoтичному рухові. Цим пояснюється газуватий стан азоту за звичайних умов і це є причиною того, що азот зріджується (-196 °С) і твердне (-210 °С) за дуже низьких температур. У твердому стані має молекулярні кристалічні ґратки. Неполярністю молекул азоту пояснюється його низька розчинність у воді (в 1 об'ємі води за 20 °С розчиняється Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями. Це — білий, червоний і чорний фосфор. Білий фосфор — м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але звичайно жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка (tпл. = 44 °С) і легкозаймиста. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули Р4. У воді не розчиняється. Розчиняється у сірковуглеці CS2 та бензині. У темряві на повітрі світиться зеленкувато-жовтим світлом (люмінесценція), при цьому виділяється теплота (хімічна енергія перетворюється на світлову). Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Під час нагрівання або на світлі він перетворюється на червоний фосфор. Білий фосфор — надзвичайно отруйна речовина, навіть у малих дозах (50 мг) діє смертельно! Червоний фосфор — порошок від темно-коричневого до червоного і фіолетового кольору, з атомними кристалічними гратками (структура до кінця не з'ясована), без запах, не отруйний на повітрі окиснюється повільно, у темряві не Чорний фосфор — речовина, схожа на графіт, має шарувату будову, металічний блиск, виявляє властивості напівпровідника, не отруйний. Це найбільш стійка алотропна форма. Утворюється з білого фосфору при тривалому нагріванні (200 °С) під великим тиском (1220 МПа). Утворення фосфором кількох алотропних форм пояснюється різним розміщенням атомів один відносно одного у кристалічних ґратках. Ви вже знаєте, щов молекулі азоту N2, за рахунок трьох неспарених електронів кожного з атомів утворюється потрійний з'вязок.йний зв'язок: N2 :N::N: N=N Через це молекула азоту дуже міцна. Потрібно витратити велику кількість енергії на руйнування зв'язку, щоб почалася реакція. Тому молекулярний азот, як правило, вступає в хімічну взаємодію за високих температур. Фосфор хімічно активніший, ніж азот. Хімічна активність фосфору залежить від алотропної форми. Так, найактивніший білий фосфор. Ви знаєте, що він легко окислюється на повітрі і світиться в темряві, може самовільно спалахувати. Червоний фосфор менш активний. Він окислюєтьсмя під час нагрівання. Ще менш активний — чорний фосфор. У рівняннях хімічних реакцій білий фосфор звичайно позначають формулою Р4, що відповідає складу його молекули. Червона і чорна алотропні форми фосфору позначаються символом Р. Такий самий символ використовують, коли форма невідома або може бути будь-якою. Це хімічна формула фосфору умовна для всіх його алотропних форм. Оскільки Нітроген і Фосфор у сполуках можуть виявляти як позитивний, так і негативний ступені окиснення, їхні прості речовини в реакціях можуть бути як окисниками, так і відновниками. Азот і фосфор поводяться як окисники відносно найактивніших металів і водню. При цьому 0 +6e -3 0 +3e -З 1. Взаємодія з металами. Азот і фосфор під час нагрівання реагують з багатьма металами, утворюючи відповідно нітриди і фосфіди. 3Mg + N2 = Mg3N2 3Mg + 2P = Mg3P2 Лише з літієм азот реагує за звичайної температури, утворюючи нітрид літію: 6Li + N2 = 2Li3N 2. Взаємодія з неметалами: а) з воднем азот сполучається за наявності каталізатора, високих тиску і температури, утворюючи аміак: N2 + ЗН2 ⇔ 2NH3, а фосфор з воднем практично не взаємодіє; б) з киснем азот сполучається за температури електричної дуги, понад 2000 °С, утворюючи оксид нітрогену (ІІ): N2 + 02 ⇔ 2NO Фосфор енергійно взаємодіє з киснем. Якщо його підпалити, він згоряє в кисні сліпучим яскравим полум'ям, утворюючи оксид фосфору(V): 4Р + 502 = 2Р205 Під час повільного окиснення утворюється оксид фосфору(ІІІ): 4Р + 302 = 2Р203 Застосування. Азот у великих кількостях використовується для добування аміаку і для наповнення електроламп (інертне середовище). Білий фосфор широкого застосування не має. Його використовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину, а також для утворення димових завіс. Червоний фосфор використовується для виробництві сірників. У 1831 р. французький винахідник сірників Шарль Соріа почав застосовувати білий фосфор для виготовлення сірникових головок. Такі сірники легко займалися піц час тертя об будь-яку поверхню, але були отруйними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились. Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до складу намазки, що наноситься на коробку (разом із сульфідом стибію (III) Sb2S3, залізним суриком Fe203, домішкою кварцу SiO2 і клею). Головки сірників складаються, головним чином, з бертолетової солі КСl03, молотого скла, сірки та клею. Під час тертя головки по намазці сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево. Крім виробництва cірників, фосфор застосовують у металургії. Використовують його і для виготовлення напівпровідників, фосфорорганічних препаратів — засобів знищення комах — шкідників сільськогосподарських рослин. Алотропія Карбону і Силіцію. У природі зустрічаються три алотропні форми Карбону: алмаз, графіт і карбін. Алмаз (від грец. adamas — непохитний, твердий) — кристалічна речовина, тугоплавка, хімічно малоактивна, діелектрик, практично не проводить електричного струму. Кристалічні ґратки атомні (мал. 10.). Мал. 10. Кристалічні ґратки. Приклади застосування алмазу Зустрічаються кристали безбарвні або забарвлені у жовтий, коричневий, рожево-бузковий, зелений, голубий, синій і чорний колір. Кристали можуть бути прозорі і непрозорі, для них характерний сильний блиск. У кристалі алмазу кожний атом Карбону з'єднується міцними ковалентними зв'язками з чотирма сусідніми атомами. Такою будовою кристалів пояснюється виключна твердість алмазу. Він найтвердіший з усіх відомих речовин. Завдяки твердості алмаз широко використовується для свердління твердих порід, виготовлення шліфувальних дисків, різців, свердел, різання скла (див. мал.10) тощо. Для цього застосовують технічні алмази, тобто такі, що містять різні домішки. Чисті алмази — безбарвні прозорі кристали. Їх гранують, шліфують (алмазним порошком) і виготовляють з них діаманти. Прозорі алмази красивого синього, зеленого, червонуватого кольору надто рідкісні й оцінюються дуже високо. Чим більше граней має кристал, тим краще він «грає». Маса діамантів вимірюється каратами (1 карат = 0,2 г). Найбільший з будь-коли знайдених на Землі алмазів — це алмаз «Куллінан». Його знайшли у 1905 р. Назву він здобув від імені одного із володарів. До огранювання його розмір був з жіночий кулак і маса 3106 каратів, тобто 621 г. Під час обробки алмаз розкололи за напрямом тріщин, що були у ньому, і вирізали 105 діамантів. Найбільший серед них назвали «Зоряна Африка». Він має форму краплі і масу 530 каратів. Цікаво, що серед індійських алмазів є славнозвісний «Шах» масою 89 каратів, яким перський уряд, щоб «уласкавити білого царя», розплатився за кров відомого російського дипломата і видатного письменника О. С. Грибоєдова, полеглого від рук розлюченого натовпу перських фанатиків у 1829 р. у Тегерані — столиці Персії. Розроблено штучне добування алмазів (1954 p., США) з графіту в умовах високих тисків і температур. Як правило, утворюються дрібні кристали. Їх використовують для виготовлення різальних інструментів і як опору для підшипників та інших рухливих частин у точних вимірювальних інструментах. Нині виробляються й синтетичні алмази ювелірної якості. Промисловий синтез алмазів — велике досягнення науки і техніки. Графіт (від грец. grapho — пишу) — кристалічна речовина, жирна на дотик, сірого або чорного кольору з металічним блиском. Структура графіту шарувата (мал. 11): атоми карбону розміщені шарами, що складаються з шестичленних кілець. У межах одного шару кожний атом Карбону утворює три хімічні зв'язки з трьома сусідніми атомами. Усі атоми Карбону об'єднуються у макромолекули, які являють собою нескінченні шари із шестичленних кілець. За рахунок четвертих електронів зовнішнього електронного шару кожного атома Карбону, що не беруть участі в утворенні хімічних зв'язків у площині, виникає загальна система хімічного зв'язку, делокалізованого у межах всієї макромолекули. Цим саме і визначається електрична провідність графіту, темно-сірий колір і металічний блиск. Шари атомів Карбону об'єднуються у кристалічні ґратки за рахунок міжмолекулярних сил. Всередині шару графіту зв'язки між атомами ковалентні, доволі міцні, а між шарами діють міжмолекулярні сили, доволі слабкі. Тому графіт легко розшаровується на лусочки. Це робить кристали графіту неміцними, а сам мінерал м'яким. Навіть під час слабкого тертя графіту по паперу на ньому залишається сірий слід. Графіт тугоплавкий (tпл. = 3800 °С), хімічно дуже стійкий. З нього виготовляють вогнетривкі тиглі, мастила, синтетичні алмази, електроди, обкладки для електролітичних ванн, труби теплообмінників (див. мал. 11). В ядерних реакторах графіт використовують як уповільнювач нейтронів. З графіту роблять грифелі для олівців. У промисловості, крім природного, використовують штучний графіт. Його добувають з кращих сортів кам'яного вугілля (кокс, антрацит). Процес відбувається в електропечах за температури 2600 — 3000 °С і тиску 250 МПа без доступу повітря. Карбін — чорна речовина. Складається з довгих ланцюгів атомів Карбону — С = С — С = С — С = С —, виявляє властивості напівпровідника. Існують ще так звані вуглецеві матеріали (раніше називали «аморфний вуглець»). До них належать вугілля (кокс, деревне вугілля), технічний вуглець (сажа) та ін. Вони не є самостійними алотропними формами Карбону, як це раніше вважалось, бо мікрокристалічна структура їх така сама, як у графіту, але кристали розміщені безладно. Сажу використовують як наповнювач для гуми і пластмас, пігмент для друкарської фарби, копіювального паперу, стрічки для друкарських машинок та ін. Кокс використовують у металургії як паливо і відновник. Застосування деревного вугілля ґрунтується на його здатності притягувати до своєї поверхні молекули речовин з навколишнього середовища (вбирання на поверхні). Таке явище називають адсорбцією. Зрозуміло, що чим більша поверхня, тим сильніша адсорбція. Щоб збільшити поверхню вугілля, його активують — обробляють перегрітою водяною парою для видалення з його nop сторонніх домішок і збільшення поруватості. Таке вугілля називають активованим. Активоване вугілля чудовий адсорбент (вбирник). Саме тому його використовують у промисловості для очищення газів, вловлювання цінних органічних розчинників, виготовлення протигазів, у медицині — для очищення крові і вбирання шкідливих речовин із шлунково-кишкового тракту. Силіцій як проста речовина має кристалічну будову, крихкий, темно-сірого кольору з металічним блиском. Як хімічний елемент Силіцій на відміну від Карбону існує лише в одній формі, структура якої аналогічна структурі алмазу, оскільки графітоподібна форма дуже нестійка. Але, на відміну від алмазу, Силіцій — напівпровідник. Це пояснюється тим, що деякі ковалентні зв'язки між його атомами легко руйнуються, що зумовлює помітну рухливість електронів у кристалі. Силіцій використовують в електроніці як напівпровіднк, а також для виготовлення діодів, транзисторів, сонячних батарей, фотоприймачів, детекторів частинок у ядерній фізиці. В металургії силіцій використовують як відновник і для видалення кисню з розплавлених металів. Силіцій компонент електротехнічних сталей, чавунів, бронзи, силумінів (сплавів з алюмінієм). Силіцій — другий хімічний елемент після Оксигену за поширенням у природі, його масова частка в земній корі 26,6 %. Але у вільному стані він не зустрічається, тільки у вигляді сполук. Найпоширенішою сполукою Силіцію є оксид силіцію (IV) Si02, або кремнезем. Це — мінерал кварц і багато його різновидів (пісок, гірський кришталь, кремінь, яшма опал, агат, аметист та ін.). Силіцій у вигляді силікатів і алюмосилікатів входить до складу таких мінералів, як азбест, тальк, польовий шпат, каолін, нефелін, слюда тощо. Входить він і до складу рослинних (хвощі, бамбук та, ін.) і тваринних організмів (кістяк, сполучна тканина). ВУГЛЕЦЬ виявляє невисоку хімічну активність: більшість реакцій за його участю відбувається лише за високої температури. Силіцій ще менш активний, ніж вуглець. За низьких температур він навіть хімічно інертний, а під час нагрівання його здатність до реагування різко зростає. Найголовніша хімічна властивість вуглецю і силіцію — де їхня відновна здатність. У вуглецю вона виражена яскравіше, ніж у силіцію. Вуглець — один з найкращих відновників. 1. Взаємодія з оксидами металів. Під час нагрівання вуглець відновлює метали з їхніх оксидів: 2е CuO + С = Cu + CO↑ SnO + C = Sn + CO↑ За наявності вільного доступу повітря при цьому утворюється оксид карбону(IV) С02: 2СuО + С = 2Сu + С02↑ 2SnO + С = 2Sn + C02↑ У металургійній практиці, як правило, утворюється суміш газів CO і С02. Такі процеси, що ґрунтуються на відновленні металів з їхніх оксидів вуглецем (коксом), називаються карботермією. Силіцій також виявляє відновні властивості, але вони виражені значно слабше, ніж у вуглецю. Наприклад, силіцій поводить себе як відновник у процесі виплавляння сталі: за високої температури він відновлює металічне залізо з оксиду феруму(ІІ), що міститься у брухті разом з іншими речовинами (Fe203 • хН20): 2FeO + Si = 2Fe + Si02 2Fe203 + 3Si = 4Fe + 3Si02 Метод відновлення металів силіцієм називається силікотермією. 2. Взаємодія з киснем. Вуглець легко горить на повітрі. При цьому виділяється велика кількість теплоти, що свідчить про велику міцність зв'язків у молекулі оксиду карбону (IV), який утворюється: С + 02 = С02; ΔH = -394 кДж. Продукт реакції горіння вуглецю залежить від температури. За порівняно невисоких температур горіння утворюється діоксид карбону С02, а за високих (понад 1000 °С) — поряд з С02 утворюється значна кількість оксиду карбону(II) CO: 2С + 02 = 2СО С + С02 ⇔2СО Саме така реакція (поряд з іншими) відбувається під час спалювання коксу, вугілля, бензину за високої температури та нестачі кисню. Тому вихлопні гази автомобільних двигунів, відхідні гази печей за умови поганої тяги, тютюновий дим обов'язково містять чадний газ CO і забруднюють повітря. Силіцій за звичайних умов хімічно стійкий. Але під час сильного нагрівання (понад 400 °С) порошок силіцію згоряє, утворюючи оксид силіцію(ІV): Si + 02 = Si02 При цьому також виділяється велика кількість теплоти, що свідчить про велику міцність зв'язку між атомами Силіцію й Оксигену. 3. Взаємодія з металами. Під час нагрівання вуглець може взаємодіяти з деякими металами, утворюючи карбіди: Са + 2С = СаС2 4АІ + ЗС = А14С3 Карбіди — тверді і тугоплавкі речовини. У цих реакціях вуглець виступає як окисник, що для нього не характерно. Силіцій також виявляє окисні властивості, але лише відносно деяких металів, наприклад: 2Mg + Si = Mg2Si, що для силіцію також не характерно. 4. Взаємодія з воднем. Вуглець може взаємодіяти з воднем. Реакція відбувається під час нагрівання до 500 °С за наявності порошку нікелю як каталізатора: С + 2Н2 ⇔ СН4 Утворюється органічна сполука — метан СН4 (головна складова частина природного газу). • Який ступінь окиснення виявляє атом Карбону в молекулі метану СН4? Як ви гадаєте, окисником чи відновником у даному разі є вуглець. Чому для нього взаємодія з воднем нехарактерна? Силіцій з воднем безпосередньо не взаємодіє. Його водневу сполуку SіН4 — силан добувають непрямим способом. ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: