Версия 12:16, 6 декабря 2012Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Біологія: Обчислення обٰєму газу за нормальних умов. Повні уроки
Тема
Мета уроку
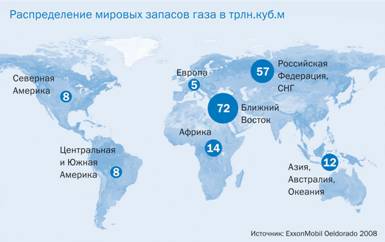
Задачі уроку1. Згадати значення поняття «молярний об’єм газу», називати хімічну формулу його знаходження. Хід урокуПоняття «молярний об’єм газу»Маса одного моля речовини називається молярною. А як називатиметься об'єм одного моля речовини? Очевидно, що і він також називатиметься молярним. Чому дорівнює молярний об'єм води? Коли ми відміряли 1 моль води, ми не зважували на вагах 18 г води — це дуже незручно. Ми користувалися мірним посудом: циліндром, мензуркою або колбою, оскільки знали, що щільність води (маса однієї одиниці об'єму) рівна 1 г/мл. Тому молярний об'єм води рівний 18 мл. У рідин і твердих речовин він залежить від щільності речовин. Малюнок 1. Розподіл світових запасів газу. Інша справа у газів. Якщо узяти 1 моль водню Н2 (2 г), 1 моль кисню 02 (32 г), 1 моль озону 03 (48 г), 1 моль вуглекислого газу С02 (44 г) і навіть 1 моль водяної пари Н20 (18 г) за однакових умовах, наприклад нормальних (у хімії прийнято називати нормальними умовами температуру 0 °С і тиск 760 мм рт. ст., або 101,3 кПа), то виявиться, що один моль будь-який з газів займе один і той же об'єм, рівний 22,4 л. На цьому відео ми побачимо як залежить тиск газу від об’єму газу. Відео 1. Залежність тиску газу від об’єму.
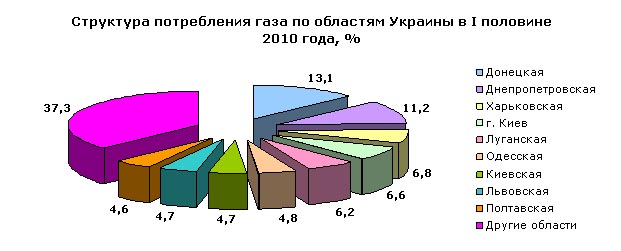
Подивіться на Малюнок 1. На ньому зображено сонце. Сонце - виключно величезна куля вируючого газу, переважно водню. Малюнок 2. Сонце. Малюнок 3. Молекула водню. Молярный объём 14,1 см³/моль Оскільки це об'єм газу кількістю речовини 1 моль, то він називається молярним об'ємом і позначається Vm. Молярний об’єм – це фізична величина, що дорівнює відношенню об’єму газу до відповідної кількості речовини цього газу. Vm= V/n; [V]=л, [n]=моль, отже [Vm]= л/моль. Знаючи молярний об’єм газу, можна визначати кількість речовини, об’єм будь-якої кількості речовини та кількість структурних частинок в певному об’ємі газу. З формули Vm=V/n → n=V/Vm, або n=V/22,4. Знаючи, що N= NA∙n, можемо записати: N= NA∙V/22,4. Контролюючий блок № 11. Охарактеризуйте поняття «молярний об’єм газу», назвіть формули його знаходження. Розвязування задач на знаходження молярного об’єму газу за нормальних умовЗадача 1. Обчислити об’єм, що займе при нормальних умовах водень кількістю речовини 1,5 моль. Дано: n=1,5 моль ; Знайти: V(H2) Рішення V=22,4•n Пропоную переглянути цей малюнок. На ньому ви побачите структуру вжитку газу по Україні за 2010 рік. Малюнок 4. Структура вжитку газу за 2010 рік. Малюнок 5. Робота, яку проводять при зміненні об'єму газу за допомогою Теплових машин. Задача 2. Обчислити, якій кількості речовини відповідатиме 4,48 л вуглекислого газу. Дано: V(CO2)=4,48л; Знайти: n Рішення n=V/22,4 Задача 3. Обчислити кількість молекул та атомів, що міститься в 89,6 л кисню при нормальних умовах. Дано: V(O2)=89,6л; Знайти : Nмол., Nатомів; Рішення N= NA∙V/22,4 Розглянемо малюнок 6. На ньому ви бачите кисневий балон, який використовується у медицині. Кисневі балони розраховані на зберігання кисню до 6000 дм3. Для того, щоб визначити кількість кисню в балоні, користуються формулою: Vk = Vspk. Де: Vk -кількість кисню в балоні; Vs - ємкість балона; Рк - тиск кисню. Малюнок 6. Кисневий балон Kislorod Прана-К2 14л з маскою. Пропоную переглянути відео. На ньому ми побачимо, як отримують кисень у лабораторних умовах та розглянемо його хімічні властивості.
Відео 2. Отримання та хімічні властивості кисню. Давайте проглянемо це відео. На ньому ми наглядно побачимо, як змінився рівень вуглекислого газу на Землі.
Відео 3. Рівень вуглекислого газу на Землі. Малюнок 7. Викиди CО2 цього року можуть досягти рекордного рівня. Контролюючий блок № 21. Обчисліть об’єм газу, який утвориться при змішуванні розчину масою 276 г із масовою часткою калій карбонату 10 % із достатньою кількістю розчину сульфатної кислоти.
Цікаво знати,що …Торік об'єм викидів вуглекислого газу в атмосферу нашої планети був найнижчим, починаючи з 1999 року, що було пов'язане зі світовою економічною кризою. Як тільки криза залишилася позаду, об'єми викидів вуглекислого газу знову стали зростати. У кризисний 2009 рік багато людей не подорожували так активно, як в попередні роки, промислові підприємства припинили роботу або уповільнили темпи виробництва. Так в США, яка є найбільшим емітентом парникових газів, викиди вуглекислого газу знизилися на 7%. В результаті глобальний об'єм викидів вуглекислого газу в 2009 році склав 31 мільярд тонн, що на 453 мільйони тонн менше, ніж в попередній йому докризовий рік. Не дивлячись на це, на думку багатьох фахівців, у 2010 році глобальні викиди вуглекислого газу досягнуть нової рекордної відмітки. З кожним роком все більшу роль в глобальній емісії вуглекислого газу починають грати країни, що розвиваються. У 2009 році, на відміну від розвинених країн, об'єми викидів парникових газів країн, що розвиваються, продовжили своє зростання. Торік Китай викинув в атмосферу на 8% більше вуглекислого газу, чим в попередній докризовий 2008 рік, Індія - на 6,2%. У 2010 році розвинені країни, що оправилися від кризи, також збільшили об'єми викидів вуглекислого газу. В результаті викиди CО2 цього року можуть досягти рекордного рівня. P.S. В даний час концентрація вуглекислого газу в атмосфері нашої планети досягла рекордного значення 387 ppm (частин на мільйон). У доїндустріальную епоху концентрація CО2 складала 280 ppm. Список використаних джерел1. Урок «Молярный объём газов. Относительная плотность газов» Мишунькина Людмила Викторовна, учитель МОУ СОШ №17
Макаринська Я.Ю. Мишунькина Л. В. Лоренко Л.П. Яковлева О. А.
|
|||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: