|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас. Повні уроки]]>>Хімія: Атомна одиниця маси. Відносна атомна маса хімічних елементів. Повні уроки<metakeywords>Природознавство, клас, урок, на тему, Атомна одиниця маси. Відносна атомна маса хімічних елементів</metakeywords>''' | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас. Повні уроки]]>>Хімія: Атомна одиниця маси. Відносна атомна маса хімічних елементів. Повні уроки<metakeywords>Природознавство, клас, урок, на тему, Атомна одиниця маси. Відносна атомна маса хімічних елементів</metakeywords>''' |
| | | | |
| - | <br>'''''Мета уроку:'''''<br>1. Вивчити поняття атомна одиниця маси.<br>2. Розглянути, які є відносні атомні маси хімічних елементив<br>'''''Хід уроку:<br>Частина 1.'''''<br>'''''Атомна одиниця маси.'''''<br>Атомна одиниця маси (а. о м.), одиниця маси для вираження мас мікрочасток. За 1 а.е.м. прийнята 1 / 12 частина маси найбільш поширеного і легкого ізотопу вуглецю 12С з масовим числом 12 (т. зв. вуглецева шкала). 1 а.е.м. = 1,6605655 (86) • 10-27 кг.<br>Для перекладу значень мас m частинок, виражених в а.е.м., в одиницю маси СІ (кг) користуються формулою:<br>m (кг) = m (до а.е.м.)* NA,<br>де m (до а.е.м.) - маса частинки в кілоатомних одиницях, NA - стала Авогадро.<br><br>''Малюнок 1. Розрахунок абсолютних мас атомів і молекул''<br><br>Оскільки 1 а.е.м. є величиною, обернено пропорційній числу Авогадро, тобто 1/NA г, то молярна маса певного елементу, виражена в грамах на моль, цілком співпадає з масою атома цього елемента, вираженої в а. е. м.<br><br><br>''Малюнок 2. Латинська назва - Aurum, позначення - Au.<br> атомний номер – 79, атомна маса - 196,9665.'' | + | <br>'''''Мета уроку:'''''<br>1. Вивчити поняття атомна одиниця маси.<br>2. Розглянути, які є відносні атомні маси хімічних елементив<br>'''''Хід уроку:<br>Частина 1.'''''<br>'''''Атомна одиниця маси.'''''<br>Атомна одиниця маси (а. о м.), одиниця маси для вираження мас мікрочасток. За 1 а.е.м. прийнята 1 / 12 частина маси найбільш поширеного і легкого ізотопу вуглецю 12С з масовим числом 12 (т. зв. вуглецева шкала). 1 а.е.м. = 1,6605655 (86) • 10-27 кг.<br>Для перекладу значень мас m частинок, виражених в а.е.м., в одиницю маси СІ (кг) користуються формулою:<br>m (кг) = m (до а.е.м.)* NA,<br>де m (до а.е.м.) - маса частинки в кілоатомних одиницях, NA - стала Авогадро.<br>[[Image:him7_7_1.jpg]]<br>''Малюнок 1. Розрахунок абсолютних мас атомів і молекул''<br><br>Оскільки 1 а.е.м. є величиною, обернено пропорційній числу Авогадро, тобто 1/NA г, то молярна маса певного елементу, виражена в грамах на моль, цілком співпадає з масою атома цього елемента, вираженої в а. е. м.<br>[[Image:him7_7_2.jpg]]<br>''Малюнок 2. Латинська назва - Aurum, позначення - Au.<br> атомний номер – 79, атомна маса - 196,9665.'' |
| | | | |
| - | <br>Для вимірювання маси атомів і молекул до 1961 року в хімії застосовувалася а. е. м., рівна 1 / 16 атомної маси елемента кисню. А у фізиці за а. Є.М. приймалася 1 / 16 маси атома найлегшого зі стабільних ізотопів кисню. Значення фізичної а. е. м. і хімічної а. е. м. різнилися: хімічна була в 1,000275 рази більше фізичної, так як природний кисень містить 3 стабільних ізотопи: 16O (99,76%), 17O (0,04%), 18O (0,20%). Тому в 1961 р. була встановлена як у фізиці, так і в хімії уніфікована а. е. м., рівна 1,0003179 колишньої фізичної а.е.м. і вельми близькою за значенням до колишньої хімічної а.е.м. Для елементарних частинок (електронів, нуклонів, мезонів і т. п.) як одиниці маси застосовують масу електрона, рівну 5,4858026.10-4 уніфікованої а. е. м. або 9,1091 Ї.10-1928.<br>Маса і кількість речовини - поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини - в молях. Між масою речовини (т, м), кількістю речовини (п, моль) і молярною масою (М, г / моль) існують прості співвідношення: m = nM, n = m / MM = m / n За цим формулам легко обчислити масу визначеної кількості речовини, або визначити кількість речовини у відомій Ассе його, або знайти молярну масу речовини.<br><br>''Малюнок 3. Джон Дальтон''<br>''(1766-1844), англійський хімік і фізик, творець хімічної атомістичної теорії''<br><br>Поняття "Атомна маса" ввів Дж. Дальтон (1803). Він же вперше визначив Атомну масу. Великі роботи по встановленню Атомної маси були виконані в 1-ій половині 19 століття Я. Берцелиусом, пізніше Ж. С. Стасом і Т. У. Річардсом. У 1869 році Д. І. Менделєєв відкрив закон періодичної залежності властивостей елементів від Атомної маси і на його основі виправив Атомні маси багатьох відомих у той час елементів (Be, U, La і інших) і, крім того, передбачив Атомні маси ще не відкритих тоді Ga, Ge, Sc. Після відкриття Ф. Содді (1914) явища ізотопії поняття "Атомна маса" стали відносити і до елементів, що складається з суміші ізотопів, і до окремих ізотопів.<br>До вашої уваги дев’ята частина циклу "Світ всередині атомного ядра" - "Джерела маси" | + | <br>Для вимірювання маси атомів і молекул до 1961 року в хімії застосовувалася а. е. м., рівна 1 / 16 атомної маси елемента кисню. А у фізиці за а. Є.М. приймалася 1 / 16 маси атома найлегшого зі стабільних ізотопів кисню. Значення фізичної а. е. м. і хімічної а. е. м. різнилися: хімічна була в 1,000275 рази більше фізичної, так як природний кисень містить 3 стабільних ізотопи: 16O (99,76%), 17O (0,04%), 18O (0,20%). Тому в 1961 р. була встановлена як у фізиці, так і в хімії уніфікована а. е. м., рівна 1,0003179 колишньої фізичної а.е.м. і вельми близькою за значенням до колишньої хімічної а.е.м. Для елементарних частинок (електронів, нуклонів, мезонів і т. п.) як одиниці маси застосовують масу електрона, рівну 5,4858026.10-4 уніфікованої а. е. м. або 9,1091 Ї.10-1928.<br>Маса і кількість речовини - поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини - в молях. Між масою речовини (т, м), кількістю речовини (п, моль) і молярною масою (М, г / моль) існують прості співвідношення: m = nM, n = m / MM = m / n За цим формулам легко обчислити масу визначеної кількості речовини, або визначити кількість речовини у відомій Ассе його, або знайти молярну масу речовини.<br>[[Image:him7_7_3.jpg]]<br>''Малюнок 3. Джон Дальтон''<br>''(1766-1844), англійський хімік і фізик, творець хімічної атомістичної теорії''<br><br>Поняття "Атомна маса" ввів Дж. Дальтон (1803). Він же вперше визначив Атомну масу. Великі роботи по встановленню Атомної маси були виконані в 1-ій половині 19 століття Я. Берцелиусом, пізніше Ж. С. Стасом і Т. У. Річардсом. У 1869 році Д. І. Менделєєв відкрив закон періодичної залежності властивостей елементів від Атомної маси і на його основі виправив Атомні маси багатьох відомих у той час елементів (Be, U, La і інших) і, крім того, передбачив Атомні маси ще не відкритих тоді Ga, Ge, Sc. Після відкриття Ф. Содді (1914) явища ізотопії поняття "Атомна маса" стали відносити і до елементів, що складається з суміші ізотопів, і до окремих ізотопів.<br>До вашої уваги дев’ята частина циклу "Світ всередині атомного ядра" - "Джерела маси" |
| | | | |
| | <br>http://www.youtube.com/watch?v=fqaWcKZX_Hc<br><br>'''''Контролюючий блок №1'''''<br>1. Розкрийте поняття - атомна одиниця маси.<br>2. Чи різняться значення фізичної а. е. м. і хімічної а. е. м.?<br>3. Хто ввів в хімії поняття "Атомна маса"? | | <br>http://www.youtube.com/watch?v=fqaWcKZX_Hc<br><br>'''''Контролюючий блок №1'''''<br>1. Розкрийте поняття - атомна одиниця маси.<br>2. Чи різняться значення фізичної а. е. м. і хімічної а. е. м.?<br>3. Хто ввів в хімії поняття "Атомна маса"? |
| | | | |
| - | '''''<br>Частина 2<br>Відносна атомна маса хімічних елементів.'''''<br>Символи, назви, атомні ваги і природний ізотопний склад деяких хімічних елементів.<br>''Таблиця 1.''<br><br> | + | '''''<br>Частина 2<br>Відносна атомна маса хімічних елементів.'''''<br>Символи, назви, атомні ваги і природний ізотопний склад деяких хімічних елементів.<br>''Таблиця 1.''<br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" style="width: 509px; height: 294px;" | | {| cellspacing="1" cellpadding="1" border="1" style="width: 509px; height: 294px;" |
| | |- | | |- |
| - | | '''Елемент і його символ з масовим числом і зарядом ядра'''<br> | + | | '''Елемент і його символ з масовим числом і зарядом ядра'''<br> |
| - | | '''Латинська назва<br>(Як читається) <br> <br>''' | + | | '''Латинська назва<br>(Як читається) <br> <br>''' |
| - | | + | | ''' Атомна вага природного елемента '''<br> |
| - | | ''' Атомна вага природного елемента '''<br> | + | | ''' Атомна вага ізотопів'''<br> |
| - | | ''' Атомна вага ізотопів'''<br> | + | |
| | | ''' ''Зміст ізотопів у природному елементі,%'''''<br> | | | ''' ''Зміст ізотопів у природному елементі,%'''''<br> |
| | |- | | |- |
| - | | Водень<br>1<sub>1</sub>H<br>2<sub>1</sub>H (D)<br> | + | | Водень<br>1<sub>1</sub>H<br>2<sub>1</sub>H (D)<br> |
| - | | Hydrogenium<br>(Гідрогеніум)<br><br> | + | | Hydrogenium<br>(Гідрогеніум)<br><br> |
| - | | 1,0079<br> | + | | 1,0079<br> |
| - | | 1,0078<br>2,0140<br><br> | + | | 1,0078<br>2,0140<br><br> |
| | | 99,984<br>0,0156<br><br> | | | 99,984<br>0,0156<br><br> |
| | |- | | |- |
| - | | Вуглець<br>12<sub>6</sub>C<br>13<sub>6</sub>C<br> | + | | Вуглець<br>12<sub>6</sub>C<br>13<sub>6</sub>C<br> |
| - | | Carboneum<br>(Карбоніум)<br><br> | + | | Carboneum<br>(Карбоніум)<br><br> |
| - | | 12,011<br> | + | | 12,011<br> |
| - | | 12,00000<br>13,00335<br><br> | + | | 12,00000<br>13,00335<br><br> |
| | | 98,892<br>1,108<br><br> | | | 98,892<br>1,108<br><br> |
| | |- | | |- |
| - | | Азот<br>14<sub>7</sub>N<br>15<sub>7</sub>N<br> | + | | Азот<br>14<sub>7</sub>N<br>15<sub>7</sub>N<br> |
| - | | Nitrogenium<br>(Нітрогеніум)<br><br> | + | | Nitrogenium<br>(Нітрогеніум)<br><br> |
| - | | 14,0067<br> | + | | 14,0067<br> |
| - | | 14,00307<br>15,00011<br><br> | + | | 14,00307<br>15,00011<br><br> |
| | | 99,635<br>0,365<br><br> | | | 99,635<br>0,365<br><br> |
| | |- | | |- |
| - | | Кисень<br>16<sub>8</sub>O<br>17<sub>8</sub>O<br>18<sub>8</sub>O<br> | + | | Кисень<br>16<sub>8</sub>O<br>17<sub>8</sub>O<br>18<sub>8</sub>O<br> |
| - | | Oxygenium<br>(Оксігеніум)<br> | + | | Oxygenium<br>(Оксігеніум)<br> |
| - | | 15,9994<br> | + | | 15,9994<br> |
| - | | 15,99491<br>16,9991<br>17,9992<br><br> | + | | 15,99491<br>16,9991<br>17,9992<br><br> |
| | | 99,759<br>0,037<br>0,204<br><br> | | | 99,759<br>0,037<br>0,204<br><br> |
| | |- | | |- |
| - | | Натрій<br>23<sub>11</sub>Na<br> | + | | Натрій<br>23<sub>11</sub>Na<br> |
| - | | Natrium<br>(Натріум)<br><br> | + | | Natrium<br>(Натріум)<br><br> |
| - | | 22,9898<br> | + | | 22,9898<br> |
| - | | 22,9898<br> | + | | 22,9898<br> |
| | | 100<br> | | | 100<br> |
| | |- | | |- |
| - | | Хлор<br>35<sub>17</sub>Cl<br>3717Cl<br> | + | | Хлор<br>35<sub>17</sub>Cl<br>3717Cl<br> |
| - | | Chlorum<br>(хлорум)<br><br> | + | | Chlorum<br>(хлорум)<br><br> |
| - | | 35,453<br> | + | | 35,453<br> |
| - | | 34,96885<br>36,9658<br><br> | + | | 34,96885<br>36,9658<br><br> |
| | | 75,53<br>24,47<br><br> | | | 75,53<br>24,47<br><br> |
| | |} | | |} |
| | | | |
| - | <br>Назви елементів латинською та українською мовою і латинські символи цих елементів наведені для того, щоб ми поступово починали знайомитися з усіма елементами. З таблиці видно, що середня виміряна атомна вага знайденого в природі елемента залежить від того, скільки в ньому міститься різних ізотопів.<br>Атомна вага елемента дорівнює середньому значенню з атомних ваг всіх його природних ізотопів з урахуванням їх поширеності.<br>Наприклад, елемент хлор в природі знаходиться у вигляді двох ізотопів: хлор-35 і хлор-37. Їх зміст становить 75,53% і 24,47% (див. табл. 1). Якщо загальний вміст двох ізотопів хлору в сумі прийняти за одиницю, то одного з них - приблизно 0,75 і іншого - приблизно 0,25 (в частках одиниці). Тоді атомна вага природного суміші двох ізотопів хлору закруглено дорівнює:<br>34,97 × 0,75 + 36,96 × 0,25 = 35,5 а.е.м.<br>Дефект маси - зменшення маси атома в порівнянні з сумарною масою всіх окремо взятих складових його елементарних частинок, обумовлене енергією їх зв'язку в атомі.<br>Якщо "розібрати" ядро атома на окремі протони і нейтрони (наприклад, за допомогою ядерної реакції), то їх маса знову прийме саме ті значення, які нам вже відомі: 1,00728 а.о.м. для протона і 1,00867 а.е.м. для нейтрона.<br><br>''Малюнок 4. Будова атома''<br><br>Дефект маси є наслідком універсального співвідношення E = Mc2, що випливає з теорії відносності А. Ейнштейна, де E - повна енергія системи, c = 3.1010 см / сек - швидкість світла у порожнечі, M - маса системи (у нашому випадку - атома). Тоді DM = DЕ/c2, де DM - дефект маси, а DE - енергія зв'язку нуклонів в ядрі, тобто енергія, яку необхідно затратити для поділу ядра атома на окремі протони і нейтрони. Таким чином, чим більше дефект маси, тим більше енергія зв'язування нуклонів в ядрі і тим стійкіше ядро атома елемента. Зі збільшенням числа протонів у ядрі (І масового числа) дефект маси спочатку зростає від нуля (для 1H) до максимуму (у 64Ni), а потім поступово зменшується для більш важких елементів.<br><br>''Малюнок 5. Схематичне зображення атомного ядра: нуклони (протони і нейтрони), кожен з яких складається з 3-х кварків і великої кількості часток, якими вони обмінюються.'' | + | <br>Назви елементів латинською та українською мовою і латинські символи цих елементів наведені для того, щоб ми поступово починали знайомитися з усіма елементами. З таблиці видно, що середня виміряна атомна вага знайденого в природі елемента залежить від того, скільки в ньому міститься різних ізотопів.<br>Атомна вага елемента дорівнює середньому значенню з атомних ваг всіх його природних ізотопів з урахуванням їх поширеності.<br>Наприклад, елемент хлор в природі знаходиться у вигляді двох ізотопів: хлор-35 і хлор-37. Їх зміст становить 75,53% і 24,47% (див. табл. 1). Якщо загальний вміст двох ізотопів хлору в сумі прийняти за одиницю, то одного з них - приблизно 0,75 і іншого - приблизно 0,25 (в частках одиниці). Тоді атомна вага природного суміші двох ізотопів хлору закруглено дорівнює:<br>34,97 × 0,75 + 36,96 × 0,25 = 35,5 а.е.м.<br>Дефект маси - зменшення маси атома в порівнянні з сумарною масою всіх окремо взятих складових його елементарних частинок, обумовлене енергією їх зв'язку в атомі.<br>Якщо "розібрати" ядро атома на окремі протони і нейтрони (наприклад, за допомогою ядерної реакції), то їх маса знову прийме саме ті значення, які нам вже відомі: 1,00728 а.о.м. для протона і 1,00867 а.е.м. для нейтрона.<br>[[Image:him7_7_4.jpg]]<br>''Малюнок 4. Будова атома''<br><br>Дефект маси є наслідком універсального співвідношення E = Mc2, що випливає з теорії відносності А. Ейнштейна, де E - повна енергія системи, c = 3.1010 см / сек - швидкість світла у порожнечі, M - маса системи (у нашому випадку - атома). Тоді DM = DЕ/c2, де DM - дефект маси, а DE - енергія зв'язку нуклонів в ядрі, тобто енергія, яку необхідно затратити для поділу ядра атома на окремі протони і нейтрони. Таким чином, чим більше дефект маси, тим більше енергія зв'язування нуклонів в ядрі і тим стійкіше ядро атома елемента. Зі збільшенням числа протонів у ядрі (І масового числа) дефект маси спочатку зростає від нуля (для 1H) до максимуму (у 64Ni), а потім поступово зменшується для більш важких елементів.<br>[[Image:him7_7_5.jpg]]<br>''Малюнок 5. Схематичне зображення атомного ядра: нуклони (протони і нейтрони), кожен з яких складається з 3-х кварків і великої кількості часток, якими вони обмінюються.'' |
| | | | |
| | <br>Перегляньте будь ласка це відео, з нього ви дізнаєтесь, як визначить атомну масу металу | | <br>Перегляньте будь ласка це відео, з нього ви дізнаєтесь, як визначить атомну масу металу |
Версия 19:37, 12 ноября 2010
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Атомна одиниця маси. Відносна атомна маса хімічних елементів. Повні уроки
Мета уроку:
1. Вивчити поняття атомна одиниця маси.
2. Розглянути, які є відносні атомні маси хімічних елементив
Хід уроку:
Частина 1.
Атомна одиниця маси.
Атомна одиниця маси (а. о м.), одиниця маси для вираження мас мікрочасток. За 1 а.е.м. прийнята 1 / 12 частина маси найбільш поширеного і легкого ізотопу вуглецю 12С з масовим числом 12 (т. зв. вуглецева шкала). 1 а.е.м. = 1,6605655 (86) • 10-27 кг.
Для перекладу значень мас m частинок, виражених в а.е.м., в одиницю маси СІ (кг) користуються формулою:
m (кг) = m (до а.е.м.)* NA,
де m (до а.е.м.) - маса частинки в кілоатомних одиницях, NA - стала Авогадро.

Малюнок 1. Розрахунок абсолютних мас атомів і молекул
Оскільки 1 а.е.м. є величиною, обернено пропорційній числу Авогадро, тобто 1/NA г, то молярна маса певного елементу, виражена в грамах на моль, цілком співпадає з масою атома цього елемента, вираженої в а. е. м.

Малюнок 2. Латинська назва - Aurum, позначення - Au.
атомний номер – 79, атомна маса - 196,9665.
Для вимірювання маси атомів і молекул до 1961 року в хімії застосовувалася а. е. м., рівна 1 / 16 атомної маси елемента кисню. А у фізиці за а. Є.М. приймалася 1 / 16 маси атома найлегшого зі стабільних ізотопів кисню. Значення фізичної а. е. м. і хімічної а. е. м. різнилися: хімічна була в 1,000275 рази більше фізичної, так як природний кисень містить 3 стабільних ізотопи: 16O (99,76%), 17O (0,04%), 18O (0,20%). Тому в 1961 р. була встановлена як у фізиці, так і в хімії уніфікована а. е. м., рівна 1,0003179 колишньої фізичної а.е.м. і вельми близькою за значенням до колишньої хімічної а.е.м. Для елементарних частинок (електронів, нуклонів, мезонів і т. п.) як одиниці маси застосовують масу електрона, рівну 5,4858026.10-4 уніфікованої а. е. м. або 9,1091 Ї.10-1928.
Маса і кількість речовини - поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини - в молях. Між масою речовини (т, м), кількістю речовини (п, моль) і молярною масою (М, г / моль) існують прості співвідношення: m = nM, n = m / MM = m / n За цим формулам легко обчислити масу визначеної кількості речовини, або визначити кількість речовини у відомій Ассе його, або знайти молярну масу речовини.
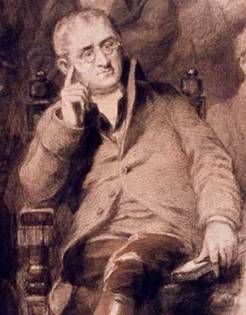
Малюнок 3. Джон Дальтон
(1766-1844), англійський хімік і фізик, творець хімічної атомістичної теорії
Поняття "Атомна маса" ввів Дж. Дальтон (1803). Він же вперше визначив Атомну масу. Великі роботи по встановленню Атомної маси були виконані в 1-ій половині 19 століття Я. Берцелиусом, пізніше Ж. С. Стасом і Т. У. Річардсом. У 1869 році Д. І. Менделєєв відкрив закон періодичної залежності властивостей елементів від Атомної маси і на його основі виправив Атомні маси багатьох відомих у той час елементів (Be, U, La і інших) і, крім того, передбачив Атомні маси ще не відкритих тоді Ga, Ge, Sc. Після відкриття Ф. Содді (1914) явища ізотопії поняття "Атомна маса" стали відносити і до елементів, що складається з суміші ізотопів, і до окремих ізотопів.
До вашої уваги дев’ята частина циклу "Світ всередині атомного ядра" - "Джерела маси"
http://www.youtube.com/watch?v=fqaWcKZX_Hc
Контролюючий блок №1
1. Розкрийте поняття - атомна одиниця маси.
2. Чи різняться значення фізичної а. е. м. і хімічної а. е. м.?
3. Хто ввів в хімії поняття "Атомна маса"?
Частина 2
Відносна атомна маса хімічних елементів.
Символи, назви, атомні ваги і природний ізотопний склад деяких хімічних елементів.
Таблиця 1.
Елемент і його символ з масовим числом і зарядом ядра
| Латинська назва
(Як читається)
| Атомна вага природного елемента
| Атомна вага ізотопів
| Зміст ізотопів у природному елементі,%
|
Водень
11H
21H (D)
| Hydrogenium
(Гідрогеніум)
| 1,0079
| 1,0078
2,0140
| 99,984
0,0156
|
Вуглець
126C
136C
| Carboneum
(Карбоніум)
| 12,011
| 12,00000
13,00335
| 98,892
1,108
|
Азот
147N
157N
| Nitrogenium
(Нітрогеніум)
| 14,0067
| 14,00307
15,00011
| 99,635
0,365
|
Кисень
168O
178O
188O
| Oxygenium
(Оксігеніум)
| 15,9994
| 15,99491
16,9991
17,9992
| 99,759
0,037
0,204
|
Натрій
2311Na
| Natrium
(Натріум)
| 22,9898
| 22,9898
| 100
|
Хлор
3517Cl
3717Cl
| Chlorum
(хлорум)
| 35,453
| 34,96885
36,9658
| 75,53
24,47
|
Назви елементів латинською та українською мовою і латинські символи цих елементів наведені для того, щоб ми поступово починали знайомитися з усіма елементами. З таблиці видно, що середня виміряна атомна вага знайденого в природі елемента залежить від того, скільки в ньому міститься різних ізотопів.
Атомна вага елемента дорівнює середньому значенню з атомних ваг всіх його природних ізотопів з урахуванням їх поширеності.
Наприклад, елемент хлор в природі знаходиться у вигляді двох ізотопів: хлор-35 і хлор-37. Їх зміст становить 75,53% і 24,47% (див. табл. 1). Якщо загальний вміст двох ізотопів хлору в сумі прийняти за одиницю, то одного з них - приблизно 0,75 і іншого - приблизно 0,25 (в частках одиниці). Тоді атомна вага природного суміші двох ізотопів хлору закруглено дорівнює:
34,97 × 0,75 + 36,96 × 0,25 = 35,5 а.е.м.
Дефект маси - зменшення маси атома в порівнянні з сумарною масою всіх окремо взятих складових його елементарних частинок, обумовлене енергією їх зв'язку в атомі.
Якщо "розібрати" ядро атома на окремі протони і нейтрони (наприклад, за допомогою ядерної реакції), то їх маса знову прийме саме ті значення, які нам вже відомі: 1,00728 а.о.м. для протона і 1,00867 а.е.м. для нейтрона.
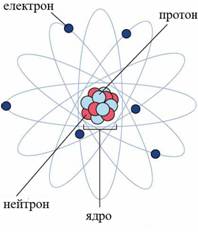
Малюнок 4. Будова атома
Дефект маси є наслідком універсального співвідношення E = Mc2, що випливає з теорії відносності А. Ейнштейна, де E - повна енергія системи, c = 3.1010 см / сек - швидкість світла у порожнечі, M - маса системи (у нашому випадку - атома). Тоді DM = DЕ/c2, де DM - дефект маси, а DE - енергія зв'язку нуклонів в ядрі, тобто енергія, яку необхідно затратити для поділу ядра атома на окремі протони і нейтрони. Таким чином, чим більше дефект маси, тим більше енергія зв'язування нуклонів в ядрі і тим стійкіше ядро атома елемента. Зі збільшенням числа протонів у ядрі (І масового числа) дефект маси спочатку зростає від нуля (для 1H) до максимуму (у 64Ni), а потім поступово зменшується для більш важких елементів.

Малюнок 5. Схематичне зображення атомного ядра: нуклони (протони і нейтрони), кожен з яких складається з 3-х кварків і великої кількості часток, якими вони обмінюються.
Перегляньте будь ласка це відео, з нього ви дізнаєтесь, як визначить атомну масу металу
http://www.youtube.com/watch?v=NXuKUH7W4SU
Відомо, що атом вуглецю грає першорядну роль в зародженні і підтримці життя на нашій планеті, можна сказати, що він Альфа і Омега життя на Земле. Якщо поглянути на атом вуглецю під різними кутами, то можна побачити такі священні символи, як свастика, Кумбха, омкара, альфа і омега.
http://www.youtube.com/watch?v=eSw7mxM357Q
Контролюючий блок №1
1. Від чого залежить середня виміряна атомна вага елемента?
2. Чому дорівнює атомна вага елемента?
3. Приведіть будь який приклад: розрахуйте атомну вагу хлору і ще декілька хімічних елементів на ваш розсуд.
4. Розкрийте поняття «дефект маси»?
Список джерел:
1. Шиманович І.Є., Павлович М.Л., Тікавий В.Ф., Малашков П.М. "Загальна хімія в формулах, визначеннях, схемах"
2. Лідін Р.А., Молочко В.А., Андреєва Л.Л. "Хімічні властивості неорганічних речовин" М.: Хімія, 2000
3. Складання хімічних рівнянь. Кудрявцев А.А. 2001
4. Супрамолекулярна хімія. У 2 томах. Стід Дж. В., Етвуд Дж. Л. 2007
Урок на тему: " Атомна одиниця маси. Відносна атомна маса хімічних елементів." Підготувала вчитель хімії Бірюкова Гана Іванівна. м. Полтава
Відредаговано та надіслано Горбатко С. М.
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
Предмети > Хімія > Хімія 7 клас
|