|
|
|
| Строка 5: |
Строка 5: |
| | [[Image:Him7 8 1.jpg]]<br>'' графіт алмаз<br>Малюнок 1. Алотропні форми існування вуглецю.''<br><br>До вашої уваги відео про ці алотропні форми вуглецю | | [[Image:Him7 8 1.jpg]]<br>'' графіт алмаз<br>Малюнок 1. Алотропні форми існування вуглецю.''<br><br>До вашої уваги відео про ці алотропні форми вуглецю |
| | | | |
| - | <br>http://www.youtube.com/watch?v=A0_zmHys5Jo <br>В даний час відомо близько 400 алотропних видозмін простих речовин. Різноманіття складних речовин зумовлена їх різним якісним і кількісним складом. Наприклад, відомо для азоту п'ять форм оксидів: N2O, NO, N2O3, NO2, N2O5; для водню дві форми: Н2О і Н2О2 і ін. З точки зору теорії будови атома кількісний склад неорганічних сполук визначається кількістю електронів в електронній оболонці атома і кількістю протонів і нейтронів в атомному ядрі. <br>Органічних речовин в даний час описано близько двох мільйонів, і щорічно вчені-хіміки усього світу синтезують близько 30000 нових речовин, в той час як неорганічних речовин налічується кілька сотень тисяч. У зв'язку з цим виникає питання: як пояснити таке різноманіття органічних речовин? <br>Пояснюється це наступним. Так як до складу молекул органічних речовин в якості обов'язкового елемента входить вуглець, то, очевидно, він і визначає різноманіття, властивості і особливості органічних речовин. Вуглець в періодичній системі займає положення між типовими металами і неметалами. Як по відношенню до кисню, так і до водню він однаково чотиривалентним. Його атоми здатні з'єднуватися з атомами великого числа інших хімічних елементів. Крім того, атоми вуглецю здатні до взаємного з'єднання з утворенням лінійних, розгалужених і кільчастих ланцюжків, наприклад:<br>[[Image:Him7 8 2.jpg]]<br>''Малюнок 2. Приклади ланцюгів атомів вуглецю.''<br><br>При цьому вуглецеві атоми зв'язуються один з одним за допомогою простих (одинарних), подвійних і потрійних хімічних зв'язків, наприклад:<br>'''''<br>'''''<i>Малюнок 3. Приклад хімічних зв’язків.</i><br><br>'''''Контролюючий блок №1'''''<br>1. Розкажіть чим зумовлена різноманіття складних речовин?<br>2. Як пояснити таке різноманіття органічних речовин?<br>3. Приведіть приклади ланцюгів атомів вуглецю.<br><br>'''''Частина 2<br>Прості й складні речовини'''''<br>Хімічні речовини підрозділяються на прості і складні. <br>Прості речовини — це речовини, утворені з атомів одного елемента. Наприклад, проста речовина вугілля утворене атомами елемента вуглецю, простої речовина залізо — атомами елемента заліза, простої речовина азот — атомами елемента азоту. Поняття “проста речовина” не можна ототожнювати з поняттям “хімічний елемент”. Проста речовина характеризується визначеною щільністю, розчинністю, температурами плавлення і кипіння і т.п. Ці властивості відносяться до сукупності атомів і для різних простих речовин вони різні. Хімічний елемент характеризується визначеним позитивним зарядом ядра атома (порядковим номером), ступенем окислювання, ізотопною сполукою і т.д. Властивості елементів відносяться до його окремих атомів.<br>Складні речовини, чи хімічні сполуки, — це речовини, утворені атомами різних елементів.<br>Так, оксид міді (II) утворений атомами елементів міді і кисню, вода — атомами елементів водню і кисню.<br>[[Image:Him7 8 4.jpg]]<br>''Малюнок 4. Кристалічна решітка оксиду міді'' | + | <br>http://www.youtube.com/watch?v=A0_zmHys5Jo <br>В даний час відомо близько 400 алотропних видозмін простих речовин. Різноманіття складних речовин зумовлена їх різним якісним і кількісним складом. Наприклад, відомо для азоту п'ять форм оксидів: N2O, NO, N2O3, NO2, N2O5; для водню дві форми: Н2О і Н2О2 і ін. З точки зору теорії будови атома кількісний склад неорганічних сполук визначається кількістю електронів в електронній оболонці атома і кількістю протонів і нейтронів в атомному ядрі. <br>Органічних речовин в даний час описано близько двох мільйонів, і щорічно вчені-хіміки усього світу синтезують близько 30000 нових речовин, в той час як неорганічних речовин налічується кілька сотень тисяч. У зв'язку з цим виникає питання: як пояснити таке різноманіття органічних речовин? <br>Пояснюється це наступним. Так як до складу молекул органічних речовин в якості обов'язкового елемента входить вуглець, то, очевидно, він і визначає різноманіття, властивості і особливості органічних речовин. Вуглець в періодичній системі займає положення між типовими металами і неметалами. Як по відношенню до кисню, так і до водню він однаково чотиривалентним. Його атоми здатні з'єднуватися з атомами великого числа інших хімічних елементів. Крім того, атоми вуглецю здатні до взаємного з'єднання з утворенням лінійних, розгалужених і кільчастих ланцюжків, наприклад:<br>[[Image:Him7 8 2.jpg]]<br>''Малюнок 2. Приклади ланцюгів атомів вуглецю.''<br><br>При цьому вуглецеві атоми зв'язуються один з одним за допомогою простих (одинарних), подвійних і потрійних хімічних зв'язків, наприклад:<br><br><br>'''''Контролюючий блок №1'''''<br>1. Розкажіть чим зумовлена різноманіття складних речовин?<br>2. Як пояснити таке різноманіття органічних речовин?<br>3. Приведіть приклади ланцюгів атомів вуглецю.<br><br>'''''Частина 2<br>Прості й складні речовини'''''<br>Хімічні речовини підрозділяються на прості і складні. <br>Прості речовини — це речовини, утворені з атомів одного елемента. Наприклад, проста речовина вугілля утворене атомами елемента вуглецю, простої речовина залізо — атомами елемента заліза, простої речовина азот — атомами елемента азоту. Поняття “проста речовина” не можна ототожнювати з поняттям “хімічний елемент”. Проста речовина характеризується визначеною щільністю, розчинністю, температурами плавлення і кипіння і т.п. Ці властивості відносяться до сукупності атомів і для різних простих речовин вони різні. Хімічний елемент характеризується визначеним позитивним зарядом ядра атома (порядковим номером), ступенем окислювання, ізотопною сполукою і т.д. Властивості елементів відносяться до його окремих атомів.<br>Складні речовини, чи хімічні сполуки, — це речовини, утворені атомами різних елементів.<br>Так, оксид міді (II) утворений атомами елементів міді і кисню, вода — атомами елементів водню і кисню.<br>[[Image:Him7 8 4.jpg]]<br>''Малюнок 3. Кристалічна решітка оксиду міді'' |
| | | | |
| | <br>На цьому відео продемонстровано як оксид міді легко відновлюється воднем до міді | | <br>На цьому відео продемонстровано як оксид міді легко відновлюється воднем до міді |
| | | | |
| - | <br>http://www.youtube.com/watch?v=PlOH0ldh83s <br>Складні речовини складаються не з простих речовин, а з елементів. Наприклад, вода складається не з простих речовин водню і кисню, а з елементів водню і кисню. Назви елементів звичайно збігаються з назвами відповідних їм простих речовин (виключення: вуглець і одне з простих речовин кисню — озон).<br>Які ж бувають речовини?<br>Відповіддю на це питання може служити схема, в основі якої лежить класифікація речовин за кількісним та якісним складом.<br>Використовуючи схему, можна коротко охарактеризувати речовини прості і складні, склад речовин різних класів, навести приклади.<br>[[Image:Him7 8 5.jpg]]<br>''Малюнок 5. Схема розподілу речовин''<br><br>Звернемо увагу на схему на якому зображена таблиця розподілу речовин: складні речовини у свою чергу також поділяються –<br>Оксиди - це складні речовини, що складаються з двох елементів, один з яких кисень.<br>Кислоти - це електроліти, при дисоціації яких з позитивних іонів утворюються тільки іони водню (Н +).<br>Підстави - це електроліти, при дисоціації яких з негативних іонів утворюються тільки гідроксид-іони (ОН-).<br>Солі - це електроліти, при дисоціації яких утворюються катіони металів і аніони кислотного залишку.<br>Далі слід привести рівняння реакцій, що характеризують основні властивості кожного класу сполук.<br>Для оксидів такою властивістю є взаємодія з водою:<br>[[Image:Him7 8 6.dif]]<br>''Малюнок 6. Приклади взаємодії оксидів з водою.''<br><br>'''''Контролюючий блок №2'''''<br>1. На які речовини розподіляються хімічні речовин?<br>2. Розкрийте поняття складних та простих речовин.<br>3. Як далі розподіляються прості речовини? Приведіть приклади<br>4. Як далі розподіляються складні речовини? Приведіть приклади<br>5. Розкажіть, що таке оксиди, кислоти, підстави та солі. | + | <br>http://www.youtube.com/watch?v=PlOH0ldh83s <br>Складні речовини складаються не з простих речовин, а з елементів. Наприклад, вода складається не з простих речовин водню і кисню, а з елементів водню і кисню. Назви елементів звичайно збігаються з назвами відповідних їм простих речовин (виключення: вуглець і одне з простих речовин кисню — озон).<br>Які ж бувають речовини?<br>Відповіддю на це питання може служити схема, в основі якої лежить класифікація речовин за кількісним та якісним складом.<br>Використовуючи схему, можна коротко охарактеризувати речовини прості і складні, склад речовин різних класів, навести приклади.<br>[[Image:Him7 8 5.jpg]]<br>''Малюнок 4. Схема розподілу речовин''<br><br>Звернемо увагу на схему на якому зображена таблиця розподілу речовин: складні речовини у свою чергу також поділяються –<br>Оксиди - це складні речовини, що складаються з двох елементів, один з яких кисень.<br>Кислоти - це електроліти, при дисоціації яких з позитивних іонів утворюються тільки іони водню (Н +).<br>Підстави - це електроліти, при дисоціації яких з негативних іонів утворюються тільки гідроксид-іони (ОН-).<br>Солі - це електроліти, при дисоціації яких утворюються катіони металів і аніони кислотного залишку.<br>Далі слід привести рівняння реакцій, що характеризують основні властивості кожного класу сполук.<br>Для оксидів такою властивістю є взаємодія з водою:<br>[[Image:Him7 8 6.dif]][[Image:him7_8_6.gif]]<br>''Малюнок 5. Приклади взаємодії оксидів з водою.''<br><br>'''''Контролюючий блок №2'''''<br>1. На які речовини розподіляються хімічні речовин?<br>2. Розкрийте поняття складних та простих речовин.<br>3. Як далі розподіляються прості речовини? Приведіть приклади<br>4. Як далі розподіляються складні речовини? Приведіть приклади<br>5. Розкажіть, що таке оксиди, кислоти, підстави та солі. |
| | | | |
| | <br>'''''Частина 3<br>Метали й неметали'''''<br>Майже всі метали - тверді блискучі речовини, вони добре проводять електричний струм, ковкі і пластичні, за допомогою лиття з них можна отримувати вироби практично будь-якої форми. <br>Розрізняють фізичні і хімічні властивості металів. У загальному випадку, властивості металів досить різноманітні. Розрізняють метали лужні, лужноземельні, чорні, кольорові, лантаноїди (або рідкоземельні метали - близькі за хімічними властивостями до лужноземельних), актиноїди (більшість з них - радіоактивні елементи), шляхетні й платинові метали.<br>Крім того, окремі метали проявляють як металеві, так і неметалеві властивості. Такі метали - амфотерні (або як кажуть - перехідні).<br>''[[Image:Him7 8 7.jpg]]<br>Малюнок 7. Таблиця «Лужні метали»'' | | <br>'''''Частина 3<br>Метали й неметали'''''<br>Майже всі метали - тверді блискучі речовини, вони добре проводять електричний струм, ковкі і пластичні, за допомогою лиття з них можна отримувати вироби практично будь-якої форми. <br>Розрізняють фізичні і хімічні властивості металів. У загальному випадку, властивості металів досить різноманітні. Розрізняють метали лужні, лужноземельні, чорні, кольорові, лантаноїди (або рідкоземельні метали - близькі за хімічними властивостями до лужноземельних), актиноїди (більшість з них - радіоактивні елементи), шляхетні й платинові метали.<br>Крім того, окремі метали проявляють як металеві, так і неметалеві властивості. Такі метали - амфотерні (або як кажуть - перехідні).<br>''[[Image:Him7 8 7.jpg]]<br>Малюнок 7. Таблиця «Лужні метали»'' |
Версия 20:37, 12 ноября 2010
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Багатоманітність речовин. Прості й складні речовини. Метали й неметали. Повні уроки
Мета уроку:
1. Розширити знання учнів про періодичну систему елементів;
2. Закріпити знання учнів про хімічний елемент, хімічну символіку;
3. Запровадити поняття про багатоманітність Речовини;
4. Дати елементарно класифікацію елементів на метали та не металізованими, а також їх поширення в природі;
5. Навчити розрізняти металічні й неметалічні елементи за також їх положенням у періодичній системі;
6. Показати суттєву відмінність фізичних властивостями металів й неметалів;
7. Розвивати логічне мислення;
8. Розвивати вміння та навички:
а) працювати з періодичною системою хімічних елементів,
б) характеризувати хімічний елемент по положенню в періодичній системі, визначатися кількість протонів, нейтронів та електронів,
в) узагальнювати вивченості матеріал, вибирати головне, робити висновки.
Хід уроку:
Частина 1
Багатоманітність речовин.
При вивченні неорганічних речовин було встановлено їх різноманіття. Дійсно, всі елементи періодичної системи здатні до взаємного з'єднання в самих різних поєднаннях. При цьому утворюються, як прості, так і складні речовини. Для багатьох простих речовин відомі їхні алотропні форми існування: вуглець - у формі графіту і алмазу і т.д.

графіт алмаз
Малюнок 1. Алотропні форми існування вуглецю.
До вашої уваги відео про ці алотропні форми вуглецю
http://www.youtube.com/watch?v=A0_zmHys5Jo
В даний час відомо близько 400 алотропних видозмін простих речовин. Різноманіття складних речовин зумовлена їх різним якісним і кількісним складом. Наприклад, відомо для азоту п'ять форм оксидів: N2O, NO, N2O3, NO2, N2O5; для водню дві форми: Н2О і Н2О2 і ін. З точки зору теорії будови атома кількісний склад неорганічних сполук визначається кількістю електронів в електронній оболонці атома і кількістю протонів і нейтронів в атомному ядрі.
Органічних речовин в даний час описано близько двох мільйонів, і щорічно вчені-хіміки усього світу синтезують близько 30000 нових речовин, в той час як неорганічних речовин налічується кілька сотень тисяч. У зв'язку з цим виникає питання: як пояснити таке різноманіття органічних речовин?
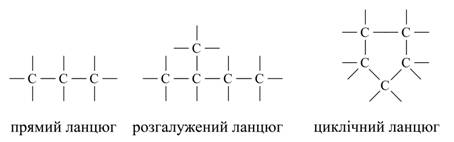
Пояснюється це наступним. Так як до складу молекул органічних речовин в якості обов'язкового елемента входить вуглець, то, очевидно, він і визначає різноманіття, властивості і особливості органічних речовин. Вуглець в періодичній системі займає положення між типовими металами і неметалами. Як по відношенню до кисню, так і до водню він однаково чотиривалентним. Його атоми здатні з'єднуватися з атомами великого числа інших хімічних елементів. Крім того, атоми вуглецю здатні до взаємного з'єднання з утворенням лінійних, розгалужених і кільчастих ланцюжків, наприклад:

Малюнок 2. Приклади ланцюгів атомів вуглецю.
При цьому вуглецеві атоми зв'язуються один з одним за допомогою простих (одинарних), подвійних і потрійних хімічних зв'язків, наприклад:
Контролюючий блок №1
1. Розкажіть чим зумовлена різноманіття складних речовин?
2. Як пояснити таке різноманіття органічних речовин?
3. Приведіть приклади ланцюгів атомів вуглецю.
Частина 2
Прості й складні речовини
Хімічні речовини підрозділяються на прості і складні.
Прості речовини — це речовини, утворені з атомів одного елемента. Наприклад, проста речовина вугілля утворене атомами елемента вуглецю, простої речовина залізо — атомами елемента заліза, простої речовина азот — атомами елемента азоту. Поняття “проста речовина” не можна ототожнювати з поняттям “хімічний елемент”. Проста речовина характеризується визначеною щільністю, розчинністю, температурами плавлення і кипіння і т.п. Ці властивості відносяться до сукупності атомів і для різних простих речовин вони різні. Хімічний елемент характеризується визначеним позитивним зарядом ядра атома (порядковим номером), ступенем окислювання, ізотопною сполукою і т.д. Властивості елементів відносяться до його окремих атомів.
Складні речовини, чи хімічні сполуки, — це речовини, утворені атомами різних елементів.
Так, оксид міді (II) утворений атомами елементів міді і кисню, вода — атомами елементів водню і кисню.
Малюнок 3. Кристалічна решітка оксиду міді
На цьому відео продемонстровано як оксид міді легко відновлюється воднем до міді
http://www.youtube.com/watch?v=PlOH0ldh83s
Складні речовини складаються не з простих речовин, а з елементів. Наприклад, вода складається не з простих речовин водню і кисню, а з елементів водню і кисню. Назви елементів звичайно збігаються з назвами відповідних їм простих речовин (виключення: вуглець і одне з простих речовин кисню — озон).
Які ж бувають речовини?
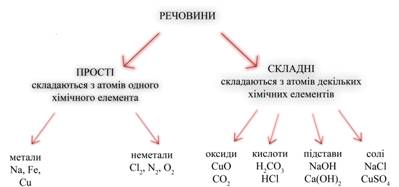
Відповіддю на це питання може служити схема, в основі якої лежить класифікація речовин за кількісним та якісним складом.
Використовуючи схему, можна коротко охарактеризувати речовини прості і складні, склад речовин різних класів, навести приклади.
Малюнок 4. Схема розподілу речовин
Звернемо увагу на схему на якому зображена таблиця розподілу речовин: складні речовини у свою чергу також поділяються –
Оксиди - це складні речовини, що складаються з двох елементів, один з яких кисень.
Кислоти - це електроліти, при дисоціації яких з позитивних іонів утворюються тільки іони водню (Н +).
Підстави - це електроліти, при дисоціації яких з негативних іонів утворюються тільки гідроксид-іони (ОН-).
Солі - це електроліти, при дисоціації яких утворюються катіони металів і аніони кислотного залишку.
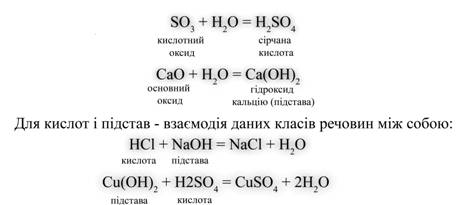
Далі слід привести рівняння реакцій, що характеризують основні властивості кожного класу сполук.
Для оксидів такою властивістю є взаємодія з водою:
Файл:Him7 8 6.difФайл:Him7 8 6.gif
Малюнок 5. Приклади взаємодії оксидів з водою.
Контролюючий блок №2
1. На які речовини розподіляються хімічні речовин?
2. Розкрийте поняття складних та простих речовин.
3. Як далі розподіляються прості речовини? Приведіть приклади
4. Як далі розподіляються складні речовини? Приведіть приклади
5. Розкажіть, що таке оксиди, кислоти, підстави та солі.
Частина 3
Метали й неметали
Майже всі метали - тверді блискучі речовини, вони добре проводять електричний струм, ковкі і пластичні, за допомогою лиття з них можна отримувати вироби практично будь-якої форми.
Розрізняють фізичні і хімічні властивості металів. У загальному випадку, властивості металів досить різноманітні. Розрізняють метали лужні, лужноземельні, чорні, кольорові, лантаноїди (або рідкоземельні метали - близькі за хімічними властивостями до лужноземельних), актиноїди (більшість з них - радіоактивні елементи), шляхетні й платинові метали.
Крім того, окремі метали проявляють як металеві, так і неметалеві властивості. Такі метали - амфотерні (або як кажуть - перехідні).
Малюнок 7. Таблиця «Лужні метали»
У властивостях металів багато спільного: металевий блиск, будова кристалічної решітки, здатність у хімічних реакціях проявляти властивості відновника, при цьому окислюючись. У хімічних реакціях іони розчинених металів при взаємодії з кислотами солі, при взаємодії з водою (залежно від активності металу) утворюють луг або підстави.
Це відео, приклад взаємодії лужних металів з водою.
http://www.youtube.com/watch?v=O0qKywNFQ3Y
Більшість неметалів - Гази; тверді ж неметали, як правило, тендітні, іноді прозорі і не проводять електрики.
Неметали - прості хімічні речовини, які з металами мають схожість і відмінність. Відмінності у властивостях металів і неметалів стають зрозумілими, якщо знати будову їх атомів, їх електронну конфігурацію. Зовнішня електронна оболонка атомів металів заповнена менше ніж наполовину, тому, вступаючи в хімічні реакції, всі метали прагнуть позбутися від зовнішніх електронів, набуваючи стабільну електронну конфігурацію Таким чином, вони схильні утворювати позитивні іони. Саме ці зовнішні (рухливі) електрони відповідають за електропровідність металів, а також за їх механічні властивості. Навпаки, зовнішня електронна оболонка атомів неметалів практично не заповнена.
Малюнок 8. Таблиця «Неметали. Галогени»
До неметалів, зокрема, відносяться інертні гази, у яких на зовнішній електронній оболонці максимальне число електронів: у гелію два, у решти вісім. У хімічних реакціях неметали або приєднують електрони, перетворюючись в негативні іони, або утворюють ковалентний зв'язок.
26x24px   
Малюнок 9. Приклади неметалів.
Контролюючий блок №3
1. Розкажіть, що значить поняття «метали». Приведіть приклади.
2. Які метали розрізняють?
3. Що спільного у властивостях металів?
4. Розкрийте поняття «неметали». Що саме складає їх більшу частку?
5. Що потрібно знати, щоб розрізняти відмінності у властивостях металів і неметалів?
6. Приведіть приклади неметалів.
7. Придивіться до періодичної системи хімічних елементів. Запом`ятайте
розтушування металів.
Список джерел:
1. Енциклопедія юного хіміка. – М., 1998.
2. Основи теоретичної хімії. Посібник. – М., 2000.
3. Астахов О.I. "Цiкавi роботи з хiмii" Киев:Радяньска школа 2001
4. Агрономів А. Є. "Вибрані глави органічної хімії" М.: Хімія, 2000
5. Аналітична хімія: Хімічні методи аналізу "М.: Хімія, 2003
6. Андруз Дж., Брімблекумб П., Джікелз Т., Лісс П. "Введення в хімію навколишнього середовища "М.: Мир 1999
7. Ахметов Н.С. "Загальна та неорганічна хімія" М.: Вища школа, 2001
Урок на тему: " Метали й неметали" Підготувала вчитель хімії Літвін Людмила Василівна . м. Маріуполь.
Відредаговано та надіслано Горбатко С. М.
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
Предмети > Хімія > Хімія 7 клас
|



















