|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Фізика і астрономія|Фізика і астрономія]]>>[[Фізика 9 клас|Фізика 9 клас]]>> Фізика: Електричний струм в розчинах і розплавах електролітів. Кількість речовини, що виділяється під час електролізу. Застосування електролізу у промисловості та техніці'''<metakeywords>Фізика, клас, урок, на Тему, Електричний струм, в розчинах, розплавах електролітів, Кількість речовини, що виділяється, під час електролізу, Застосування електролізу, у промисловості, та техніці</metakeywords> <br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Фізика і астрономія|Фізика і астрономія]]>>[[Фізика 9 клас|Фізика 9 клас]]>> Електричний струм в розчинах і розплавах електролітів. Кількість речовини, що виділяється під час електролізу. '''<metakeywords>Фізика, клас, урок, на Тему, Електричний струм, в розчинах, розплавах електролітів, Кількість речовини, що виділяється, під час електролізу, Застосування електролізу, у промисловості, та техніці</metakeywords> <br> |
| | | | |
| - | '''ЕЛЕКТРИЧНИЙ СТРУМ У РІДИНАХ'''<br><br>Дистильована вода — практично діелектрик, тому що в ній майже немає вільних заряджених частинок; діелектриком є й кухонна сіль. Однак якщо дрібку кухонної солі кинути в дистильовану воду, то отриманий розчин добре проводитиме струм. Чому це так? Звідки в розчині взялися вільні частинки, що мають електричний заряд?<br><br>'''Знайомимося з електролітами'''<br><br>Молекули багатьох речовин (наприклад, солей) являють собою позитивні і негативні йони, з'єднані в одне ціле силою електричного притягання. Так, макромолекула кухонної солі ^аСІ) складається з позитивних йонів Натрію (N3") і негативних йонів Хлору (СІ ) (рис. 19.1), | + | [[Презентація_до_теми_Електричний_струм_в_розчинах_і_розплавах_електролітів|'''ЕЛЕКТРИЧНИЙ СТРУМ У РІДИНАХ''']]<br><br>Дистильована вода — практично [[Електрична_провідність_матеріалів:_провідники,_напівпровідники_та_діелектрики._Струм_у_металах|діелектрик]], тому що в ній майже немає вільних заряджених частинок; діелектриком є й кухонна сіль. Однак якщо дрібку кухонної солі кинути в дистильовану воду, то отриманий розчин добре проводитиме [[Амперметр._Вимірювання_сили_струму|струм]]. Чому це так? Звідки в розчині взялися вільні частинки, що мають електричний заряд?<br><br>'''Знайомимося з [[Електроліти_та_неелектроліти|електролітами]]'''<br><br>Молекули багатьох речовин (наприклад, солей) являють собою позитивні і негативні йони, з'єднані в одне ціле силою електричного притягання. Так, макромолекула кухонної солі ^аСІ) складається з позитивних йонів Натрію (N3") і негативних йонів Хлору (СІ ) (рис. 19.1), макромолекула купрум сульфату (Си804) — з позитивних йонів Купруму (Си2+) і негативних йонів сульфату (80 2 ). |
| | | | |
| - | [[Image:F9191.jpg]] | + | [[Image:F9191.jpg|Макромолекула кухонної солі. фото]] |
| | | | |
| - | макромолекула купрум сульфату (Си804) — з позитивних йонів Купруму (Си2+) і негативних йонів сульфату (80 2 ). Якщо ці речовини розчинити, наприклад, у воді, то притягання між йонами стане набагато слабшим і молекули речовин можуть розпастися на окремі йони. З курсу хімії ви вже знаєте, що розпад деяких речовин на йони під дією полярних молекул розчинника називають електролітичною дисоціацією (від латин, бІіззосіаііо — роз'єднання, розділення).<br>Рис. 19.2.
| + | ''Рис. 19.1. Макромолекула кухонної солі.''<br> |
| | | | |
| - | [[Image:F9192.jpg]] | + | Якщо ці речовини розчинити, наприклад, у воді, то притягання між йонами стане набагато слабшим і молекули речовин можуть розпастися на окремі йони. З курсу [[Хімія|хімії ]]ви вже знаєте, що розпад деяких речовин на йони під дією полярних молекул розчинника називають електролітичною дисоціацією (від латин, бІіззосіаііо — роз'єднання, розділення).<br> |
| | | | |
| - | Схема дослідження електричного струму в рідинах: 1 — анод; 2 — катод; З — ванна з розчином електроліту. Після замикання кола позитивні йони (катіони) рухаються до катода, негативні йони (аніони) — до анода.<br>У результаті електролітичної дисоціації в розчині з'являються вільні заряджені частинки — позитивні і негативні йони й розчин починає проводити струм.<br>Досліди показують, що розпадання молекул на йони може бути спричинене не тільки розчинником. За умови значного збільшення температури деякі солі та оксиди металів можуть розпадатися на окремі йони й без «допомоги» розчинника. Тому розплави цих речовин теж проводять електричний струм.<br>Речовини, розчини й розплави яких проводять електричний струм, називають електролітами.<br>З'ясовуємо, як проходить електричний струм через — електроліти<br>Візьмемо два вугільні стрижні (електроди) та з'єднаємо їх із полюсами джерела струму (див. рис. 19.2). Нагадаємо, що електрод, з'єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з'єднаний із негативним полюсом,— катодом. Опустимо електроди в посудину з розчином електроліту, наприклад, із водним розчином купрум хлориду (СиС12), і замкнемо коло. У розчині купрум хлориду виникне електричне поле, під дією якого вільні позитивні йони Купруму (Си24) попрямують до катода, а вільні негативні йони Хлору (СІ ) — до анода. Отже, у розчині виникне напрямлений рух вільних заряджених частинок — електричний струм.<br>Електричний струм у розчинах і розплавах електролітів являє собою напрямлений рух вільних йонів.<br>Електроліти цс тверді <ібо рідкі речовини, що мають йонну про відність.<br>Під час проходження струму через електроліти позитивні йони рухаються до негативного електрода — катода, тому їх називають катіонами; негативні йони рухаються до позитивного електрода — анода, і їх відповідно називають аніонами.<br><br>Даємо визначення електролізу<br>Проходження електричного струму через електроліт (на відміну від проходження струму через метал) характеризується тим, що йони переносять хімічні складові електроліту і ті виділяються на електродах — відкладаються у вигляді твердого шару або виділяються в газоподібному стані.<br>Наприклад, якщо через водний розчин купрум хлориду протягом кількох хвилин пропускати струм, то побачимо, що поверхню катода вкриє тонкий шар міді (рис. 19.3) | + | [[Image:F9192.jpg|Схема дослідження електричного струму в рідинах: 1 — анод; 2 — катод; З — ванна з розчином електроліту. фото]] |
| | | | |
| - | [[Image:F9193.jpg]]
| + | ''Рис. 19.2. Схема дослідження електричного струму в рідинах: 1 — анод; 2 — катод; З — ванна з розчином електроліту. ''<br> |
| | | | |
| - | , а біля анода виділиться газоподібний хлор. Наявність хлору можна визначити за характерним запахом або, якщо попередньо обгорнути анод кольоровою тканиною,— за її знебарвленням.<br>Це відбувається тому, що під час проходження струму через розчин купрум хлориду вільні позитивні йони Купруму (Си2+) прямують до катода, а вільні негативні йони Хлору (СГ) — до анода. Досягши катода, катіон Купруму «бере» з його поверхні електрони, яких йому бракує, тобто відбувається хімічна реакція відновлення. Унаслідок цієї реакції катіон Купруму перетворюється на нейтральний атом; на поверхні катода осідає мідь. Водночас аніони Хлору, досягши поверхні анода, навпаки, «віддають» йому надлишкові електрони — відбувається хімічна реакція окиснення; на аноді виділяється хлор.<br>Процес виділяння речовин на електродах, пов'язаний з окисно-відновними реакціями, що відбуваються на електродах під час проходження струми, називають електролізом.<br><br>Відкриваємо закон Фарадея<br>Уперше явище електролізу докладно вивчив англійський фізик М. Фарадей (рис. 19.4). | + | Після замикання кола позитивні [[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|йони ]](катіони) рухаються до катода, негативні йони (аніони) — до анода.<br>У результаті електролітичної дисоціації в розчині з'являються вільні заряджені частинки — позитивні і негативні йони й розчин починає проводити струм.<br>Досліди показують, що розпадання молекул на йони може бути спричинене не тільки розчинником. За умови значного збільшення температури деякі солі та оксиди металів можуть розпадатися на окремі йони й без «допомоги» розчинника. Тому розплави цих речовин теж проводять електричний струм.<br>Речовини, розчини й розплави яких проводять електричний струм, називають [[Електроліти_та_неелектроліти|електролітами]].<br>'''З'ясовуємо, як проходить електричний струм через — електроліти'''<br>Візьмемо два вугільні стрижні (електроди) та з'єднаємо їх із полюсами джерела струму (див. рис. 19.2). Нагадаємо, що електрод, з'єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з'єднаний із негативним полюсом,— катодом. Опустимо електроди в посудину з розчином електроліту, наприклад, із водним розчином купрум хлориду (СиС12), і замкнемо коло. У розчині купрум хлориду виникне електричне поле, під дією якого вільні позитивні йони Купруму (Си24) попрямують до катода, а вільні негативні йони Хлору (СІ ) — до анода. Отже, у розчині виникне напрямлений рух вільних заряджених частинок — електричний струм.<br>Електричний струм у розчинах і розплавах електролітів являє собою напрямлений рух вільних йонів.<br>Електроліти - це тверді або рідкі речовини, що мають йонну провідність.<br>Під час проходження струму через електроліти позитивні йони рухаються до негативного електрода — катода, тому їх називають катіонами; негативні йони рухаються до позитивного електрода — анода, і їх відповідно називають аніонами.<br><br>'''Даємо визначення електролізу'''<br>Проходження електричного струму через електроліт (на відміну від проходження струму через метал) характеризується тим, що йони переносять хімічні складові електроліту і ті виділяються на електродах — відкладаються у вигляді твердого шару або виділяються в газоподібному стані.<br>Наприклад, якщо через водний розчин купрум хлориду протягом кількох хвилин пропускати струм, то побачимо, що поверхню катода вкриє тонкий шар міді (рис. 19.3), а біля анода виділиться газоподібний хлор. Наявність хлору можна визначити за характерним запахом або, якщо попередньо обгорнути анод кольоровою тканиною,— за її знебарвленням. |
| | | | |
| - | [[Image:F9194.jpg]] | + | [[Image:F9193.jpg|Тонкий шар міді на поверхні катода. фото]] |
| | | | |
| - | Точно вимірюючи масу речовин, які виділялись на електродах під час проходження електричного струму через розчин електроліту, він сформулював закон, який згодом був названий законом електролізу, або першим законом Фарадея.<br><br>'''ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ'''<br>Існує легенда, що наприкінці XVIII ст. король Англії надіслав у подарунок російській імператриці Єкатерині II... алюмінієвий кухоль. Уявіть, що вона була вражена таким коштовним подарунком! Річ у тім, що в ті часи алюміній був дуже рідкісним і коштував у кілька разів дорожче від золота. Згодом завдяки застосуванню електролізу алюміній став загальнодоступним і досить недорогим. Про те, як за допомогою електролізу одержують метали і де ще застосовують електроліз, ітиметься в цьому параграфі.<br><br>Застосовуємо електроліз для одержування металів Електроліз широко застосовують у промисловості. За допомогою електролізу із солей і оксидів одержують багато металів: мідь, нікель, алюміній та ін. Наприклад, щоб одержати алюміній, як електроліт використовують алюміній оксид (А1203), розчинений у розплавленому кріоліті (МаяА1Г6) за температури 950 °С. Розчин поміщають у спеціальні електролітичні ванни; катодом зазвичай слугують дно та стінки ванни, викладені графітом, а анодом — занурені в електроліт вугільні блоки (рис. 20.1).
| + | ''Рис. 19.3. Тонкий шар міді на поверхні катода.''<br> |
| | | | |
| - | [[Image:F9201.jpg]] | + | <br>Це відбувається тому, що під час проходження струму через [[Електролітична_дисоціація_кислот,_основ,_солей_у_водних_розчинах|розчин ]]купрум хлориду вільні позитивні йони Купруму (Си2+) прямують до катода, а вільні негативні йони Хлору (СГ) — до анода. Досягши катода, катіон Купруму «бере» з його поверхні електрони, яких йому бракує, тобто відбувається хімічна реакція відновлення. Унаслідок цієї реакції катіон Купруму перетворюється на нейтральний атом; на поверхні катода осідає мідь. Водночас аніони Хлору, досягши поверхні анода, навпаки, «віддають» йому надлишкові електрони — відбувається хімічна реакція окиснення; на аноді виділяється хлор.<br>Процес виділяння речовин на електродах, пов'язаний з окисно-відновними реакціями, що відбуваються на електродах під час проходження струми, називають електролізом.<br><br>'''Відкриваємо закон Фарадея'''<br>Уперше явище електролізу докладно вивчив англійський [[Фізика_і_астрономія|фізик ]]М. Фарадей (рис. 19.4). |
| | | | |
| - | У процесі пропускання струму через електроліт на катоді виділяється алюміній. Аналогічно одержують деякі інші метали.<br><br><br><br>Фізика 9 клас. Ф.Я.Божинова, М.М.Кірюхін О.О.Кірюхіна | + | [[Image:F9194.jpg|Фізик М. Фарадей. фото]] |
| | + | |
| | + | ''Рис. 19.4. Фізик М. Фарадей.''<br> |
| | + | |
| | + | Точно [[Фізичне_тіло_і_речовина._Маса_тіла._Одиниці_маси._Вимірювання_маси_тіл._Повні_уроки|вимірюючи масу речовин]], які виділялись на електродах під час проходження електричного струму через розчин електроліту, він сформулював закон, який згодом був названий законом електролізу, або першим законом Фарадея.<br><br>'''ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ'''<br>Існує легенда, що наприкінці XVIII ст. король Англії надіслав у подарунок російській імператриці Єкатерині II... алюмінієвий кухоль. Уявіть, що вона була вражена таким коштовним подарунком! Річ у тім, що в ті часи алюміній був дуже рідкісним і коштував у кілька разів дорожче від золота. Згодом завдяки застосуванню електролізу алюміній став загальнодоступним і досить недорогим. Про те, як за допомогою електролізу одержують метали і де ще застосовують електроліз, ітиметься в цьому параграфі.<br><br>Застосовуємо електроліз для одержування металів Електроліз широко застосовують у промисловості. За допомогою електролізу із солей і оксидів одержують багато металів: мідь, нікель, алюміній та ін. Наприклад, щоб одержати алюміній, як електроліт використовують алюміній оксид (А1203), розчинений у розплавленому кріоліті (МаяА1Г6) за температури 950 °С. Розчин поміщають у спеціальні електролітичні ванни; катодом зазвичай слугують дно та стінки ванни, викладені графітом, а анодом — занурені в електроліт вугільні блоки (рис. 20.1). |
| | + | |
| | + | [[Image:F9201.jpg|Розчин у спеціальній електричній ванні. фото]] |
| | + | |
| | + | ''Рис. 20.1. Розчин у спеціальній електричній ванні.'' |
| | + | |
| | + | У процесі пропускання струму через електроліт на катоді виділяється алюміній. Аналогічно одержують деякі інші метали.<br><br><br><br>''[[Фізика_9_клас|Фізика 9 клас.]] Ф.Я.Божинова, М.М.Кірюхін О.О.Кірюхіна'' |
| | | | |
| | <br> | | <br> |
Текущая версия на 16:24, 8 июля 2012
Гіпермаркет Знань>>Фізика і астрономія>>Фізика 9 клас>> Електричний струм в розчинах і розплавах електролітів. Кількість речовини, що виділяється під час електролізу.
ЕЛЕКТРИЧНИЙ СТРУМ У РІДИНАХ
Дистильована вода — практично діелектрик, тому що в ній майже немає вільних заряджених частинок; діелектриком є й кухонна сіль. Однак якщо дрібку кухонної солі кинути в дистильовану воду, то отриманий розчин добре проводитиме струм. Чому це так? Звідки в розчині взялися вільні частинки, що мають електричний заряд?
Знайомимося з електролітами
Молекули багатьох речовин (наприклад, солей) являють собою позитивні і негативні йони, з'єднані в одне ціле силою електричного притягання. Так, макромолекула кухонної солі ^аСІ) складається з позитивних йонів Натрію (N3") і негативних йонів Хлору (СІ ) (рис. 19.1), макромолекула купрум сульфату (Си804) — з позитивних йонів Купруму (Си2+) і негативних йонів сульфату (80 2 ).
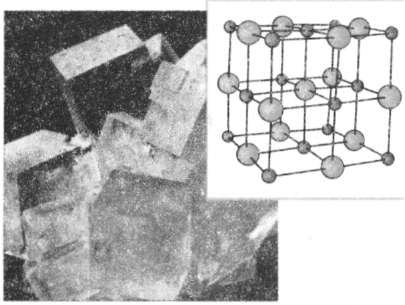
Рис. 19.1. Макромолекула кухонної солі.
Якщо ці речовини розчинити, наприклад, у воді, то притягання між йонами стане набагато слабшим і молекули речовин можуть розпастися на окремі йони. З курсу хімії ви вже знаєте, що розпад деяких речовин на йони під дією полярних молекул розчинника називають електролітичною дисоціацією (від латин, бІіззосіаііо — роз'єднання, розділення).
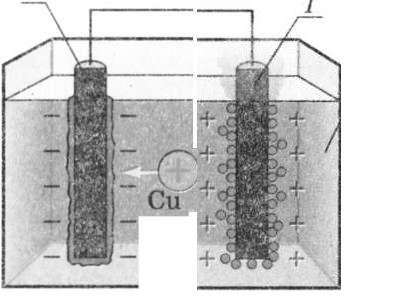
Рис. 19.2. Схема дослідження електричного струму в рідинах: 1 — анод; 2 — катод; З — ванна з розчином електроліту.
Після замикання кола позитивні йони (катіони) рухаються до катода, негативні йони (аніони) — до анода.
У результаті електролітичної дисоціації в розчині з'являються вільні заряджені частинки — позитивні і негативні йони й розчин починає проводити струм.
Досліди показують, що розпадання молекул на йони може бути спричинене не тільки розчинником. За умови значного збільшення температури деякі солі та оксиди металів можуть розпадатися на окремі йони й без «допомоги» розчинника. Тому розплави цих речовин теж проводять електричний струм.
Речовини, розчини й розплави яких проводять електричний струм, називають електролітами.
З'ясовуємо, як проходить електричний струм через — електроліти
Візьмемо два вугільні стрижні (електроди) та з'єднаємо їх із полюсами джерела струму (див. рис. 19.2). Нагадаємо, що електрод, з'єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з'єднаний із негативним полюсом,— катодом. Опустимо електроди в посудину з розчином електроліту, наприклад, із водним розчином купрум хлориду (СиС12), і замкнемо коло. У розчині купрум хлориду виникне електричне поле, під дією якого вільні позитивні йони Купруму (Си24) попрямують до катода, а вільні негативні йони Хлору (СІ ) — до анода. Отже, у розчині виникне напрямлений рух вільних заряджених частинок — електричний струм.
Електричний струм у розчинах і розплавах електролітів являє собою напрямлений рух вільних йонів.
Електроліти - це тверді або рідкі речовини, що мають йонну провідність.
Під час проходження струму через електроліти позитивні йони рухаються до негативного електрода — катода, тому їх називають катіонами; негативні йони рухаються до позитивного електрода — анода, і їх відповідно називають аніонами.
Даємо визначення електролізу
Проходження електричного струму через електроліт (на відміну від проходження струму через метал) характеризується тим, що йони переносять хімічні складові електроліту і ті виділяються на електродах — відкладаються у вигляді твердого шару або виділяються в газоподібному стані.
Наприклад, якщо через водний розчин купрум хлориду протягом кількох хвилин пропускати струм, то побачимо, що поверхню катода вкриє тонкий шар міді (рис. 19.3), а біля анода виділиться газоподібний хлор. Наявність хлору можна визначити за характерним запахом або, якщо попередньо обгорнути анод кольоровою тканиною,— за її знебарвленням.

Рис. 19.3. Тонкий шар міді на поверхні катода.
Це відбувається тому, що під час проходження струму через розчин купрум хлориду вільні позитивні йони Купруму (Си2+) прямують до катода, а вільні негативні йони Хлору (СГ) — до анода. Досягши катода, катіон Купруму «бере» з його поверхні електрони, яких йому бракує, тобто відбувається хімічна реакція відновлення. Унаслідок цієї реакції катіон Купруму перетворюється на нейтральний атом; на поверхні катода осідає мідь. Водночас аніони Хлору, досягши поверхні анода, навпаки, «віддають» йому надлишкові електрони — відбувається хімічна реакція окиснення; на аноді виділяється хлор.
Процес виділяння речовин на електродах, пов'язаний з окисно-відновними реакціями, що відбуваються на електродах під час проходження струми, називають електролізом.
Відкриваємо закон Фарадея
Уперше явище електролізу докладно вивчив англійський фізик М. Фарадей (рис. 19.4).

Рис. 19.4. Фізик М. Фарадей.
Точно вимірюючи масу речовин, які виділялись на електродах під час проходження електричного струму через розчин електроліту, він сформулював закон, який згодом був названий законом електролізу, або першим законом Фарадея.
ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ
Існує легенда, що наприкінці XVIII ст. король Англії надіслав у подарунок російській імператриці Єкатерині II... алюмінієвий кухоль. Уявіть, що вона була вражена таким коштовним подарунком! Річ у тім, що в ті часи алюміній був дуже рідкісним і коштував у кілька разів дорожче від золота. Згодом завдяки застосуванню електролізу алюміній став загальнодоступним і досить недорогим. Про те, як за допомогою електролізу одержують метали і де ще застосовують електроліз, ітиметься в цьому параграфі.
Застосовуємо електроліз для одержування металів Електроліз широко застосовують у промисловості. За допомогою електролізу із солей і оксидів одержують багато металів: мідь, нікель, алюміній та ін. Наприклад, щоб одержати алюміній, як електроліт використовують алюміній оксид (А1203), розчинений у розплавленому кріоліті (МаяА1Г6) за температури 950 °С. Розчин поміщають у спеціальні електролітичні ванни; катодом зазвичай слугують дно та стінки ванни, викладені графітом, а анодом — занурені в електроліт вугільні блоки (рис. 20.1).
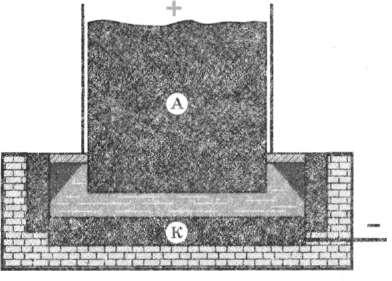
Рис. 20.1. Розчин у спеціальній електричній ванні.
У процесі пропускання струму через електроліт на катоді виділяється алюміній. Аналогічно одержують деякі інші метали.
Фізика 9 клас. Ф.Я.Божинова, М.М.Кірюхін О.О.Кірюхіна
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|















