|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Фізичні та хімічні властивості кислот: дія на індикатори, взаємодія з металами. Класифiкація кислот. Поняття про ряд активності металів. Заходи безпеки під час роботи з кислотами''' <metakeywords>Хімія, клас, урок, на Тему, Фізичні та хімічні, властивості кислот, дія на індикатори, взаємодія з металами, Класифiкація кислот, Поняття про ряд, ряд активності металів, Заходи безпеки, під час роботи, роботи з кислотами</metakeywords> <br> | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Фізичні та хімічні властивості кислот: дія на індикатори, взаємодія з металами. Класифiкація кислот. Поняття про ряд активності металів. Заходи безпеки під час роботи з кислотами''' <metakeywords>Хімія, клас, урок, на Тему, Фізичні та хімічні, властивості кислот, дія на індикатори, взаємодія з металами, Класифiкація кислот, Поняття про ряд, ряд активності металів, Заходи безпеки, під час роботи, роботи з кислотами</metakeywords> <br> |
| | | | |
| | + | <br> |
| | | | |
| | + | '''Класифікація кислот.''' Кислоти поділяють:<br>а) ''за основністю'' на одно-, двох-, три-і багатоосновні (табл. 4). |
| | | | |
| - | Тобі відомо, що хімічні властивості речовин виявляються тільки в процесі перетворення одних речовин на інші. Тому почнемо з дослідів, які продемонструють найхарактерніші властивості кислот.<br><br>'''1. Кислоти діють на індикатори (речовини-визначники).'''<br>Дослід 1. У три пробірки з розчином сульфатної кислоти H<sub>2</sub>S0<sub>4</sub> додамо по кілька крапель індикаторів: у першу — лакмусу, розчин стає червоним; у другу — метилового оранжевого, розчин стає рожево-червоним; у третю — фенолфталеїну, розчин залишається безбарвним.<br>Речовини, які змінюють своє забарвлення під дією кислот (або лугів), називаються індикаторами.<br>Лакмус, метиловий оранжевий (метилоранж), фенолфталеїн — індикатори на кислоти і луги (див. таблицю на форзаці).<br><br>'''2. Кислоти взаємодіють з металами'''<br>Дослід 2. У три пробірки наливаємо розбавленої сульфатної кислоти. У першу вміщуємо кусочок магнію Mg, у другу — цинку Zn, у третю — міді Си. Що<br>відбувається? Можна помітити, що магній енергійно реагує з кислотою, витісняючи водень, цинк — дещо повільніше, а мідь — не реагує.<br>Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + H<sub>2</sub> î<br>Zn + H<sub>2</sub>S0<sub>4</sub> = ZnS0<sub>4</sub> + Н<sub>2</sub> î<br>Cu + H<sub>2</sub>S0<sub>4</sub> = (реакція не відбувається)<br><br>Краплю розчину з першої і другої пробірки наносимо на скляну пластинку й нагріваємо в полум'ї спиртівки. Вода випаровується, а на пластинці залишаються білі плями, утворені дрібними кристаликами речовини, — це солі: магній сульфат MgS0<sub>4</sub> і цинк сульфат ZnS0<sub>4</sub>. Відбулися реакції, у процесі яких атоми Магнію і Цинку замістили атоми Гідрогену в сульфатній кислоті, внаслідок чого утворилися солі MgS0<sub>4</sub> і ZnS0<sub>4</sub> та виділився водень Н<sub>2</sub>. Такі реакції належать до реакцій заміщення.<br>
| + | Таблиця 4. Класифікація кислот за основністю<br>[[Image:Таблиця 4. Класифікація кислот за основністю.jpg]]<br> <br>б) ''за складом'' на оксигеновмісні й без-оксигенові (табл. 5). |
| | | | |
| - | <br>'''Реакції заміщення''' — це хімічні реакції, що відбуваються між простими і складними речовинами, в процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.<br><br>Виявляється, всі метали за активністю заміщення Гідрогену в кислоті (витіснення водню з кислоти) можна розмістити в ряд:<br>Li, К, Ва, Са, Na, Mg, Al, Mn, Zn, Fe,<br>Ni, Sn, Pb, (H<sub>2</sub>), Cu, Hg, Ag, Pt, Au.<br><br>Утворився так званий '''''ряд активності металів''''' (витискувальний ряд). Уперше його склав на основі експериментальних даних видатний російський та український учений М. М. Бекетов. Метали в цьому ряду розміщені в порядку зменшення їх активності. Метали, що стоять ліворуч від водню, здатні витісняти його з кислоти (крім нітратної), а ті, що стоять праворуч від водню, — ні<sup>1</sup>.
| + | Таблиця 5. Класифікація кислот за складом кислоти <br> |
| | | | |
| - | <sup>1 </sup>Під час взаємодії нітратної кислоти з металами виділяються інші гази. | + | [[Image:Таблиця 5. Класифікація кислот за складом кислоти.jpg]]<br> |
| | | | |
| | <br> | | <br> |
| - | [[Image:Микола Миколайович Бекетов.jpg]]<br>
| |
| - | Микола Миколайович Бекетов (1827—1911)
| |
| - | <br>
| |
| - | Російський і український фізико-хімік, академік Петербурзької Академії наук (з 1886), професор Харківського університету (з 1859), де вперше як самостійну наукову дисципліну читав курс фізичної хімії. Відкрив спосіб відновлення металів з їх оксидів алюмінієм, заклав основи алюмінотер-мії. Склав (1863) ряд активності металів, який було названо його іменем. Один із засновників фізичної хімії
| |
| | | | |
| | + | <br> |
| | | | |
| | + | [[Image:Звичайний оцет — це розчин оцтової кислоти.jpg]]<br> |
| | + | |
| | + | Звичайний оцет — це розчин оцтової кислоти |
| | + | |
| | + | '''<br>Фізичні властивості кислот.''' За стандартних умов багато кислот — рідини (H<sub>2</sub>S0<sub>4</sub>, HN0<sub>3</sub>), але є й тверді кислоти — ортофосфатна Н<sub>3</sub>Р0<sub>4</sub>, метафосфатна НРОз, силікатна (драглиста маса) H<sub>2</sub>Si0<sub>3</sub>. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN0<sub>3</sub>), вони мають задушливий запах. Майже всі кислоти безбарвні.<br>Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту. |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | '''Хімічні властивості кислот.'''<span style="font-weight: bold;"> </span>Тобі відомо, що хімічні властивості речовин виявляються тільки в процесі перетворення одних речовин на інші. Тому почнемо з дослідів, які продемонструють найхарактерніші властивості кислот. |
| | + | |
| | + | '''► Кислоти діють на індикатори (речовини-визначники).'''<br>Дослід 1. У три пробірки з розчином сульфатної кислоти H<sub>2</sub>S0<sub>4</sub> додамо по кілька крапель індикаторів: у першу — лакмусу, розчин стає червоним; у другу — метилового оранжевого, розчин стає рожево-червоним; у третю — фенолфталеїну, розчин залишається безбарвним.<br>Речовини, які змінюють своє забарвлення під дією кислот (або лугів), називаються індикаторами.<br>Лакмус, метиловий оранжевий (метилоранж), фенолфталеїн — індикатори на кислоти і луги (див. таблицю на форзаці).<br><br>'''► Кислоти взаємодіють з металами'''<br>Дослід 2. У три пробірки наливаємо розбавленої сульфатної кислоти. У першу вміщуємо кусочок магнію Mg, у другу — цинку Zn, у третю — міді Си. Що<br>відбувається? Можна помітити, що магній енергійно реагує з кислотою, витісняючи водень, цинк — дещо повільніше, а мідь — не реагує.<br>Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + H<sub>2</sub> î<br>Zn + H<sub>2</sub>S0<sub>4</sub> = ZnS0<sub>4</sub> + Н<sub>2</sub> î<br>Cu + H<sub>2</sub>S0<sub>4</sub> = (реакція не відбувається)<br><br>Краплю розчину з першої і другої пробірки наносимо на скляну пластинку й нагріваємо в полум'ї спиртівки. Вода випаровується, а на пластинці залишаються білі плями, утворені дрібними кристаликами речовини, — це солі: магній сульфат MgS0<sub>4</sub> і цинк сульфат ZnS0<sub>4</sub>. Відбулися реакції, у процесі яких атоми Магнію і Цинку замістили атоми Гідрогену в сульфатній кислоті, внаслідок чого утворилися солі MgS0<sub>4</sub> і ZnS0<sub>4</sub> та виділився водень Н<sub>2</sub>. Такі реакції належать до реакцій заміщення.<br> |
| | + | |
| | + | <br>'''Реакції заміщення''' — це хімічні реакції, що відбуваються між простими і складними речовинами, в процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.<br><br>Виявляється, всі метали за активністю заміщення Гідрогену в кислоті (витіснення водню з кислоти) можна розмістити в ряд:<br>Li, К, Ва, Са, Na, Mg, Al, Mn, Zn, Fe,<br>Ni, Sn, Pb, (H<sub>2</sub>), Cu, Hg, Ag, Pt, Au.<br><br>Утворився так званий '''''ряд активності металів''''' (витискувальний ряд). Уперше його склав на основі експериментальних даних видатний російський та український учений М. М. Бекетов. Метали в цьому ряду розміщені в порядку зменшення їх активності. Метали, що стоять ліворуч від водню, здатні витісняти його з кислоти (крім нітратної), а ті, що стоять праворуч від водню, — ні<sup>1</sup>. |
| | + | |
| | + | <sup>1 </sup>Під час взаємодії нітратної кислоти з металами виділяються інші гази. |
| | + | |
| | + | <br> [[Image:Микола Миколайович Бекетов.jpg]]<br> Микола Миколайович Бекетов (1827—1911) <br> Російський і український фізико-хімік, академік Петербурзької Академії наук (з 1886), професор Харківського університету (з 1859), де вперше як самостійну наукову дисципліну читав курс фізичної хімії. Відкрив спосіб відновлення металів з їх оксидів алюмінієм, заклав основи алюмінотер-мії. Склав (1863) ряд активності металів, який було названо його іменем. Один із засновників фізичної хімії |
| | + | |
| | + | <br> |
| | | | |
| | ---- | | ---- |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту | + | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту |
| | | | |
| - | <br> <sub>Хімія [[Хімія|онлайн]], конспекти з хімії за [[Хімія_8_клас|8 клас]], допомога школяру</sub> <br> | + | <br> <sub>Хімія [[Хімія|онлайн]], конспекти з хімії за [[Хімія 8 клас|8 клас]], допомога школяру</sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
Версия 07:07, 1 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Фізичні та хімічні властивості кислот: дія на індикатори, взаємодія з металами. Класифiкація кислот. Поняття про ряд активності металів. Заходи безпеки під час роботи з кислотами
Класифікація кислот. Кислоти поділяють:
а) за основністю на одно-, двох-, три-і багатоосновні (табл. 4).
Таблиця 4. Класифікація кислот за основністю

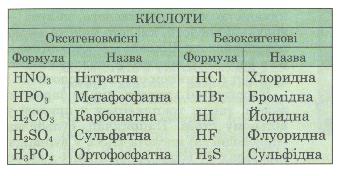
б) за складом на оксигеновмісні й без-оксигенові (табл. 5).
Таблиця 5. Класифікація кислот за складом кислоти

Звичайний оцет — це розчин оцтової кислоти
Фізичні властивості кислот. За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна Н3Р04, метафосфатна НРОз, силікатна (драглиста маса) H2Si03. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN03), вони мають задушливий запах. Майже всі кислоти безбарвні.
Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту.
Хімічні властивості кислот. Тобі відомо, що хімічні властивості речовин виявляються тільки в процесі перетворення одних речовин на інші. Тому почнемо з дослідів, які продемонструють найхарактерніші властивості кислот.
► Кислоти діють на індикатори (речовини-визначники).
Дослід 1. У три пробірки з розчином сульфатної кислоти H2S04 додамо по кілька крапель індикаторів: у першу — лакмусу, розчин стає червоним; у другу — метилового оранжевого, розчин стає рожево-червоним; у третю — фенолфталеїну, розчин залишається безбарвним.
Речовини, які змінюють своє забарвлення під дією кислот (або лугів), називаються індикаторами.
Лакмус, метиловий оранжевий (метилоранж), фенолфталеїн — індикатори на кислоти і луги (див. таблицю на форзаці).
► Кислоти взаємодіють з металами
Дослід 2. У три пробірки наливаємо розбавленої сульфатної кислоти. У першу вміщуємо кусочок магнію Mg, у другу — цинку Zn, у третю — міді Си. Що
відбувається? Можна помітити, що магній енергійно реагує з кислотою, витісняючи водень, цинк — дещо повільніше, а мідь — не реагує.
Mg + H2S04 = MgS04 + H2 î
Zn + H2S04 = ZnS04 + Н2 î
Cu + H2S04 = (реакція не відбувається)
Краплю розчину з першої і другої пробірки наносимо на скляну пластинку й нагріваємо в полум'ї спиртівки. Вода випаровується, а на пластинці залишаються білі плями, утворені дрібними кристаликами речовини, — це солі: магній сульфат MgS04 і цинк сульфат ZnS04. Відбулися реакції, у процесі яких атоми Магнію і Цинку замістили атоми Гідрогену в сульфатній кислоті, внаслідок чого утворилися солі MgS04 і ZnS04 та виділився водень Н2. Такі реакції належать до реакцій заміщення.
Реакції заміщення — це хімічні реакції, що відбуваються між простими і складними речовинами, в процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.
Виявляється, всі метали за активністю заміщення Гідрогену в кислоті (витіснення водню з кислоти) можна розмістити в ряд:
Li, К, Ва, Са, Na, Mg, Al, Mn, Zn, Fe,
Ni, Sn, Pb, (H2), Cu, Hg, Ag, Pt, Au.
Утворився так званий ряд активності металів (витискувальний ряд). Уперше його склав на основі експериментальних даних видатний російський та український учений М. М. Бекетов. Метали в цьому ряду розміщені в порядку зменшення їх активності. Метали, що стоять ліворуч від водню, здатні витісняти його з кислоти (крім нітратної), а ті, що стоять праворуч від водню, — ні1.
1 Під час взаємодії нітратної кислоти з металами виділяються інші гази.

Микола Миколайович Бекетов (1827—1911)
Російський і український фізико-хімік, академік Петербурзької Академії наук (з 1886), професор Харківського університету (з 1859), де вперше як самостійну наукову дисципліну читав курс фізичної хімії. Відкрив спосіб відновлення металів з їх оксидів алюмінієм, заклав основи алюмінотер-мії. Склав (1863) ряд активності металів, який було названо його іменем. Один із засновників фізичної хімії
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Хімія онлайн, конспекти з хімії за 8 клас, допомога школяру
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














