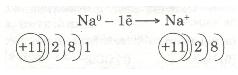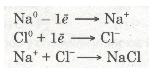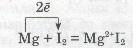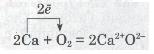|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Йонний зв’язок''' <metakeywords>Хімія, клас, урок, на Тему, Йонний зв’язок</metakeywords> <br> | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Йонний зв’язок''' <metakeywords>Хімія, клас, урок, на Тему, Йонний зв’язок</metakeywords> <br> |
| | | | |
| - | <u></u><br> | + | <u></u><br> |
| | | | |
| - | <u></u><br> | + | <u></u><br> |
| | | | |
| | <u>Тобі треба<br>розуміти суть понять:</u> йонний зв'язок; йон; <br><u>уміти:</u> пояснювати утворення йонного зв'язку в сполуках; характеризувати особливості йонного зв'язку.<br><br><br>Ти вже розумієш, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегатив-ністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:<br>2Na + Сl<sub>2</sub> = 2NaCl | | <u>Тобі треба<br>розуміти суть понять:</u> йонний зв'язок; йон; <br><u>уміти:</u> пояснювати утворення йонного зв'язку в сполуках; характеризувати особливості йонного зв'язку.<br><br><br>Ти вже розумієш, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегатив-ністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:<br>2Na + Сl<sub>2</sub> = 2NaCl |
| | | | |
| - | [[Файл:Na + Сl.jpg]] | + | [[Image:Na + Сl.jpg]] |
| | | | |
| - | Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:<br> | + | Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:<br> |
| | | | |
| - | [[Файл:атом Натрію.jpg]]<br> | + | [[Image:Атом Натрію.jpg]]<br> |
| | | | |
| - | <br>Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.<br>Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон:<br>Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:<br> | + | <br>Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.<br>Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон: |
| | | | |
| - | [[Файл:валентний електрон атома Натрію під час взаємодії з атомом Хлору.jpg]] | + | [[Файл:атом Хлору.jpg]] |
| | | | |
| - | <br>Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.<br>Різнойменно заряджені йони Натрію Na<sup>+</sup> і Хлору Сl<sup>-</sup>, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:<br> | + | <br>Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:<br> |
| | | | |
| - | [[Файл:натрій хлорид NaCl.jpg]]<br> | + | [[Image:Валентний електрон атома Натрію під час взаємодії з атомом Хлору.jpg]] |
| | | | |
| - | <br>Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.<br>Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.<br>Приклади речовин з йонним типом хімічного зв 'язку:<br>NaCl, NaBr, NaF, MgCl<sub>2</sub>, MgS, NaOH, Li<sub>2</sub>O, Ca<sub>3</sub>P<sub>2</sub>, AlCl<sub>3</sub>, BaO, KCl<br><br>Розглянь рівняння реакцій утворення деяких йонних сполук:<br>а) взаємодія магнію з йодом:<br> | + | <br>Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.<br>Різнойменно заряджені йони Натрію Na<sup>+</sup> і Хлору Сl<sup>-</sup>, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:<br> |
| | | | |
| - | [[Файл:взаємодія магнію з йодом.jpg]]<br>б) окиснення кальцію:<br> | + | [[Image:Натрій хлорид NaCl.jpg]]<br> |
| | | | |
| - | [[Файл:взаємодія магнію з йодом.jpg]]<br>в) горіння алюмінію в бромі:<br>[[Файл:горіння алюмінію в бромі .jpg]]<br>Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».<br>Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.<br><br><br><u>Bисновки</u><br>Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.<br>Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.<br>Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.<br><br><br><u>Завдання для самоконтролю</u><br>1. Що таке йонний зв'язок? Між якими елементами він виникає?<br>2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.<br>3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na<sub>2</sub>S; в) у кальцій нітриді Ca<sub>3</sub>N<sub>2</sub>. Поясни схеми.<br>4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н<sub>2</sub>0, РН<sub>3</sub>, CaS, ZnCI<sub>2</sub>, SiH<sub>4</sub>, ССl<sub>4</sub>.<br>5. Запиши формули сполук, до складу яких входять такі йони: a) Na<sup>+</sup> і Вr<sup>-</sup>; б) Са<sup>2+</sup> і Сl<sup>-</sup>; в) К<sup>+</sup> і S<sup>2+</sup>. Назви ці сполуки.<br>6. Яскраво виражений йонний зв'язок у парі атомів<br>(а) K—F; (в) F—F;<br>(б) 0—F; (г) P—F.<br>7. Хлор у сполуках утворює йонні зв'язки з<br>(а) К; (б) Н; (в) Са; (г) С. | + | <br>Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.<br>Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.<br>Приклади речовин з йонним типом хімічного зв 'язку:<br>NaCl, NaBr, NaF, MgCl<sub>2</sub>, MgS, NaOH, Li<sub>2</sub>O, Ca<sub>3</sub>P<sub>2</sub>, AlCl<sub>3</sub>, BaO, KCl<br><br>Розглянь рівняння реакцій утворення деяких йонних сполук:<br>а) взаємодія магнію з йодом:<br> |
| | + | |
| | + | [[Image:Взаємодія магнію з йодом.jpg]]<br>б) окиснення кальцію:<br> |
| | + | |
| | + | [[Файл:окиснення кальцію.jpg]]<br>в) горіння алюмінію в бромі:<br>[[Image:Горіння алюмінію в бромі .jpg]]<br>Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».<br>Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.<br><br><br><u>Bисновки</u><br>Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.<br>Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.<br>Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.<br><br><br><u>Завдання для самоконтролю</u><br>1. Що таке йонний зв'язок? Між якими елементами він виникає?<br>2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.<br>3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na<sub>2</sub>S; в) у кальцій нітриді Ca<sub>3</sub>N<sub>2</sub>. Поясни схеми.<br>4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н<sub>2</sub>0, РН<sub>3</sub>, CaS, ZnCI<sub>2</sub>, SiH<sub>4</sub>, ССl<sub>4</sub>.<br>5. Запиши формули сполук, до складу яких входять такі йони: a) Na<sup>+</sup> і Вr<sup>-</sup>; б) Са<sup>2+</sup> і Сl<sup>-</sup>; в) К<sup>+</sup> і S<sup>2+</sup>. Назви ці сполуки.<br>6. Яскраво виражений йонний зв'язок у парі атомів<br>(а) K—F; (в) F—F;<br>(б) 0—F; (г) P—F.<br>7. Хлор у сполуках утворює йонні зв'язки з<br>(а) К; (б) Н; (в) Са; (г) С. |
| | | | |
| | <br><u>Додаткові завдання</u><br>8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це<br>(а) Cu i F; (в) Na і F;<br>(б) C i N; (г) Li i Н.<br>9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.<br>10*. У натрій гідроксиді йонними є зв'язки<br>(а) між Натрієм і Оксигеном;<br>(б) між Гідрогеном і Оксигеном;<br>(в) між Натрієм і Гідрогеном;<br>(г) усі зв'язки.<br>11*. Порівняй будову йонів Мg<sup>2+</sup> і F<sup>-</sup> з будовою атома Неону. Знайди подібні й відмінні ознаки.<br>12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?<br>13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?<br> | | <br><u>Додаткові завдання</u><br>8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це<br>(а) Cu i F; (в) Na і F;<br>(б) C i N; (г) Li i Н.<br>9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.<br>10*. У натрій гідроксиді йонними є зв'язки<br>(а) між Натрієм і Оксигеном;<br>(б) між Гідрогеном і Оксигеном;<br>(в) між Натрієм і Гідрогеном;<br>(г) усі зв'язки.<br>11*. Порівняй будову йонів Мg<sup>2+</sup> і F<sup>-</sup> з будовою атома Неону. Знайди подібні й відмінні ознаки.<br>12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?<br>13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?<br> |
Версия 18:28, 1 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Йонний зв’язок
Тобі треба
розуміти суть понять: йонний зв'язок; йон;
уміти: пояснювати утворення йонного зв'язку в сполуках; характеризувати особливості йонного зв'язку.
Ти вже розумієш, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегатив-ністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:
2Na + Сl2 = 2NaCl

Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:
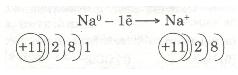
Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.
Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон:
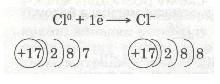
Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:

Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.
Різнойменно заряджені йони Натрію Na+ і Хлору Сl-, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:
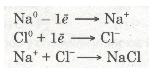
Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.
Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.
Приклади речовин з йонним типом хімічного зв 'язку:
NaCl, NaBr, NaF, MgCl2, MgS, NaOH, Li2O, Ca3P2, AlCl3, BaO, KCl
Розглянь рівняння реакцій утворення деяких йонних сполук:
а) взаємодія магнію з йодом:
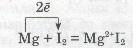
б) окиснення кальцію:
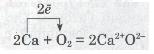
в) горіння алюмінію в бромі:
Файл:Горіння алюмінію в бромі .jpg
Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».
Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.
Bисновки
Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.
Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.
Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.
Завдання для самоконтролю
1. Що таке йонний зв'язок? Між якими елементами він виникає?
2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.
3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na2S; в) у кальцій нітриді Ca3N2. Поясни схеми.
4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н20, РН3, CaS, ZnCI2, SiH4, ССl4.
5. Запиши формули сполук, до складу яких входять такі йони: a) Na+ і Вr-; б) Са2+ і Сl-; в) К+ і S2+. Назви ці сполуки.
6. Яскраво виражений йонний зв'язок у парі атомів
(а) K—F; (в) F—F;
(б) 0—F; (г) P—F.
7. Хлор у сполуках утворює йонні зв'язки з
(а) К; (б) Н; (в) Са; (г) С.
Додаткові завдання
8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це
(а) Cu i F; (в) Na і F;
(б) C i N; (г) Li i Н.
9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.
10*. У натрій гідроксиді йонними є зв'язки
(а) між Натрієм і Оксигеном;
(б) між Гідрогеном і Оксигеном;
(в) між Натрієм і Гідрогеном;
(г) усі зв'язки.
11*. Порівняй будову йонів Мg2+ і F- з будовою атома Неону. Знайди подібні й відмінні ознаки.
12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?
13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Плани уроків з хімії, підручники та книги шкільної програми онлайн, хімія 8 клас
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|