|
|
|
| Строка 25: |
Строка 25: |
| | ''1.Окиснення аміаку.'' Аміак, маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник. Відновні властивості аміаку виявляються під час горіння його в кисні (мал. 5).<br> | | ''1.Окиснення аміаку.'' Аміак, маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник. Відновні властивості аміаку виявляються під час горіння його в кисні (мал. 5).<br> |
| | | | |
| - | [[Image:3-3..jpg|Горіння аміаку. фото]]<br> ''Мал. 5. Горіння аміаку '' | + | [[Image:3-3..jpg|350px|Горіння аміаку. фото]]<br> ''Мал. 5. Горіння аміаку '' |
| | | | |
| | 4NH<sub>3</sub> + 30<sub>2</sub> ⇔ 2N<sub>2</sub> + 6H<sub>2</sub>0 | | 4NH<sub>3</sub> + 30<sub>2</sub> ⇔ 2N<sub>2</sub> + 6H<sub>2</sub>0 |
| Строка 105: |
Строка 105: |
| | '''Сполуки неметалічних елементів із Гідрогеном'''<br>Склад і назви сполук. Сполуки з Гідрогеном відомі для більшості [[Багатоманітність речовин. Прості й складні речовини. Метали й неметали|неметалічних елементів]]; їх не утворюють лише інертні елементи.<br>Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент1.<br>У таблиці 2 наведено формули найважливіших сполук неметалічних елементів із [[Практичні роботи: 1. Добування вуглекислого газу. Взаємоперетворення карбонатів і гідрогенкарбонатів.|Гідрогеном]]. | | '''Сполуки неметалічних елементів із Гідрогеном'''<br>Склад і назви сполук. Сполуки з Гідрогеном відомі для більшості [[Багатоманітність речовин. Прості й складні речовини. Метали й неметали|неметалічних елементів]]; їх не утворюють лише інертні елементи.<br>Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент1.<br>У таблиці 2 наведено формули найважливіших сполук неметалічних елементів із [[Практичні роботи: 1. Добування вуглекислого газу. Взаємоперетворення карбонатів і гідрогенкарбонатів.|Гідрогеном]]. |
| | | | |
| - | [[Image:H1013.jpg|Таблиця. фото]]<br>''► Визначте ступені окиснення елементів у сполуках неметалічних елементів 3-го періоду з Гідрогеном.''<br>Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НпЕ і ЕНп. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним. Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку (див. форзац І).<br>Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви (амоніак, метан, вода, хлороводень, сірководень та ін.), іноді — хімічні (гідроген хлорид, гідроген сульфід тощо).<br>Будова. Сполуки неметалічних елементів із Гідрогеном складаються з молекул (мал. 17). Атоми в них сполучені ковалентними зв'язками. Якщо електронегативності елемента і Гідрогену однакові, то ці зв'язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв'язки полярні. | + | [[Image:H1013.jpg|350px|Таблиця. фото]]<br>''► Визначте ступені окиснення елементів у сполуках неметалічних елементів 3-го періоду з Гідрогеном.''<br>Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НпЕ і ЕНп. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним. Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку (див. форзац І).<br>Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви (амоніак, метан, вода, хлороводень, сірководень та ін.), іноді — хімічні (гідроген хлорид, гідроген сульфід тощо).<br>Будова. Сполуки неметалічних елементів із Гідрогеном складаються з молекул (мал. 17). Атоми в них сполучені ковалентними зв'язками. Якщо електронегативності елемента і Гідрогену однакові, то ці зв'язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв'язки полярні. |
| | | | |
| - | [[Image:H1014.jpg|Масштабні моделі молекул. Кулестержневі моделі молекул. Водневі зв'язки в рідкому гідроген фториді. фото]]<br>''► Зобразіть електронні та графічні формули молекул НГ і 8іН4. Покажіть у графічних формулах зміщення спільних електронних пар до відповідних атомів.''<br>Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; вона має два електричні полюси і називається диполем.<br>Полярними є молекули НГ, Н2О, МН3 (мал. 18) та деякі інші.<br>► ''Доведіть, що молекула води полярна.''<br>[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Фізичні властивості]]. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НГ (за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким.<br>Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас1. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності (мал. 19). Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами (мал. 20). | + | [[Image:H1014.jpg|350px|Масштабні моделі молекул. Кулестержневі моделі молекул. Водневі зв'язки в рідкому гідроген фториді. фото]]<br>''► Зобразіть електронні та графічні формули молекул НГ і 8іН4. Покажіть у графічних формулах зміщення спільних електронних пар до відповідних атомів.''<br>Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; вона має два електричні полюси і називається диполем.<br>Полярними є молекули НГ, Н2О, МН3 (мал. 18) та деякі інші.<br>► ''Доведіть, що молекула води полярна.''<br>[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Фізичні властивості]]. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НГ (за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким.<br>Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас1. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності (мал. 19). Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами (мал. 20). |
| | | | |
| | Залежність [[Температура|температур]] кипіння сполук елементів VII групи із Гідрогеном від значень їх відносних молекулярних мас<br>Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С). Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині.<br>Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації.<br>Розчини сполук галогенів із Гідрогеном і Сульфуру1 з Гідрогеном у воді виявляють властивості кислот. Досить полярні зв'язки Н-Е зумовлюють дисоціацію молекул цих сполук у водному розчині з утворенням катіонів Гідрогену: | | Залежність [[Температура|температур]] кипіння сполук елементів VII групи із Гідрогеном від значень їх відносних молекулярних мас<br>Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С). Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині.<br>Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації.<br>Розчини сполук галогенів із Гідрогеном і Сульфуру1 з Гідрогеном у воді виявляють властивості кислот. Досить полярні зв'язки Н-Е зумовлюють дисоціацію молекул цих сполук у водному розчині з утворенням катіонів Гідрогену: |
Версия 16:24, 20 августа 2012
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню
Будова молекули.
Молекула аміаку NH3 являє собою диполь: спільні електронні пари дуже зміщені до атома Нітрогену (чому?):
.. ..
NH3, H :N: H N
.. / ↑ \
N H H H
• Зазначте електронні формули атомів Нітрогену і Гідрогену, покажіть графічно розміщення електронів по орбіталях і поясніть, якими електронами утворюється ковалентний зв'язок у молекулі аміаку і чому він полярний. Яка валентність і ступінь окиснення Нітрогену в аміаку?
Фізичні властивості.
Аміак NH3 — безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (при 200С в 1 об'ємі води — 700 об'ємів NH3), при температурі, нижчій за — 33,4 °С переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
Хімічні властивості.
Для аміаку характерні реакції окиснення і приєднання.
1.Окиснення аміаку. Аміак, маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник. Відновні властивості аміаку виявляються під час горіння його в кисні (мал. 5).
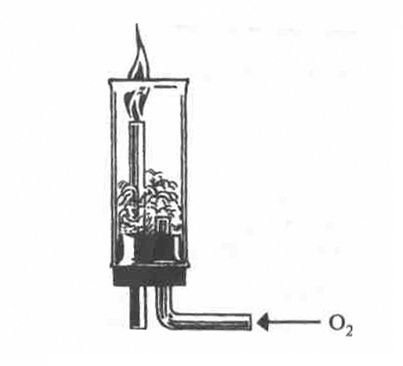
Мал. 5. Горіння аміаку
4NH3 + 302 ⇔ 2N2 + 6H20
За наявності каталізатора (Pt) реакція окиснення аміаку змінюється: замість вільного азоту утворюється оксид нітрогену (ІІ) N0:
4NH3 + 502 = 4N0↑ + 6Н20
• Складіть для наведених рівнянь електронний баланс, обґрунтуйте розстановку коефіцієнтів і доведіть, що аміак в обох випадках — відновник.
2. Взаємодія з водою. Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Якщо суху колбу, заповнену аміаком і закриту пробкою із вставленою трубкою з відтягнутим кінцем, занурити у воду, до якої додано кілька крапель розчину фенолфталеїну, то з безбарвної рідини починає бити малиновий «фонтан».
Забарвлення аміачної води свідчить про те, що водний розчин аміаку має лужну реакцію.
Як це можна пояснити? У воді концентрації йонів Гідрогену Н+ і гідроксид-іонів ОН- — однакові:
H2O ⇔ H+ + OH- ,
тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH3 у воді концентрація гідроксид-іонів ОН- збільшується, отже, утворюється лужне середовище, і фенолфталеїн стає малиновим.
Виникнення лужного середовища пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NH+4.
NH3 + H+ → NH4
При цьому вивільнюються з води гідроксид-іони ОН- , що й надає розчину лужної реакції.
Кожний йон амонію NH+4 має чотири ковалентні зв'язки. Три з них юються за рахунок трьох неспарених електронів, які є на р-орбіталях зовнішнього електронного шару атома Нітрогену. Четвертий зв'язок утворюється за донорно-акцепторним механізмом між атомом Нітрогену аміаку (донор) та йоном гідрогену (акцептор):
Н Н +
l І
Н — N: + Н+ → Н — N — Н
І І
Н Н
Усі чотири зв'язки нітроген-гідроген N — Н в йоні амонію рівноцінні, незважаючи на різні механізми їхнього утворення.
Взаємодія аміаку з водою відбувається за рівнянням:
NH3 + Н20 ⇔ NH3 • Н20⇔ NH+4 + ОН-
Але в розчині лише невелика частина молекул NH3 перетворюється на йони амонію NH+4. Тому аміачна вода пахне аміаком.
Аміачну воду позначають формулою NH3 • Н20 і називають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ:
NH3 • Н20 ⇔ NH+4 + ОН-
NH3 • Н20⇔ NH3↑ + Н20
3. Взаємодія з кислотами. Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу — концентрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим — дрібні кристалики хлориду амонію (нашатирю):
NH3 + НСl = NH4Cl
Отже, аміак, взаємодіючи з кислотами, утворює солі амонію:
• Напишіть рівняння реакцій між аміаком і: а) нітратною, б) сульфатною кислотами. Які солі амонію при цьому утворюються?
Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»?
Добування. У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH4Cl і гашеного вапна Са(ОH)2 за рівнянням:
2NH4Cl + Са(ОН)2 = CaCl2+2NH3↑ + 2Н20 .
• Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном?
Застосування. Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках.
У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Які фізичні властивості аміаку? Як його добувають у лабораторних умовах? Напишіть відповідне рівняння реакції.
2. Чи можна зібрати аміак способом: а) витіснення повітря? б) витіснення води? Чому?
3. Зазначте електронні конфігурації атомів Нітрогену і Гідрогену та поясніть, якими електронами утворюються ковалентні зв'язки в молекулі аміаку і чому вона полярна. Яка валентність і який ступінь окиснення Нітрогену в аміаку?
4. Які реакції аміаку з іншими речовинами ведуть до утворення йонів амонію?
5. В якому напрямі (на. підставі принципу Ле Шательє) зміститься рівновага реакції аміаку з водою під час: а) нагрівання; б) охолодження; в) додавання кислоти; г) додавання лугу?
6. На каталітичне окиснення аміаку кількістю речовини 2 моль витрачається кисень об'ємом (н. у.)
(а) 11,2 л; (в) 28 л;
(б) 22,4 л; (г) 56 л.
7. Під час взаємодії хлориду амонію з гашеним вапном масою 370 кг виділяється аміак об'ємом (н. у.)
(а) 11,2 м3: (в) 224 м3;
(б) 22,4 м3; (г) 448 м3.
8. Прокип'ятили 200 г розчину з масовою часткою аміаку в ньому 25 %. При цьому 20 г аміаку звітрилося. Якою стала масова частка аміаку в розчині? Яка маса хлороводню потрібна для його нейтралізації?
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Вислано читачами з інтернет-сайтів
Сполуки неметалічних елементів із Гідрогеном
Склад і назви сполук. Сполуки з Гідрогеном відомі для більшості неметалічних елементів; їх не утворюють лише інертні елементи.
Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент1.
У таблиці 2 наведено формули найважливіших сполук неметалічних елементів із Гідрогеном.
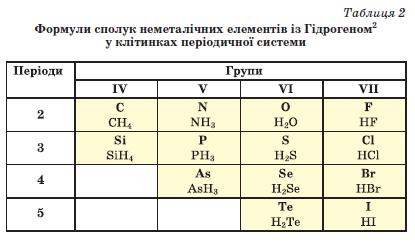
► Визначте ступені окиснення елементів у сполуках неметалічних елементів 3-го періоду з Гідрогеном.
Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НпЕ і ЕНп. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним. Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку (див. форзац І).
Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви (амоніак, метан, вода, хлороводень, сірководень та ін.), іноді — хімічні (гідроген хлорид, гідроген сульфід тощо).
Будова. Сполуки неметалічних елементів із Гідрогеном складаються з молекул (мал. 17). Атоми в них сполучені ковалентними зв'язками. Якщо електронегативності елемента і Гідрогену однакові, то ці зв'язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв'язки полярні.
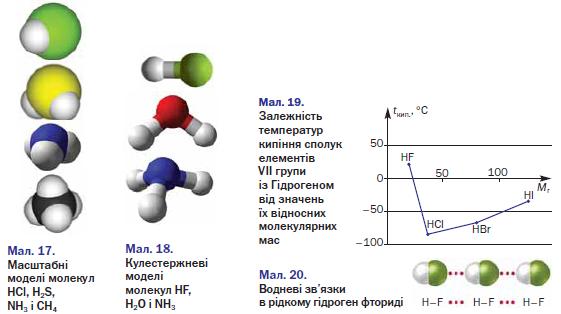
► Зобразіть електронні та графічні формули молекул НГ і 8іН4. Покажіть у графічних формулах зміщення спільних електронних пар до відповідних атомів.
Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; вона має два електричні полюси і називається диполем.
Полярними є молекули НГ, Н2О, МН3 (мал. 18) та деякі інші.
► Доведіть, що молекула води полярна.
Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НГ (за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким.
Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас1. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності (мал. 19). Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами (мал. 20).
Залежність температур кипіння сполук елементів VII групи із Гідрогеном від значень їх відносних молекулярних мас
Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С). Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині.
Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації.
Розчини сполук галогенів із Гідрогеном і Сульфуру1 з Гідрогеном у воді виявляють властивості кислот. Досить полярні зв'язки Н-Е зумовлюють дисоціацію молекул цих сполук у водному розчині з утворенням катіонів Гідрогену:
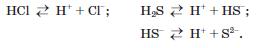
Водні розчини НС1, НВг і НІ поводяться як сильні одноосновні кислоти, НГ — як кислота середньої сили, а Н28 — як слабка двохосновна кислота.
► Яку назву має розчин кожної сполуки?
Метан СН4 інертний щодо води (за звичайних умов).
Водний розчин амоніаку КН3, на відміну від розчинів інших сполук неметалічних елементів із Гідрогеном, має лужну реакцію (§ 5).
Вам відомо, що вода є слабким електролітом. Мізерна частка її молекул дисоціює з утворенням йонів Н+ і ОН~:
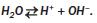
Отже, воду можна вважати дуже слабкою кислотою і водночас дуже слабкою основою.
ВИСНОВКИ
Майже всі неметалічні елементи, крім інертних, утворюють сполуки з Гідрогеном. Їх загальна формула — НПЕ або ЕНп. Для цих сполук найчастіше використовують тривіальні назви.
Сполуки неметалічних елементів із Гідрогеном мають молекулярну будову. Майже всі вони є газами. Водні розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном виявляють властивості кислот.
П.П. Попель, Л.С. Крикля. Хімія, 10 клас
Надіслано читачами інтернет-сайту
Онлайн бібліотека з підручниками і книгами з хімії, плани-конспекти уроків по всім предметам, завдання з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













