|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас|Хімія 7 клас]]>> Хімія: Атомна одиниця маси. Відносна атомна маса хімічних елементів''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас|Хімія 7 клас]]>> Атомна одиниця маси. Відносна атомна маса хімічних елементів''' |
| | | | |
| | <metakeywords>Хімія, Хімія клас 7, тема уроку, Атомна одиниця маси, Відносна атомна маса хімічних елементів</metakeywords> | | <metakeywords>Хімія, Хімія клас 7, тема уроку, Атомна одиниця маси, Відносна атомна маса хімічних елементів</metakeywords> |
| | | | |
| - | Кожен атом хімічного елемента має певну масу. В яких одиницях ця маса виражається?<br>Якщо скористатися звичайними одиницями маси, наприклад грамами, то маса т найлегшого з хімічних елементів — атома Гідрогену становитиме 0, 000 000 000 000 000 000 000 001 67 г.<br>Таке число важко прочитати і важко ним користуватися. Тому такі числа заведено записувати у так званому стандартному вигляді, а саме:<br>m(Н) = 1,67 • 10<sup>-24</sup>.<br>Найважчі атоми, які існують в природі на Землі, це атоми елемента Урану U. їхня маса дорівнює 0, 000 000 000 000 000 000 000 395 г.<br> Спробуй самостійно записати у стандартному вигляді масу атома Урану. Дістанеш m(U) = 3,95 • 10<sup>-22</sup>.<br>Зрозуміло, що подібними числами, навіть записаними у стандартному вигляді, користуватися незручно. Тому на практиці замість абсолютних мас атомів використовують відносні атомні маси, порівнюючи маси атомів різних елементів між собою або з певною частиною маси атома іншого елемента.<br>У ті далекі часи, коли абсолютні (тобто виражені, в одиницях маси) значення атомних мас були: ще не відомі, як одиницю порівняння спочатку обрали масу атома найлегшого з елементів Гідрогену (Дж. Дальтон), потім 1/16 частину маси атома Оксигену (Й. Берцеліус), а маси решти атомів почали виражати відносно цієї маси, тобто у відносних одиницях. За два століття виникла традиція, яка збереглася у хіміків і фізиків усього світу й дотепер.<br>Нині за одиницю порівняння вибрано 1/12 частину маси атома Карбону. Вона називається ''атомною одиницею маси'' — а. о. м. (1 а. о. м. = 1,66 х 10<sup>-27</sup> кг = 1,66 • 10<sup>-24</sup> г).<br>Зрозуміло, що відносна маса атома Карбону, виражена в атомних одиницях маси, дорівнює 12 а. о. м. Отже,<br>'''відносна атомна маса '''— це фізична величина, що визначається відношенням маси атома елемента до 1/12 маси атома Карбону. <br>Відносна атомна маса позначається символом А<sub>r</sub>. А — перша літера слова «атомна», r — перша літера латинського слова «relativus», що означає «відносний».<br>Наприклад, маса атома Флуору F 3,15481 х 10<sup>-23</sup> г. Отже, відносна атомна маса Флуору дорівнює:<br>А<sub>r</sub>(F) = [[Image:розвязання.jpg]]<br><br>Це означає, що маса одного атома Флуору в 19 разів більша від 1/12 маси атома Карбону, тобто від 1 а. о. м. Отже, А<sub>r</sub>(F) = 19.<br><br>Літери «а. о. м.» біля числового значення відносної атомної маси, як правило, не зазначають. Атомна одиниця маси — а. о. м. — позасистемна одиниця, в СІ відносну атомну масу А виражають абстрактним числом.<br>Відносні атомні маси елементів зазначені в періодичній системі хімічних елементів Д. І. Менделєєва. Ми зазвичай будемо користуватися заокругленими значеннями, поданими в табл. 1.<br><br>КОРОТКІ висновки<br>Відносна атомна маса елемента — безрозмірна величина, що дорівнює відношенню маси атома даного елемента до 1/12 маси атома Карбону.<br>1/12 маси атома Карбону — це і є атомна одиниця маси, позначається а. о. м. Вона являє собою величину, що дорівнює 1,66 10-24 г.<br>Значення відносної атомної маси і маси атома, вираженої в а. о. м., чисельно збігаються.<br>Відносні атомні маси хімічних елементів наведені в таблиці Менделєєва.<br><br>Завдання для самоконтролю<br>1. Як ти розумієш поняття «відносна атомна маса»? Наведи його визначення.<br>2. Поясни, що спільного і чим відрізняються поняття «маса атома» і «відносна атомна маса».<br>3. Знайди в періодичній системі елемент із відносною атомною масою 56, зазнач символ і назву цього елемента. У скільки разів атом цього елемента важчий за атом Силіцію?<br>4. Випиши точні значення відносних атомних мас зазначених елементів і заокругли їх: Оксиген, Кальцій, Хлор, Манган, Нітроген, Плюмбум.<br>5. Порівняй відносні атомні маси елементів Купруму, Карбону, Сульфуру, Гідрогену, Брому. Запиши символи цих елементів у порядку зростання їхніх відносних атомних мас.<br><br>Додаткові завдання<br>6. Заповни таблицю:<br>[[Image:завдання.jpg]]<br>7. Знайди в періодичній системі елементи з найменшою і найбільшою відносною атомною масою.<br>8*. Відомо, що 1 см3 водню містить стільки атомів Гідрогену, скільки 1 см3 кисню містить атомів Оксигену. Густина водню дорівнює 0,09 г/см3, а густина кисню — 1,43 г/см3. Обчисли, у скільки разів маса атома Гідрогену менша від маси атома Оксигену.<br> | + | Кожен [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|атом ]][[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|хімічного елемента]] має певну масу. В яких одиницях ця маса виражається?<br>Якщо скористатися звичайними одиницями маси, наприклад грамами, то маса т найлегшого з хімічних елементів — атома Гідрогену становитиме 0, 000 000 000 000 000 000 000 001 67 г.<br>Таке число важко прочитати і важко ним користуватися. Тому такі числа заведено записувати у так званому стандартному вигляді, а саме:<br>m(Н) = 1,67 • 10<sup>-24</sup>.<br>Найважчі атоми, які існують в природі на Землі, це атоми елемента Урану U. їхня маса дорівнює 0, 000 000 000 000 000 000 000 395 г.<br> Спробуй самостійно записати у стандартному вигляді масу атома Урану. Дістанеш m(U) = 3,95 • 10<sup>-22</sup>.<br>Зрозуміло, що подібними числами, навіть записаними у стандартному вигляді, користуватися незручно. Тому на практиці замість абсолютних мас атомів використовують відносні атомні маси, порівнюючи маси атомів різних елементів між собою або з певною частиною маси атома іншого елемента.<br>У ті далекі часи, коли абсолютні (тобто виражені, в одиницях маси) значення атомних мас були: ще не відомі, як одиницю порівняння спочатку обрали масу атома найлегшого з елементів Гідрогену (Дж. Дальтон), потім 1/16 частину маси атома Оксигену (Й. Берцеліус), а маси решти атомів почали виражати відносно цієї маси, тобто у відносних одиницях. За два століття виникла традиція, яка збереглася у хіміків і фізиків усього світу й дотепер.<br>Нині за одиницю порівняння вибрано 1/12 частину маси атома Карбону. Вона називається ''атомною одиницею маси'' — а. о. м. (1 а. о. м. = 1,66 х 10<sup>-27</sup> кг = 1,66 • 10<sup>-24</sup> г).<br>Зрозуміло, що відносна маса атома Карбону, виражена в атомних одиницях маси, дорівнює 12 а. о. м. Отже,<br>'''відносна [[Атомна_одиниця_маси._Повні_уроки|атомна маса]] '''— це [[Презентація_на_тему_«Фізичні_величини.Вимірювання_фізичних_величин»|фізична величина]], що визначається відношенням маси атома елемента до 1/12 маси атома Карбону. <br>Відносна атомна маса позначається символом А<sub>r</sub>. А — перша літера слова «атомна», r — перша літера латинського слова «relativus», що означає «відносний».<br>Наприклад, маса атома Флуору F 3,15481 х 10<sup>-23</sup> г. Отже, відносна атомна маса Флуору дорівнює:<br>А<sub>r</sub>(F) = [[Image:Розвязання.jpg|формула. фото]]<br><br>Це означає, що маса одного атома Флуору в 19 разів більша від 1/12 маси атома Карбону, тобто від 1 а. о. м. Отже, А<sub>r</sub>(F) = 19.<br><br>Літери «а. о. м.» біля числового значення відносної атомної маси, як правило, не зазначають. Атомна одиниця маси — а. о. м. — позасистемна одиниця, в СІ відносну атомну масу А виражають абстрактним числом.<br>Відносні атомні маси елементів зазначені в періодичній системі хімічних елементів Д. І. Менделєєва. Ми зазвичай будемо користуватися заокругленими значеннями, поданими в табл. 1.<br><br>КОРОТКІ висновки<br>Відносна атомна маса елемента — безрозмірна величина, що дорівнює відношенню маси атома даного елемента до 1/12 маси атома Карбону.<br>1/12 маси атома Карбону — це і є атомна одиниця маси, позначається а. о. м. Вона являє собою величину, що дорівнює 1,66 10-24 г.<br>Значення відносної атомної маси і маси атома, вираженої в а. о. м., чисельно збігаються.<br>Відносні атомні маси хімічних елементів наведені в [[41._Періодичний_закон_та_періодична_система_хімічних_елементів_Д._І._Менделєєва|таблиці Менделєєва]].<br><br>'''Завдання для самоконтролю'''<br>''1. Як ти розумієш поняття «відносна атомна маса»? Наведи його визначення.<br>2. Поясни, що спільного і чим відрізняються поняття «маса атома» і «відносна атомна маса».<br>3. Знайди в періодичній системі елемент із відносною атомною масою 56, зазнач символ і назву цього елемента. У скільки разів атом цього елемента важчий за атом Силіцію?<br>4. Випиши точні значення відносних атомних мас зазначених елементів і заокругли їх: Оксиген, Кальцій, Хлор, Манган, Нітроген, Плюмбум.<br>5. Порівняй відносні атомні маси елементів Купруму, Карбону, Сульфуру, Гідрогену, Брому. Запиши символи цих елементів у порядку зростання їхніх відносних атомних мас.''<br><br>'''Додаткові завдання'''<br>''6. Заповни таблицю:''<br>[[Image:Завдання.jpg|Завдання. фото]] |
| | + | |
| | + | ''Таблиця 1. Завдання.''<br>''7. Знайди в періодичній системі елементи з найменшою і найбільшою відносною атомною масою.<br>8*. Відомо, що 1 см3 водню містить стільки атомів Гідрогену, скільки 1 см3 кисню містить атомів Оксигену. Густина водню дорівнює 0,09 г/см3, а густина кисню — 1,43 г/см3. Обчисли, у скільки разів маса атома Гідрогену менша від маси атома Оксигену.<br>'' |
| | + | |
| | + | |
| | + | ''[[Хімія_7_клас|Хімія 7.]] Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська'' |
| | | | |
| - | Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
| |
| | | | |
| | Планування уроків з [[Хімія|хімії]] , відповіді на тести, [[Гіпермаркет Знань - перший в світі!|завдання та відповіді по класам]] , домашнє завадання та робота з [[Хімія 7 клас|хімії 7 класу]]<br> | | Планування уроків з [[Хімія|хімії]] , відповіді на тести, [[Гіпермаркет Знань - перший в світі!|завдання та відповіді по класам]] , домашнє завадання та робота з [[Хімія 7 клас|хімії 7 класу]]<br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%9A%D0%BE%D0%BD%D1%81%D0%BF%D0%B5%D0%BA%D1%82_%D1%83%D1%80%D0%BE%D0%BA%D1%83_%D1%96_%D0%BE%D0%BF%D0%BE%D1%80%D0%BD%D0%B8%D0%B9_%D0%BA%D0%B0%D1%80%D0%BA%D0%B0%D1%81 конспект уроку і опорний каркас] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%9A%D0%BE%D0%BD%D1%81%D0%BF%D0%B5%D0%BA%D1%82_%D1%83%D1%80%D0%BE%D0%BA%D1%83_%D1%96_%D0%BE%D0%BF%D0%BE%D1%80%D0%BD%D0%B8%D0%B9_%D0%BA%D0%B0%D1%80%D0%BA%D0%B0%D1%81 конспект уроку і опорний каркас] |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%97%D0%B0%D0%B4%D0%B0%D1%87%D1%96_%D1%82%D0%B0_%D0%B2%D0%BF%D1%80%D0%B0%D0%B2%D0%B8,%D1%81%D0%B0%D0%BC%D0%BE%D0%BF%D0%B5%D1%80%D0%B5%D0%B2%D1%96%D1%80%D0%BA%D0%B0 задачі та вправи,самоперевірка] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%97%D0%B0%D0%B4%D0%B0%D1%87%D1%96_%D1%82%D0%B0_%D0%B2%D0%BF%D1%80%D0%B0%D0%B2%D0%B8,%D1%81%D0%B0%D0%BC%D0%BE%D0%BF%D0%B5%D1%80%D0%B5%D0%B2%D1%96%D1%80%D0%BA%D0%B0 задачі та вправи,самоперевірка] |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | | | |
Текущая версия на 07:56, 9 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 7 клас>> Атомна одиниця маси. Відносна атомна маса хімічних елементів
Кожен атом хімічного елемента має певну масу. В яких одиницях ця маса виражається?
Якщо скористатися звичайними одиницями маси, наприклад грамами, то маса т найлегшого з хімічних елементів — атома Гідрогену становитиме 0, 000 000 000 000 000 000 000 001 67 г.
Таке число важко прочитати і важко ним користуватися. Тому такі числа заведено записувати у так званому стандартному вигляді, а саме:
m(Н) = 1,67 • 10-24.
Найважчі атоми, які існують в природі на Землі, це атоми елемента Урану U. їхня маса дорівнює 0, 000 000 000 000 000 000 000 395 г.
Спробуй самостійно записати у стандартному вигляді масу атома Урану. Дістанеш m(U) = 3,95 • 10-22.
Зрозуміло, що подібними числами, навіть записаними у стандартному вигляді, користуватися незручно. Тому на практиці замість абсолютних мас атомів використовують відносні атомні маси, порівнюючи маси атомів різних елементів між собою або з певною частиною маси атома іншого елемента.
У ті далекі часи, коли абсолютні (тобто виражені, в одиницях маси) значення атомних мас були: ще не відомі, як одиницю порівняння спочатку обрали масу атома найлегшого з елементів Гідрогену (Дж. Дальтон), потім 1/16 частину маси атома Оксигену (Й. Берцеліус), а маси решти атомів почали виражати відносно цієї маси, тобто у відносних одиницях. За два століття виникла традиція, яка збереглася у хіміків і фізиків усього світу й дотепер.
Нині за одиницю порівняння вибрано 1/12 частину маси атома Карбону. Вона називається атомною одиницею маси — а. о. м. (1 а. о. м. = 1,66 х 10-27 кг = 1,66 • 10-24 г).
Зрозуміло, що відносна маса атома Карбону, виражена в атомних одиницях маси, дорівнює 12 а. о. м. Отже,
відносна атомна маса — це фізична величина, що визначається відношенням маси атома елемента до 1/12 маси атома Карбону.
Відносна атомна маса позначається символом Аr. А — перша літера слова «атомна», r — перша літера латинського слова «relativus», що означає «відносний».
Наприклад, маса атома Флуору F 3,15481 х 10-23 г. Отже, відносна атомна маса Флуору дорівнює:
Аr(F) = 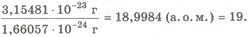
Це означає, що маса одного атома Флуору в 19 разів більша від 1/12 маси атома Карбону, тобто від 1 а. о. м. Отже, Аr(F) = 19.
Літери «а. о. м.» біля числового значення відносної атомної маси, як правило, не зазначають. Атомна одиниця маси — а. о. м. — позасистемна одиниця, в СІ відносну атомну масу А виражають абстрактним числом.
Відносні атомні маси елементів зазначені в періодичній системі хімічних елементів Д. І. Менделєєва. Ми зазвичай будемо користуватися заокругленими значеннями, поданими в табл. 1.
КОРОТКІ висновки
Відносна атомна маса елемента — безрозмірна величина, що дорівнює відношенню маси атома даного елемента до 1/12 маси атома Карбону.
1/12 маси атома Карбону — це і є атомна одиниця маси, позначається а. о. м. Вона являє собою величину, що дорівнює 1,66 10-24 г.
Значення відносної атомної маси і маси атома, вираженої в а. о. м., чисельно збігаються.
Відносні атомні маси хімічних елементів наведені в таблиці Менделєєва.
Завдання для самоконтролю
1. Як ти розумієш поняття «відносна атомна маса»? Наведи його визначення.
2. Поясни, що спільного і чим відрізняються поняття «маса атома» і «відносна атомна маса».
3. Знайди в періодичній системі елемент із відносною атомною масою 56, зазнач символ і назву цього елемента. У скільки разів атом цього елемента важчий за атом Силіцію?
4. Випиши точні значення відносних атомних мас зазначених елементів і заокругли їх: Оксиген, Кальцій, Хлор, Манган, Нітроген, Плюмбум.
5. Порівняй відносні атомні маси елементів Купруму, Карбону, Сульфуру, Гідрогену, Брому. Запиши символи цих елементів у порядку зростання їхніх відносних атомних мас.
Додаткові завдання
6. Заповни таблицю:

Таблиця 1. Завдання.
7. Знайди в періодичній системі елементи з найменшою і найбільшою відносною атомною масою.
8*. Відомо, що 1 см3 водню містить стільки атомів Гідрогену, скільки 1 см3 кисню містить атомів Оксигену. Густина водню дорівнює 0,09 г/см3, а густина кисню — 1,43 г/см3. Обчисли, у скільки разів маса атома Гідрогену менша від маси атома Оксигену.
Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
Планування уроків з хімії , відповіді на тести, завдання та відповіді по класам , домашнє завадання та робота з хімії 7 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











