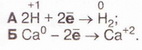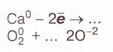|
|
|
| Строка 7: |
Строка 7: |
| | <u>Застосуйте свої знання й уміння</u><br> | | <u>Застосуйте свої знання й уміння</u><br> |
| | | | |
| - | 1. Виберіть запис, який відповідає процесу окиснення: | + | 1. Виберіть запис, який відповідає процесу окиснення: |
| | | | |
| - | [[Image:Chemistry_107.jpg]] | + | [[Image:Chemistry 107.jpg]] |
| | | | |
| | 2. Остап і Тарас посперечалися. Тарас стверджував, що згоряння вугілля у грубці - процес окиснення Карбону. Остап переконував його, що це процес відновлення Оксигену. Долучіться до їхньої дискусії й поясніть, хто з хлопців має рацію. | | 2. Остап і Тарас посперечалися. Тарас стверджував, що згоряння вугілля у грубці - процес окиснення Карбону. Остап переконував його, що це процес відновлення Оксигену. Долучіться до їхньої дискусії й поясніть, хто з хлопців має рацію. |
| | | | |
| - | 3. Опишіть перебіг хімічних реакцій, схематично зображених на малюнку 1 Поясніть спостережувані зовнішні ефекти, розглянувши реакції з точки зору окиснення-відновлення. Запишіть у повному та скороченому йонному вигляді відповідні хімічні рівняння. | + | 3. Опишіть перебіг хімічних реакцій, схематично зображених на малюнку 1 Поясніть спостережувані зовнішні ефекти, розглянувши реакції з точки зору окиснення-відновлення. Запишіть у повному та скороченому йонному вигляді відповідні хімічні рівняння. |
| | | | |
| - | [[Image:Chemistry_108.jpg]] | + | [[Image:Chemistry 108.jpg]] |
| | | | |
| - | 4. За схематичними зображеннями на малюнку 14.8 визначте, у якій з реє Бром є відновником. За таблицею розчинності визначте, йодиди й броміди яких саме металічних елементів можна використати у цій реакції. Складіть хімічні рівняння обох реакцій, розгляньте їх з точки зору окиснення-відновлення, запишіть у повному й скороченому йонному вигляді. Поясніть, чого після закінчення реакції (1) до її продуктів добавили неполярний чинник ССІ<sub>4</sub>. | + | 4. За схематичними зображеннями на малюнку 14.8 визначте, у якій з реє Бром є відновником. За таблицею розчинності визначте, йодиди й броміди яких саме металічних елементів можна використати у цій реакції. Складіть хімічні рівняння обох реакцій, розгляньте їх з точки зору окиснення-відновлення, запишіть у повному й скороченому йонному вигляді. Поясніть, чого після закінчення реакції (1) до її продуктів добавили неполярний чинник ССІ<sub>4</sub>. |
| | | | |
| - | [[Image:Chemistry_108_1.jpg]] | + | [[Image:Chemistry 108 1.jpg]] |
| | | | |
| | 5. Виберіть загальне число приєднаних електронів в електронному балансі реакції, схема якої С + 0<sub>2</sub> → С0<sub>2</sub>: А 1; Б 2; В 3; Г 4.<br> | | 5. Виберіть загальне число приєднаних електронів в електронному балансі реакції, схема якої С + 0<sub>2</sub> → С0<sub>2</sub>: А 1; Б 2; В 3; Г 4.<br> |
| Строка 29: |
Строка 29: |
| | 8. Доповніть запис електронного балансу і складіть за ним рівняння окисно-відновної реакції: | | 8. Доповніть запис електронного балансу і складіть за ним рівняння окисно-відновної реакції: |
| | | | |
| - | [[Image:Chemistry_109.jpg]] | + | [[Image:Chemistry 109.jpg]] |
| | | | |
| | 9. Виберіть схеми реакцій, у яких Гідроген - окисник: <br>А N<sub>2</sub> + Н<sub>2</sub> → NN3; <br>Б СН<sub>4</sub> → С + Н<sub>2</sub>;<br>В Zn + НСІ → ZnСІ<sub>2</sub> + Н<sub>2</sub>↑; <br>Г Н<sub>2</sub>S0<sub>4</sub> + КОН → К<sub>2</sub>S0<sub>4</sub> + Н<sub>2</sub>0;<br>Д Н<sub>2</sub> + СІ<sub>2</sub> → НСІ; <br>Е СuО + Н<sub>2</sub> → Сu + Н<sub>2</sub>0.<br> | | 9. Виберіть схеми реакцій, у яких Гідроген - окисник: <br>А N<sub>2</sub> + Н<sub>2</sub> → NN3; <br>Б СН<sub>4</sub> → С + Н<sub>2</sub>;<br>В Zn + НСІ → ZnСІ<sub>2</sub> + Н<sub>2</sub>↑; <br>Г Н<sub>2</sub>S0<sub>4</sub> + КОН → К<sub>2</sub>S0<sub>4</sub> + Н<sub>2</sub>0;<br>Д Н<sub>2</sub> + СІ<sub>2</sub> → НСІ; <br>Е СuО + Н<sub>2</sub> → Сu + Н<sub>2</sub>0.<br> |
| Строка 65: |
Строка 65: |
| | <br> ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | | <br> ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| - | <br> <sub>Скачати календарно-тематичне планування з хімії, відповіді на тести, завдання та відповіді школяру, книги та підручники, курси учителю з хімії для 9 класу</sub> | + | <br> <sub>Скачати календарно-тематичне планування [[Хімія|з хімії]], [[Гіпермаркет_Знань_-_перший_в_світі!|відповіді]] на тести, завдання та відповіді школяру, книги та підручники, курси учителю [[Хімія_9_клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
Версия 08:48, 7 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розв'язування задач і вправ №2
РОЗВ'ЯЗУВАННЯ ЗАДАЧ І ВПРАВ №2
Застосуйте свої знання й уміння
1. Виберіть запис, який відповідає процесу окиснення:
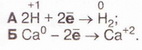
2. Остап і Тарас посперечалися. Тарас стверджував, що згоряння вугілля у грубці - процес окиснення Карбону. Остап переконував його, що це процес відновлення Оксигену. Долучіться до їхньої дискусії й поясніть, хто з хлопців має рацію.
3. Опишіть перебіг хімічних реакцій, схематично зображених на малюнку 1 Поясніть спостережувані зовнішні ефекти, розглянувши реакції з точки зору окиснення-відновлення. Запишіть у повному та скороченому йонному вигляді відповідні хімічні рівняння.
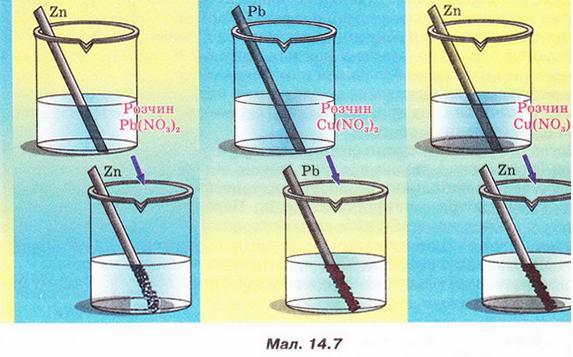
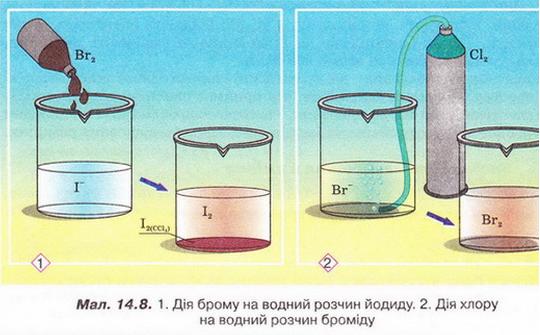
4. За схематичними зображеннями на малюнку 14.8 визначте, у якій з реє Бром є відновником. За таблицею розчинності визначте, йодиди й броміди яких саме металічних елементів можна використати у цій реакції. Складіть хімічні рівняння обох реакцій, розгляньте їх з точки зору окиснення-відновлення, запишіть у повному й скороченому йонному вигляді. Поясніть, чого після закінчення реакції (1) до її продуктів добавили неполярний чинник ССІ4.
5. Виберіть загальне число приєднаних електронів в електронному балансі реакції, схема якої С + 02 → С02: А 1; Б 2; В 3; Г 4.
6. Виберіть загальне число приєднаних електронів в електронному балансі реакції між алюмінієм і хлоридною кислотою: АЗ; Б 6; В 9; Г 12.
7. Виберіть відновник у реакції між цинком і розбавленою сульфатною кислотою: А Н+;Б S+6;В Zn°;Г O-2.
8. Доповніть запис електронного балансу і складіть за ним рівняння окисно-відновної реакції:
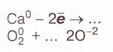
9. Виберіть схеми реакцій, у яких Гідроген - окисник:
А N2 + Н2 → NN3;
Б СН4 → С + Н2;
В Zn + НСІ → ZnСІ2 + Н2↑;
Г Н2S04 + КОН → К2S04 + Н20;
Д Н2 + СІ2 → НСІ;
Е СuО + Н2 → Сu + Н20.
10. Виберіть окисно-відновні процеси:
А Розрядження акумулятора; Б Плавлення льоду; В Реакція нейтралізації; Г Ржавіння заліза; Д Вибілювання волосся; Ж Гниття.
11. Наведіть по два приклади окисно-відновних реакцій, які водночас є реакціями: а) сполучення; б) розкладу; в) заміщення.
12. На уроці української мови учні наводили приклади антонімів. Марійка склала таку таблицю:
Кислий
| Лужний
|
| Окисник
| Відновлення
|
| Аналіз
| Синтез
|
| Сполучення
| Заміщення
|
| Катіон
| Аніон
|
Оцініть правильність виконання завдання, аргументуйте свою думку.
13. Руслана, характеризуючи реакцію заліза із сіркою з точки зору окиснення-відновлення, вжила такі слова: метал, неметал, оксид, відновник, окиснення, відновлення, залізна ожарина. Оцініть правильність виконання завдання, аргументуйте свою думку.
14. Проаналізуйте зміст третьої колонки таблиці 13.1 й визначте, про що ви дізналися і чого навчилися, опрацювавши § 14.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Скачати календарно-тематичне планування з хімії, відповіді на тести, завдання та відповіді школяру, книги та підручники, курси учителю з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|