|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 клас|Химия 8 класс]]>> Химия: Химическое равновесие и способы его смещения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Химическое равновесие и способы его смещения</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Химическое равновесие и способы его смещения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Химическое равновесие и способы его смещения</metakeywords>''' |
| | В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается иа-за того, что уменьшаются концентрации исходных веществ, расходуемых ив образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная вначале, увеличивается но мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными. | | В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается иа-за того, что уменьшаются концентрации исходных веществ, расходуемых ив образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная вначале, увеличивается но мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными. |
| | | | |
Версия 08:33, 15 июня 2010
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Химическое равновесие и способы его смещения
В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается иа-за того, что уменьшаются концентрации исходных веществ, расходуемых ив образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная вначале, увеличивается но мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Состояние химического обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов, то есть ля единицу временя образуется такоеже количество продуктов реакции, какое превращается в исходные вещества. При постоянных температуре и давлении равновесие обратимое реакции может сохраняться неопределенно долгое время.
Нa производстве же чаще всего заинтересованы в преимущественном протекании прямой реакции. Например, в получении аммиаки, оксида серы (VI). оксида азота (II). Как же вывести систему иэ состояния равновесия? Как влияет на него изменение внешних условии, при которых протекает тот или иной обратимый химический процесс?
Французский химик Амрн Ле Шателье в 1885 г. вывел, a немецкий физик Фердинанд Браун в 1887 г. обосновал общий закон смещения химического равновесия в зависимости ОТ внешних факторов, который известен пол названием принципа Ле Шателье.
Если изменить одно из условий — температуру, давление или концентрацию веществ. — при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует зтому изменению.
Этот принцип можно было бы назвать принципом "делай наоборот и добьешься своего". Рассмотрим, как нужно поступить, чтобы сместить равновесие, если наменять каждое на условий реакции, на примере реакции синтеза аммиака.
Вначале Дадим характеристику этого процесса. 1. Прямая реакции является реакцией соединения. Так как из двух простых веществ азота и водорода — образуется одно сложное вещество — аммиак. Разумеется, обратная реакция по атому признаку относится к реакциям разложения.
2. Так как обе реакции - и прямая, и обратная протекают в присутствии катализатора (им может служить или универсальная, но дорогая платина, дешевый железный катализатор с добавками оксидов калия и алюминия), го обе реакции являются каталитическими. Следует отметить, что катализатор не влияет на смещение равновесия, он одинаково изменяет как скорость прямой, так и скорость обратной реакций, то есть только ускоряет момент наступления химического равновесия.
3. Прямая реакция протекает с образованием теплоты, поэтому относится к мезотермическим реакциям. Логично поэтому утверждать, что обратная реакция является эндотермической и протекает с поглощением теплоты.
Итак, рассмотрим теперь, как применим принцип Ле Шателье, принцип противодействия, для смещения равновесия реакции синтеза аммиака.
1. Изменение равновесных концентраций, то есть концентрация веществ после установления равновесия. Чтобы сместить равновесие в сторону обраловакия аммиака, необходимо увеличить концентрацию исходных веществ, то есть концентрацию азота и водорода, и уменьшить концентрацию продукта, то есть аммиака. Равновесные концентрации принято обозначать квадратными скобками, в отличие от неравновесных, которые обозначают буквой с. Следовательно, чтобы сместить равновесие нашей реакции вправо, нужно увеличить концентрацию азота и водорода и уменьшить концентрацию аммиака то есть вывести его из сферы реакция. Понятно, что для смещения равновесия влево нужно поступить наоборот.
2. Изменение давления. Сиител аммиака из водорода и азота сопровождается уменьшением объема: на четырех молей исходных веществ образуется только два моля аммиака. Очевидно, что в закрытом сосуде или аппарате (он называется колонной синтеза) продукты этой реакции создают меньшее давление, чем создавали исходные вещества. Значит, прямая реакция — синтез аммиака — сопровождается понижением давления.
Наоборот, разложение аммиака на водород и азот ведет к увеличению числа газообразных молекул, а потому и к увеличению давления. При сжатии реакционной смеси равновесие смещается вправо, в сторону опряноипинн аммиака, так как этот процесс приводит к уменьшению давления, то есть противодействует внешнему воздействию. Наоборот, уменьшение давления смещает равновесие влево, в направлении разложения аммиака.
Необходимо отметить, что изменение давления смещает равновесие лишь в том случае, если в реакции принимают участие газообразные вещества и она сопровождается изменением их количества. Если же количество газообразных веществ в процессе реакции не изменяется, то увеличение или уменьшение давления не влияет на равновесие такой обратимой реакции. Например, в реакции синтеза оксида азота (II) общее количество исходных газов N2 и 02 равно количеству продукта N0 (по два моля).
Поэтому изменение давления не нарушает равновесие этой реакции.
3. Изменение температуры. Мы уже выяснили, что процесс образования аммиака из водорода и азота является экзотермическим, а обратный — разложение аммиака — эндотермическим. При повышении температуры равновесие этой реакции сместится влево, в направлении реакции разложения аммиака, которая проходит с поглощением теплоты и поэтому ослабляется внешним воздействием — повышением температуры. Наоборот, охлаждение реакционной смеси смещает равновесие вправо, в направлении реакции синтеза аммиака. Эта реакция идет с выделением теплоты и противодействует охлаждению.
Следовательно, повышение температуры смещает химическое равновесие в сторону эндотермической реакции, а понижение температуры — в направлении экзотермической реакции.
Как можно убедиться на рассмотренных примерах, применение принципа Ле Шателье к обратимым химическим процессам открывает путь к управлению химическими реакциями.
Рассмотрите, как нужно изменить концентрацию веществ, давление и температуру, чтобы сместить равновесие вправо.
Вы уже убедились, что для смешения реакции синтеза амчпакя вправо необходимо понизить температуру. Почему же на производстве этот процесс проводят при достаточно высокой температуре — 500—550 °С?
Как нужно изменить концентрацию веществ, температуру и давление реакции синтеза иодоводорода, чтобы сместить равновесие вправо:
Как нужно изменить давление и температуру реакции обжига известняка, чтобы сместить равновесие вправо:
Объясните, почему раствор угольной кислоты, окрашенный лакмусом в красный цвет, через некоторое время становится фиолетовым.
Почему изменение давления не влияет на равновесие процесса синтеза оксида азота (Н)? Как изменится равновесие этого процесса при повышении температуры?
1. Состояние химического равновесия.
2. Принцип Ле Шателье и влияние изменения концентрации, температуры и давления на смещение равновесия.
Дайте характеристику реакции синтеза оксида серы (VI) из оксида серы (IV) и кислорода:
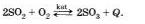
Рассмотрите, как нужно изменить концентрацию веществ, давление и температуру, чтобы сместить равновесие вправо.
Вы уже убедились, что для смешения реакции синтеза аммиака вправо необходимо понизить температуру. Почему же на производстве этот процесс проводят при достаточно высокой температуре — 500—550 °С?
Как нужно изменить концентрацию веществ, температуру и давление реакции синтеза иодоводорода, чтобы сместить равновесие вправо:
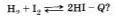
Как нужно изменить давление и температуру реакции обжига известняка, чтобы сместить равновесие вправо:
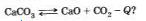
Объясните, почему раствор угольной кислоты, окрашенный лакмусом в красный цвет, через некоторое время становится фиолетовым.
Почему изменение давления не влияет на равновесие процесса синтеза оксида азота (Н)? Как изменится равновесие этого процесса при повышении температуры?
графики к уроку 8 класса, поговорки к уроку химии, домашние задания для всех классов
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










