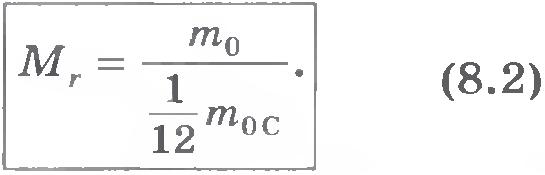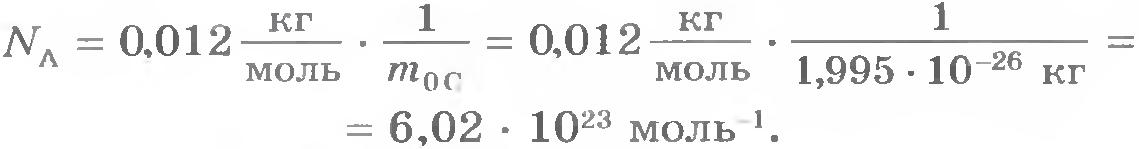|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 10 класс, Масса молекул, Количество вещества</metakeywords> | | <metakeywords>Физика, 10 класс, Масса молекул, Количество вещества</metakeywords> |
| | | | |
| - | Массы атомов и молекул различаются значительно. Какими величинами их удобно характеризовать? Как определить число атомов в любом макроскопическом теле?<br> '''Масса молекулы воды.''' Массы отдельных молекул и атомов очень малы. Например, в 1 г воды содержится 3,7•10<sup>22</sup> молекул. Следовательно, масса одной молекулы воды (Н<sub>2</sub>0) равна:<br>[[Image:A57-1.jpg|center|427x49px]] Массу такого же порядка имеют молекулы других веществ, исключая огромные молекулы органических веществ; например, белки имеют массу, в сотни тысяч раз большую, чем масса отдельных атомов. Но все равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы.<br> '''Относительная молекулярная масса.''' Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 1/12 массы атома углерода (так называемая углеродная шкала атомных масс). '''Относительной молекулярной (или атомной) массой вещества''M<sub>r</sub>''''' называют отношение массы молекулы (или атома) ''m<sub>0</sub>'' данного вещества к 1/12 массы атома углерода ''m<sub>0C</sub>'':<br>[[Image:A57-2.jpg|center|224x71px]] Относительные атомные массы всех химических элементов точно измерены.<br> Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СО<sub>2</sub> приближенно равна 44, так как относительная атомная масса углерода точно равна 12, а кислорода примерно 16: 12 + 2•16 = 44.<br> '''Количество вещества и постоянная Авогадро.''' ''Количество вещества'' наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число молекул, а относительное их число.<br> В Международной системе единиц количество вещества выражают в ''молях''. Один моль - это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.<br> Значит, в 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают ''N<sub>A</sub> ''и называют ''постоянной Авогадро'' в честь итальянского ученого (XIX в.).<br> Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближенная оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем).<br> Для массы атома углерода измерения дают: [[Image:A57-3.jpg|214x21px]].<br> Постоянную Авогадро ''N<sub>A</sub>'' можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:<br>[[Image:A57-4.jpg|center|497x65px]] | + | Массы атомов и молекул различаются значительно. Какими величинами их удобно характеризовать? Как определить число атомов в любом макроскопическом теле?<br> '''Масса молекулы воды.''' Массы отдельных [[._Рух_і_взаємодія_атомів_і_молекул._Дифузія_.Повні_уроки|молекул]] и атомов очень малы. Например, в 1 г воды содержится 3,7•10<sup>22</sup> молекул. Следовательно, масса одной молекулы воды (Н<sub>2</sub>0) равна:<br>[[Image:A57-1.jpg|center|427x49px|A57-1.jpg]] Массу такого же порядка имеют молекулы других веществ, исключая огромные молекулы органических веществ; например, белки имеют массу, в сотни тысяч раз большую, чем масса отдельных атомов. Но все равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы.<br> '''Относительная молекулярная масса.''' Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 1/12 массы атома углерода (так называемая [[Строение_атома_углерода|углеродная]] шкала атомных масс). '''Относительной молекулярной (или атомной) массой вещества''M<sub>r</sub>''''' называют отношение массы молекулы (или атома) ''m<sub>0</sub>'' данного вещества к 1/12 массы атома углерода ''m<sub>0C</sub>'':<br>[[Image:A57-2.jpg|center|224x71px|A57-2.jpg]] Относительные атомные массы всех химических элементов точно измерены.<br> Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СО<sub>2</sub> приближенно равна 44, так как относительная атомная масса углерода точно равна 12, а кислорода примерно 16: 12 + 2•16 = 44.<br> '''Количество вещества и постоянная [[3._Кількість_речовини._Моль_—_одиниця_кількості_речовини._Число_Авогадро|Авогадро]].''' ''Количество вещества'' наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число молекул, а относительное их число.<br> В Международной системе единиц количество вещества выражают в ''молях''. Один моль - это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.<br> Значит, в 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают ''N<sub>A</sub> ''и называют ''постоянной Авогадро'' в честь итальянского ученого (XIX в.).<br> Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближенная оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов [[Электромагнитное_поле|электромагнитным полем]]).<br> Для массы атома углерода измерения дают: [[Image:A57-3.jpg|214x21px|A57-3.jpg]].<br> Постоянную Авогадро ''N<sub>A</sub>'' можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:<br>[[Image:A57-4.jpg|center|497x65px|A57-4.jpg]] |
| | | | |
| - | [[Image:A57-5.jpg|center|309x33px]] Наименование ''моль<sup>-1</sup>'' указывает на то, что ''N<sub>A</sub>'' - число атомов в 1 моле любого вещества. Если, например, количество вещества [[Image:A57-12.jpg|119x18px]], то число молекул в теле [[Image:A57-6.jpg|161x18px]]. Отсюда видно, что количество вещества равно отношению числа молекул ''N'' в данном теле к постоянной Авогадро ''N<sub>A</sub>'', т. е. к числу молекул в 1 моль вещества:<br>[[Image:A57-7.jpg|center|161x50px]] Огромное числовое значение постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры и массу порядка нескольких десятков граммов.<br> '''Молярная масса.''' Наряду с относительной молекулярной массой ''M<sub>r</sub>'' в физике и химии широко используют понятие ''молярная масса''. '''Молярной массой ''M'' вещества''' называют массу вещества, взятого в количестве 1 моль.<br> Согласно такому определению молярная масса вещества равна произведению массы молекулы на постоянную Авогадро:<br>[[Image:A57-8.jpg|center|218x39px]] Масса ''m'' любого количества вещества равна произведению массы одной молекулы на число молекул в теле:<br>[[Image:A57-9.jpg|center|209x23px]] Заменив ''N<sub>A</sub>'' и ''N'' в формуле (8.4) их выражениями из формул (8.5) и (8.6), получим<br>[[Image:A57-10.jpg|center|161x36px]] '''Количество вещества равно отношению массы вещества к его молярной массе.''' Именно такое определение количества вещества дается в учебнике химии.<br> Число молекул любого количества вещества массой ''m'' и молярной массой ''M'' согласно формулам (8.4) и (8.7) равно:<br>[[Image:A57-11.jpg|center|231x32px]] Формулы (8.2), (8.4) и (8.5) дают определения новым физическим величинам, таким, как относительная молекулярная масса, количество вещества и молярная масса. Вывести их нельзя, их надо просто запомнить. Остальные формулы, например (8.7) и (8.8), можно вывести.<br><br><br> ???<br> 1. Чему равна относительная молекулярная масса воды?<br> 2. Сколько молекул в двух молях воды?<br> 3. Можно ли доказать, что молярная масса ''M'' связана с относительной молекулярной массой соотношением ''M≈10<sup>-3</sup>M<sub>r</sub>'' кг•моль<sup>-1</sup><br><br> (В доказательстве надо использовать формулы (8.5), (8.2), а также значения массы атома углерода и постоянной Авогадро.)<br> | + | [[Image:A57-5.jpg|center|309x33px|A57-5.jpg]] Наименование ''моль<sup>-1</sup>'' указывает на то, что ''N<sub>A</sub>'' - число атомов в 1 моле любого вещества. Если, например, количество вещества [[Image:A57-12.jpg|119x18px|A57-12.jpg]], то число молекул в теле [[Image:A57-6.jpg|161x18px|A57-6.jpg]]. Отсюда видно, что количество вещества равно отношению числа молекул ''N'' в данном теле к постоянной Авогадро ''N<sub>A</sub>'', т. е. к числу молекул в 1 моль вещества:<br>[[Image:A57-7.jpg|center|161x50px|A57-7.jpg]] Огромное числовое значение постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры и массу порядка нескольких десятков граммов.<br> '''Молярная масса.''' Наряду с относительной молекулярной массой ''M<sub>r</sub>'' в [[Почему_тепловые_явления_изучаются_в_молекулярной_физике|физике]] и химии широко используют понятие ''молярная масса''. '''Молярной массой ''M'' вещества''' называют массу вещества, взятого в количестве 1 моль.<br> Согласно такому определению молярная масса вещества равна произведению массы молекулы на постоянную Авогадро:<br>[[Image:A57-8.jpg|center|218x39px|A57-8.jpg]] Масса ''m'' любого количества вещества равна произведению массы одной молекулы на число молекул в теле:<br>[[Image:A57-9.jpg|center|209x23px|A57-9.jpg]] Заменив ''N<sub>A</sub>'' и ''N'' в формуле (8.4) их выражениями из формул (8.5) и (8.6), получим<br>[[Image:A57-10.jpg|center|161x36px|A57-10.jpg]] '''Количество вещества равно отношению массы вещества к его молярной массе.''' Именно такое определение количества вещества дается в учебнике [[Краткий_очерк_истории_развития_химии|химии]].<br> Число молекул любого количества вещества массой ''m'' и молярной массой ''M'' согласно формулам (8.4) и (8.7) равно:<br>[[Image:A57-11.jpg|center|231x32px|A57-11.jpg]] Формулы (8.2), (8.4) и (8.5) дают определения новым физическим величинам, таким, как относительная молекулярная масса, количество вещества и молярная масса. Вывести их нельзя, их надо просто запомнить. Остальные формулы, например (8.7) и (8.8), можно вывести.<br><br><br> ???<br> 1. Чему равна относительная молекулярная масса воды?<br> 2. Сколько молекул в двух молях [[Воды_суши|воды]]?<br> 3. Можно ли доказать, что молярная масса ''M'' связана с относительной молекулярной массой соотношением ''M≈10<sup>-3</sup>M<sub>r</sub>'' кг•моль<sup>-1</sup><br><br> (В доказательстве надо использовать формулы (8.5), (8.2), а также значения массы атома углерода и постоянной Авогадро.)<br> |
| | | | |
| | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' | | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' |
| Строка 14: |
Строка 14: |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | | | |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 05:29, 5 июля 2012
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Масса молекул. Количество вещества
Массы атомов и молекул различаются значительно. Какими величинами их удобно характеризовать? Как определить число атомов в любом макроскопическом теле?
Масса молекулы воды. Массы отдельных молекул и атомов очень малы. Например, в 1 г воды содержится 3,7•1022 молекул. Следовательно, масса одной молекулы воды (Н20) равна:
Массу такого же порядка имеют молекулы других веществ, исключая огромные молекулы органических веществ; например, белки имеют массу, в сотни тысяч раз большую, чем масса отдельных атомов. Но все равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы.
Относительная молекулярная масса. Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 1/12 массы атома углерода (так называемая углеродная шкала атомных масс). Относительной молекулярной (или атомной) массой веществаMr называют отношение массы молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода m0C:
Относительные атомные массы всех химических элементов точно измерены.
Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СО2 приближенно равна 44, так как относительная атомная масса углерода точно равна 12, а кислорода примерно 16: 12 + 2•16 = 44.
Количество вещества и постоянная Авогадро. Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число молекул, а относительное их число.
В Международной системе единиц количество вещества выражают в молях. Один моль - это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Значит, в 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают NA и называют постоянной Авогадро в честь итальянского ученого (XIX в.).
Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближенная оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем).
Для массы атома углерода измерения дают:  . .
Постоянную Авогадро NA можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:
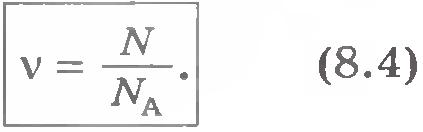
Наименование моль-1 указывает на то, что NA - число атомов в 1 моле любого вещества. Если, например, количество вещества 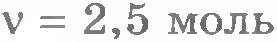 , то число молекул в теле , то число молекул в теле 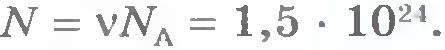 . Отсюда видно, что количество вещества равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т. е. к числу молекул в 1 моль вещества: . Отсюда видно, что количество вещества равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т. е. к числу молекул в 1 моль вещества:
Огромное числовое значение постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры и массу порядка нескольких десятков граммов.
Молярная масса. Наряду с относительной молекулярной массой Mr в физике и химии широко используют понятие молярная масса. Молярной массой M вещества называют массу вещества, взятого в количестве 1 моль.
Согласно такому определению молярная масса вещества равна произведению массы молекулы на постоянную Авогадро:
Масса m любого количества вещества равна произведению массы одной молекулы на число молекул в теле:
Заменив NA и N в формуле (8.4) их выражениями из формул (8.5) и (8.6), получим
Количество вещества равно отношению массы вещества к его молярной массе. Именно такое определение количества вещества дается в учебнике химии.
Число молекул любого количества вещества массой m и молярной массой M согласно формулам (8.4) и (8.7) равно:
Формулы (8.2), (8.4) и (8.5) дают определения новым физическим величинам, таким, как относительная молекулярная масса, количество вещества и молярная масса. Вывести их нельзя, их надо просто запомнить. Остальные формулы, например (8.7) и (8.8), можно вывести.
???
1. Чему равна относительная молекулярная масса воды?
2. Сколько молекул в двух молях воды?
3. Можно ли доказать, что молярная масса M связана с относительной молекулярной массой соотношением M≈10-3Mr кг•моль-1
(В доказательстве надо использовать формулы (8.5), (8.2), а также значения массы атома углерода и постоянной Авогадро.)
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Материалы по физике, задание и ответы по классам, планы конспектов уроков по физике для 10 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|