|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 10 класс, Закон электролиза</metakeywords> | | <metakeywords>Физика, 10 класс, Закон электролиза</metakeywords> |
| | | | |
| - | При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.<br> Очевидно, что масса выделившегося вещества ''m'' равна произведению массы одного иона ''m<sub>0i</sub>'' на число ионов достигших электрода за время [[Image:A120-14.jpg|21x15px]]:<br>[[Image:A120-1.jpg|center|212x24px]] Масса иона ''m<sub>0i</sub>'' согласно формуле (8.4) равна:<br>[[Image:A120-2.jpg|center|203x40px]]где ''М'' - молярная (или атомная) масса вещества, а ''N<sub>A</sub>'' - постоянная Авогадро, т. е. число ионов в одном моле.<br> Число ионов, достигших электрода, равно:<br>[[Image:A120-3.jpg|center|180x42px]]где [[Image:A120-17.jpg|27x20px]] - заряд, прошедший через электролит за время [[Image:A120-14.jpg|21x15px]]; [[Image:A120-15.jpg|23x16px]] - заряд иона, который определяется валентностью ''n'' атома: [[Image:A120-16.jpg|76x17px]] (''е'' - элементарный заряд).<br> При диссоциации молекул, состоящих из одновалентных атомов (''n'' = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K<sup>+</sup> и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu<sup>2+</sup> и SO<sub>4</sub><sup>2-</sup>, так как атомы меди в данном соединении двухвалентны (''n'' = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что [[Image:A120-4.jpg|204x22px]], получаем<br>[[Image:A120-5.jpg|center|205x37px]] '''Закон Фарадея.''' Обозначим через ''k'' коэффициент пропорциональности между массой вещества ''m'' и зарядом [[Image:A120-17.jpg|26x19px]]:<br>[[Image:A120-6.jpg|center|227x44px]]Коэффициент ''k'' зависит от природы вещества (значений ''М'' и ''n''). Согласно формуле (16.6) имеем:<br>[[Image:A120-7.jpg|center|187x19px]] Следовательно, ''масса вещества, выделившегося на электроде за время [[Image:A120-14.jpg|24x17px]] при прохождении электрического тока, пропорциональна силе тока и времени''.<br> Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название '''''закона электролиза Фарадея'''''.<br> Из формулы (16.8) видно, что коэффициент ''k'' численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину ''k'' называют '''электрохимическим эквивалентом''' данного вещества и выражают ''в килограммах на кулон ''(кг/Кл).<br> Электрохимический эквивалент имеет простой физический смысл. Так как [[Image:A120-8.jpg|195x39px]], то согласно формуле (16.7) [[Image:A120-9.jpg|94x48px]], т. е. ''k'' - отношение массы иона к его заряду.<br> Измеряя величины ''m'' и [[Image:A120-17.jpg|27x20px]], можно определить электрохимические эквиваленты различных веществ.<br> Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через''I<sub>1</sub>, I<sub>2</sub>, I<sub>3</sub>''. Тогда ''I<sub>1</sub> = I<sub>2</sub> + I<sub>3</sub>''. Измеряя массы ''m<sub>1</sub>, m<sub>2</sub>, m<sub>3</sub>'' веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов ''I<sub>1</sub>, I<sub>2</sub>, I<sub>3</sub>''.<br>[[Image:A16.26.jpg|center|203x340px]] '''Определение заряда электрона.''' Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен: <br>[[Image:A120-10.jpg|center|213x41px]] Зная массу ''m'' выделившегося вещества при прохождении заряда [[Image:A120-18.jpg|33x17px]], молярную массу ''М'', валентность атомов ''n'' и постоянную Авогадро<span style="font-style: italic;"> </span>''N<sub>A</sub>'', можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10<sup>-19</sup> Кл.<br> Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.<br> Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.<br><br><br> ???<br> 1. Сформулируйте закон электролиза Фарадея.<br> 2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?<br> <br> | + | При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.<br> Очевидно, что масса выделившегося вещества ''m'' равна произведению массы одного иона ''m<sub>0i</sub>'' на число ионов достигших [[Что_такое_электродинамика|электрода]] за время [[Image:A120-14.jpg|21x15px|A120-14.jpg]]:<br>[[Image:A120-1.jpg|center|212x24px|Закон электролиза]] Масса иона ''m<sub>0i</sub>'' согласно формуле (8.4) равна:<br>[[Image:A120-2.jpg|center|203x40px|Закон электролиза]]где ''М'' - молярная (или атомная) масса вещества, а ''N<sub>A</sub>'' - постоянная Авогадро, т. е. число ионов в одном моле.<br> Число ионов, достигших электрода, равно:<br>[[Image:A120-3.jpg|center|180x42px|Закон электролиза]]где [[Image:A120-17.jpg|27x20px|A120-17.jpg]] - заряд, прошедший через электролит за время [[Image:A120-14.jpg|21x15px|A120-14.jpg]]; [[Image:A120-15.jpg|23x16px|A120-15.jpg]] - заряд иона, который определяется валентностью ''n'' атома: [[Image:A120-16.jpg|76x17px|A120-16.jpg]] (''е'' - элементарный заряд).<br> При диссоциации молекул, состоящих из одновалентных атомов (''n'' = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K<sup>+</sup> и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu<sup>2+</sup> и SO<sub>4</sub><sup>2-</sup>, так как атомы меди в данном соединении двухвалентны (''n'' = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что [[Image:A120-4.jpg|204x22px|A120-4.jpg]], получаем<br>[[Image:A120-5.jpg|center|205x37px|Закон электролиза]] '''Закон Фарадея.''' Обозначим через ''k'' коэффициент пропорциональности между массой вещества ''m'' и зарядом [[Image:A120-17.jpg|26x19px|A120-17.jpg]]:<br>[[Image:A120-6.jpg|center|227x44px|Закон электролиза]]Коэффициент ''k'' зависит от природы вещества (значений ''М'' и ''n''). Согласно формуле (16.6) имеем:<br>[[Image:A120-7.jpg|center|187x19px|Закон электролиза]] Следовательно, ''масса вещества, выделившегося на электроде за время [[Image:A120-14.jpg|24x17px|A120-14.jpg]] при прохождении электрического тока, пропорциональна [[Сила_тока|силе тока]] и времени''.<br> Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название '''''закона электролиза Фарадея'''''.<br> Из формулы (16.8) видно, что коэффициент ''k'' численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину ''k'' называют '''электрохимическим эквивалентом''' данного вещества и выражают ''в килограммах на [[Закон_Кулона|кулон]] ''(кг/Кл).<br> Электрохимический эквивалент имеет простой физический смысл. Так как [[Image:A120-8.jpg|195x39px|A120-8.jpg]], то согласно формуле (16.7) [[Image:A120-9.jpg|94x48px|A120-9.jpg]], т. е. ''k'' - отношение массы иона к его заряду.<br> Измеряя величины ''m'' и [[Image:A120-17.jpg|27x20px|A120-17.jpg]], можно определить электрохимические эквиваленты различных веществ.<br> Убедиться в справедливости закона [[Електромагнітна_індукція._Досліди_Фарадея._Гіпотеза_Ампера|Фарадея]] можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через''I<sub>1</sub>, I<sub>2</sub>, I<sub>3</sub>''. Тогда ''I<sub>1</sub> = I<sub>2</sub> + I<sub>3</sub>''. Измеряя массы ''m<sub>1</sub>, m<sub>2</sub>, m<sub>3</sub>'' веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов ''I<sub>1</sub>, I<sub>2</sub>, I<sub>3</sub>''.<br>[[Image:A16.26.jpg|center|203x340px|Закон электролиза]] '''Определение заряда электрона.''' Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен: <br>[[Image:A120-10.jpg|center|213x41px|Закон электролиза]] Зная массу ''m'' выделившегося вещества при прохождении заряда [[Image:A120-18.jpg|33x17px|A120-18.jpg]], молярную массу ''М'', валентность атомов ''n'' и постоянную[[3._Кількість_речовини._Моль_—_одиниця_кількості_речовини._Число_Авогадро|Авогадро]]<span style="font-style: italic;"> </span>''N<sub>A</sub>'', можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10<sup>-19</sup> Кл.<br> Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.<br> Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.<br><br><br> ???<br> 1. Сформулируйте закон электролиза Фарадея.<br> 2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?<br> <br> |
| | | | |
| - | ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' | + | ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, [[Физика,_химия,_космология|Физика]] 10 класс'' |
| | | | |
| | <br> <sub>Планирование уроков [[Физика и астрономия|по физике]], ответы на тесты, задания и ответы по классам, домашнее задание и работа [[Физика 10 класс|по физике для 10 класса]]</sub> | | <br> <sub>Планирование уроков [[Физика и астрономия|по физике]], ответы на тесты, задания и ответы по классам, домашнее задание и работа [[Физика 10 класс|по физике для 10 класса]]</sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | | | |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 15:05, 5 июля 2012
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Закон электролиза
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.
Очевидно, что масса выделившегося вещества m равна произведению массы одного иона m0i на число ионов достигших электрода за время  : :
Масса иона m0i согласно формуле (8.4) равна:
где М - молярная (или атомная) масса вещества, а NA - постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:
где 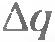 - заряд, прошедший через электролит за время - заряд, прошедший через электролит за время  ; ; 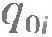 - заряд иона, который определяется валентностью n атома: - заряд иона, который определяется валентностью n атома:  (е - элементарный заряд). (е - элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K+ и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu2+ и SO42-, так как атомы меди в данном соединении двухвалентны (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что 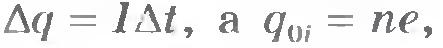 , получаем , получаем
Закон Фарадея. Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом 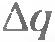 : :
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем:
Следовательно, масса вещества, выделившегося на электроде за время  при прохождении электрического тока, пропорциональна силе тока и времени. при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея.
Из формулы (16.8) видно, что коэффициент k численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину k называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Электрохимический эквивалент имеет простой физический смысл. Так как 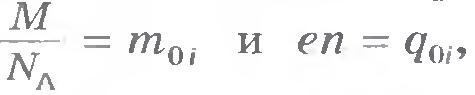 , то согласно формуле (16.7) , то согласно формуле (16.7) 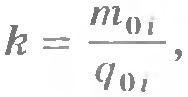 , т. е. k - отношение массы иона к его заряду. , т. е. k - отношение массы иона к его заряду.
Измеряя величины m и 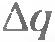 , можно определить электрохимические эквиваленты различных веществ. , можно определить электрохимические эквиваленты различных веществ.
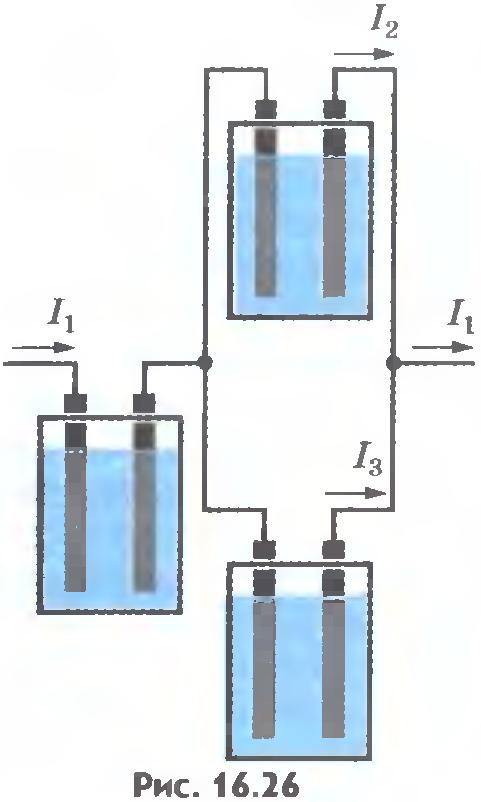
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов черезI1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона. Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:
Зная массу m выделившегося вещества при прохождении заряда  , молярную массу М, валентность атомов n и постояннуюАвогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл. , молярную массу М, валентность атомов n и постояннуюАвогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.
???
1. Сформулируйте закон электролиза Фарадея.
2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Планирование уроков по физике, ответы на тесты, задания и ответы по классам, домашнее задание и работа по физике для 10 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|