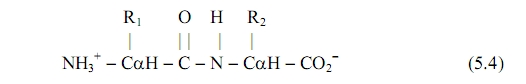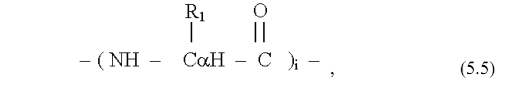|
|
|
| Строка 5: |
Строка 5: |
| | <br> | | <br> |
| | | | |
| - | ''' 5.5. Кодирование и воспроизводство биологической информации '''<br><br>Дать строгое и всеобъемлющее определение, что такое Жизнь, весьма трудно. Можно констатировать, что для живых организмов характерна устойчивая структура, наличие обмена веществ с окружающей средой, поддержание гомеостаза (постоянства внутренней среды), репликация (размножение), изменчивость и отбор. По Ф. Энгельсу жизнь - это способ существования белковых тел. Что верно с той точки зрения, что известные живые существа имеют в своем химическом составе больше белков, чем жирных кислот или углеводов. Формулировка «способ существования» - слишком философская, то есть предельно общая. С точки зрения информатики в более конкретном функциональном определении жизнь можно назвать структурно устойчивым состоянием белковых систем, использующих для поддержания гомеостаза не только обмен веществом и энергией, но и информацией, кодируемой формой и составом отдельных молекул. Последнее, по-видимому, принципиально отличает живое вещество от неживого. Нашей задачей будет описание тех способов и механизмов кодирования информации и её прочтения на молекулярном уровне, которые были отобраны в процессе эволюции жизни. | + | ''' 5.5. Кодирование и воспроизводство биологической информации '''<br><br>Дать строгое и всеобъемлющее определение, что такое Жизнь, весьма трудно. Можно констатировать, что для живых организмов характерна устойчивая структура, наличие обмена веществ с окружающей средой, поддержание гомеостаза (постоянства внутренней среды), репликация ([[Бесполое_размножение_организмов|размножение]]), изменчивость и отбор. По Ф. Энгельсу жизнь - это способ существования белковых тел. Что верно с той точки зрения, что известные живые существа имеют в своем химическом составе больше белков, чем жирных кислот или углеводов. Формулировка «способ существования» - слишком философская, то есть предельно общая. С точки зрения информатики в более конкретном функциональном определении жизнь можно назвать структурно устойчивым состоянием белковых систем, использующих для поддержания гомеостаза не только обмен веществом и энергией, но и информацией, кодируемой формой и составом отдельных молекул. Последнее, по-видимому, принципиально отличает живое вещество от неживого. Нашей задачей будет описание тех способов и механизмов кодирования информации и её прочтения на молекулярном уровне, которые были отобраны в процессе эволюции жизни. |
| | | | |
| - | <br>[[Image:32-02-07.jpg]]<br><br>Но прежде необходимо краткое описание основного «химического материала» жизни: белков и нуклеиновых кислот. <br><br>''' 5.5.1. Состав и структура белков '''<br><br>Структурными единицами белков являются аминокислоты, их известно более 200. Только 60 из них входят в состав организма человека, и всего 20 аминокислот формируют все разнообразие его белков. <br><br>Общую химическую формулу аминокислот можно представить в следующем виде: центральный атом углерода, аминная группа, карбоксильная группа и радикал. Зарядовое состояние аминной и карбоксильной групп изменяется под действием окружающей среды: в неполярной среде аминная группа имеет состав NН2, а карбоксильная - СООН. Боковой радикал, присоединяющийся к центральному атому углерода, определяет специфику данной аминокислоты. Он может иметь совсем простой состав (как в глицине), цепочки углеводородных групп (как в лейцине) или содержать пяти - шестичленные циклы (как в триптофане). <br><br>Химики определяют процесс образования белков как реакцию полимеризации - как реакцию последовательного присоединения отдельных аминокислот в общую цепь. Первый шаг на этом пути - образование димера (цепи из двух звеньев). При этом выделится молекула воды Н2О и будет образована пептидная связь (СО-NН). Будем обозначать боковые радикалы аминокислот буквами R с индексами ( R1 или R2, или Ri ), а их центральные атомы С?. <br><br>Тогда можно записать структурную формулу димера в виде | + | <br>[[Image:32-02-07.jpg|аминокислоты]]<br><br>Но прежде необходимо краткое описание основного «химического материала» жизни: белков и [[Нуклеиновые_кислоты|нуклеиновых кислот]]. <br><br>''' 5.5.1. Состав и структура белков '''<br><br>Структурными единицами белков являются аминокислоты, их известно более 200. Только 60 из них входят в состав организма человека, и всего 20 аминокислот формируют все разнообразие его белков. <br><br>Общую химическую формулу [[Аминокислоты_и_белки|аминокислот]] можно представить в следующем виде: центральный атом углерода, аминная группа, карбоксильная группа и радикал. Зарядовое состояние аминной и карбоксильной групп изменяется под действием окружающей среды: в неполярной среде аминная группа имеет состав NН2, а карбоксильная - СООН. Боковой радикал, присоединяющийся к центральному атому углерода, определяет специфику данной аминокислоты. Он может иметь совсем простой состав (как в глицине), цепочки углеводородных групп (как в лейцине) или содержать пяти - шестичленные циклы (как в триптофане). <br><br>Химики определяют процесс образования белков как реакцию полимеризации - как реакцию последовательного присоединения отдельных аминокислот в общую цепь. Первый шаг на этом пути - образование димера (цепи из двух звеньев). При этом выделится молекула воды Н2О и будет образована пептидная связь (СО-NН). Будем обозначать боковые радикалы аминокислот буквами R с индексами ( R1 или R2, или Ri ), а их центральные атомы С?. <br><br>Тогда можно записать структурную формулу димера в виде |
| | | | |
| - | <br>[[Image:32-02-08.jpg]]<br><br>В ней атомы следуют в таком порядке: центральный углерод аминокислоты - пептидная связь. Это чередование сохраняется при дальнейшей полимеризации. <br><br>Общая формула белков может быть представлена записью <br><br>[[Image:32-02-09.jpg]]<br><br>где индекс i может быть одним из интервала (1 - 20), в зависимости от конкретной аминокислоты. <br><br>Запись в виде (5.5) представляет первичную структуру белка. При больших значениях i, когда полимерная цепь становится весьма и весьма длинной, организуется вторичная структура в виде спиралей. Это повышает их устойчивость к случайным деформациям и препятствует спутыванию полимерных «ниток» в беспорядочный клубок. <br><br>[[Image:32-02-010.jpg]]<br><br>Возможность изменения формы молекул связана с различной «эластичностью» химических связей в них. Отдельные части полимерной цепи могут легко поворачиваться вокруг осей [[Image:32-02-011.jpg]]-связей (С[[Image:32-02-012.jpg]]- С ) или ( С[[Image:32-02-012.jpg]]- N ), вращение же вокруг пептидной связи затруднено, поскольку она носит смешанный характер [[Image:32-02-011.jpg]].- и [[Image:28-02-06.jpg]]-связей (пептидная связь частично двойная). Поэтому многие белки и ферменты имеют спиральную конфигурацию, которая теряется при денатурации в растворе спирта или при нагревании до относительно высокой температуры (всем знаком пример денатурации яичного белка при кипячении). Если взаимодействуют две близко расположенные полимерные цепи, то возможно образование «гармошки» - складчатой конфигурации, в которой две нити идут параллельными уступами, как лестница. При структурном анализе белков описанные участки называют ''a''-спиралями и [[Image:28-02-02.jpg]]- складками. <br><br>В природе ничего не происходит «просто так». Если есть возможность вращений отдельных частей молекулы - нити, то они будут происходить случайным образом под действием тепловых флуктуаций. Но стабильной конфигурации не получится до тех пор, пока не будет достигнут минимум потенциальной энергии. В чем-то конфигурация спирали должна быть энергетически выгоднее, чем просто линейная или зигзагообразная. По данным рентгеноструктурного анализа нашлось простое объяснение типичности спиралей в белках: минимум общей энергии достигается при таких поворотах, которые позволяют установление дополнительных водородных связей между амминной и карбоксильной группами. Как правило в '''''a'''''-спирали каждая NН-группа одной пептидной связи образует «сшивку» с четвертой от неё СО-группой другой пептидной связи, что задает размер витка спирали. Образование химической связи, даже такой слабой, как водородная, сопровождается выделением энергии так, что полная энергия системы при этом понижается. <br><br>Физические и химические свойства органических полимеров определяются не только элементным составом, но и конформацией - пространственным расположением атомов. Мало знать только химический состав, он определит лишь первичную структуру белка или фермента. Для понимания «деятельности» белков и их свойств необходимы данные о вторичной, третичной и надмолекулярной структуре. <br><br>[[Image:32-02-013.jpg]]<br> <br>Например, волосы человека (рис. 5.16) состоят из '''''a'''''-кератина. Полипептидная цепь этого белка построена в основном из глицина, лейцина, цистеина и пяти других аминокислот. Первичной структурой цепи здесь является правая '''''a'''''-спираль. Три таких правых спирали скручиваются затем в общую левую спираль, где удерживаются водородными связями и дисульфидными "мостиками". Далее 9 таких левых спиралей образуют длинный цилиндр, по оси которого проходят 2 внутренние левые спирали - так образуется микрофибрилла. Это уровень домена. Сотни доменов входят в макрофибриллы (уровень глобул), сочетание многих макрофибрилл дают клетку, из последних образуется нить волоса. Отсюда понятна большая эластичность столь высокоспирализованного» материала. При нагрузке спирали разных масштабных уровней раскручиваются вплоть до разрыва более слабых водородных связей. После снятия напряжения первоначальная форма восстанавливается, поскольку более прочные связи дисульфидных мостиков не разрушаются и способствуют регенерации '''''a'''''-спиралей. <br><br>Шелк (натуральный) является [[Image:28-02-02.jpg]]-кератином. В его составе больше аланина и глицина, меньше аминокислот, содержащих серу. Поэтому здесь реализуется другая пространственная структура, в которой [[Image:28-02-02.jpg]].-складки образуют более плоские «листовые» домены. Шелк менее эластичен, чем волосы или шерсть, но он очень гибок, так как один «лист» (слой) сравнительно легко может скользить по другому.<br> <br>В 1960 г. была установлена пространственная структура молекулы миоглобина – белка, выделенного из мышц кашалота. В её составе имеется 153 аминокислотных звена, они формируют общую спираль, которая причудливо изогнута в виде жгута, охватывающего гем железа. Затем была расшифрована структура гемоглобина. <br><br>[[Image:32-02-014.jpg]]<br><br>Молекула гемоглобина более сложная, она состоит из 4 субъединиц, похожих на молекулу миоглобина. Как переносчик кислорода, гемоглобин более эффективен, чем миоглобин. <br><br><br><br><br>
| + | <br>[[Image:32-02-08.jpg|белок]]<br><br>В ней атомы следуют в таком порядке: центральный углерод аминокислоты - пептидная связь. Это чередование сохраняется при дальнейшей полимеризации. <br><br>Общая формула белков может быть представлена записью <br><br>[[Image:32-02-09.jpg|белок]]<br><br>где индекс i может быть одним из интервала (1 - 20), в зависимости от конкретной аминокислоты. <br><br>Запись в виде (5.5) представляет первичную структуру [[Белки_(Химия_10_класс)|белка]]. При больших значениях i, когда полимерная цепь становится весьма и весьма длинной, организуется вторичная структура в виде спиралей. Это повышает их устойчивость к случайным деформациям и препятствует спутыванию полимерных «ниток» в беспорядочный клубок. <br><br>[[Image:32-02-010.jpg|белок]]<br><br>Возможность изменения формы молекул связана с различной «эластичностью» химических связей в них. Отдельные части полимерной цепи могут легко поворачиваться вокруг осей [[Image:32-02-011.jpg]]-связей (С[[Image:32-02-012.jpg]]- С ) или ( С[[Image:32-02-012.jpg]]- N ), вращение же вокруг пептидной связи затруднено, поскольку она носит смешанный характер [[Image:32-02-011.jpg]].- и [[Image:28-02-06.jpg]]-связей (пептидная связь частично двойная). Поэтому многие белки и ферменты имеют спиральную конфигурацию, которая теряется при денатурации в растворе спирта или при нагревании до относительно высокой температуры (всем знаком пример денатурации яичного белка при кипячении). Если взаимодействуют две близко расположенные полимерные цепи, то возможно образование «гармошки» - складчатой конфигурации, в которой две нити идут параллельными уступами, как лестница. При структурном анализе белков описанные участки называют ''a''-спиралями и [[Image:28-02-02.jpg]]- складками. <br><br>В природе ничего не происходит «просто так». Если есть возможность вращений отдельных частей молекулы - нити, то они будут происходить случайным образом под действием тепловых флуктуаций. Но стабильной конфигурации не получится до тех пор, пока не будет достигнут минимум потенциальной энергии. В чем-то конфигурация спирали должна быть энергетически выгоднее, чем просто линейная или зигзагообразная. По данным рентгеноструктурного анализа нашлось простое объяснение типичности спиралей в белках: минимум общей энергии достигается при таких поворотах, которые позволяют установление дополнительных водородных связей между амминной и карбоксильной группами. Как правило в '''''a'''''-спирали каждая NН-группа одной пептидной связи образует «сшивку» с четвертой от неё СО-группой другой пептидной связи, что задает размер витка спирали. Образование химической связи, даже такой слабой, как водородная, сопровождается выделением энергии так, что полная энергия системы при этом понижается. <br><br>Физические и химические свойства органических полимеров определяются не только элементным составом, но и конформацией - пространственным расположением атомов. Мало знать только химический состав, он определит лишь первичную структуру белка или [[Ферменты_(Химия_10_класс)|фермента]]. Для понимания «деятельности» белков и их свойств необходимы данные о вторичной, третичной и надмолекулярной структуре. <br><br>[[Image:32-02-013.jpg|волос]]<br> <br>Например, волосы человека (рис. 5.16) состоят из '''''a'''''-кератина. Полипептидная цепь этого белка построена в основном из глицина, лейцина, цистеина и пяти других аминокислот. Первичной структурой цепи здесь является правая '''''a'''''-спираль. Три таких правых спирали скручиваются затем в общую левую спираль, где удерживаются водородными связями и дисульфидными "мостиками". Далее 9 таких левых спиралей образуют длинный цилиндр, по оси которого проходят 2 внутренние левые спирали - так образуется микрофибрилла. Это уровень домена. Сотни доменов входят в макрофибриллы (уровень глобул), сочетание многих макрофибрилл дают клетку, из последних образуется нить волоса. Отсюда понятна большая эластичность столь высокоспирализованного» материала. При нагрузке спирали разных масштабных уровней раскручиваются вплоть до разрыва более слабых водородных связей. После снятия напряжения первоначальная форма восстанавливается, поскольку более прочные связи дисульфидных мостиков не разрушаются и способствуют регенерации '''''a'''''-спиралей. <br><br>Шелк (натуральный) является [[Image:28-02-02.jpg]]-кератином. В его составе больше аланина и глицина, меньше аминокислот, содержащих серу. Поэтому здесь реализуется другая пространственная структура, в которой [[Image:28-02-02.jpg]].-складки образуют более плоские «листовые» домены. Шелк менее эластичен, чем волосы или шерсть, но он очень гибок, так как один «лист» (слой) сравнительно легко может скользить по другому.<br> <br>В 1960 г. была установлена пространственная структура молекулы миоглобина – белка, выделенного из мышц кашалота. В её составе имеется 153 аминокислотных звена, они формируют общую спираль, которая причудливо изогнута в виде жгута, охватывающего гем [[Железо_(Химия_9_класс)|железа]]. Затем была расшифрована структура гемоглобина. <br><br>[[Image:32-02-014.jpg|миоглобин]]<br><br>Молекула гемоглобина более сложная, она состоит из 4 субъединиц, похожих на молекулу миоглобина. Как переносчик [[Кислород|кислорода]], гемоглобин более эффективен, чем миоглобин. <br><br><br><br><br> |
| | | | |
| | <br> | | <br> |
Текущая версия на 10:28, 9 июля 2012
Гипермаркет знаний>>Естествознание>>Естествознание 11 класс>> Состав и структура белков
5.5. Кодирование и воспроизводство биологической информации
Дать строгое и всеобъемлющее определение, что такое Жизнь, весьма трудно. Можно констатировать, что для живых организмов характерна устойчивая структура, наличие обмена веществ с окружающей средой, поддержание гомеостаза (постоянства внутренней среды), репликация (размножение), изменчивость и отбор. По Ф. Энгельсу жизнь - это способ существования белковых тел. Что верно с той точки зрения, что известные живые существа имеют в своем химическом составе больше белков, чем жирных кислот или углеводов. Формулировка «способ существования» - слишком философская, то есть предельно общая. С точки зрения информатики в более конкретном функциональном определении жизнь можно назвать структурно устойчивым состоянием белковых систем, использующих для поддержания гомеостаза не только обмен веществом и энергией, но и информацией, кодируемой формой и составом отдельных молекул. Последнее, по-видимому, принципиально отличает живое вещество от неживого. Нашей задачей будет описание тех способов и механизмов кодирования информации и её прочтения на молекулярном уровне, которые были отобраны в процессе эволюции жизни.
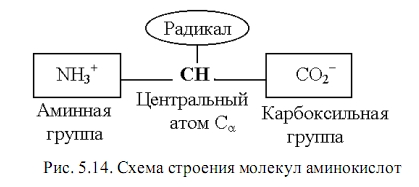
Но прежде необходимо краткое описание основного «химического материала» жизни: белков и нуклеиновых кислот.
5.5.1. Состав и структура белков
Структурными единицами белков являются аминокислоты, их известно более 200. Только 60 из них входят в состав организма человека, и всего 20 аминокислот формируют все разнообразие его белков.
Общую химическую формулу аминокислот можно представить в следующем виде: центральный атом углерода, аминная группа, карбоксильная группа и радикал. Зарядовое состояние аминной и карбоксильной групп изменяется под действием окружающей среды: в неполярной среде аминная группа имеет состав NН2, а карбоксильная - СООН. Боковой радикал, присоединяющийся к центральному атому углерода, определяет специфику данной аминокислоты. Он может иметь совсем простой состав (как в глицине), цепочки углеводородных групп (как в лейцине) или содержать пяти - шестичленные циклы (как в триптофане).
Химики определяют процесс образования белков как реакцию полимеризации - как реакцию последовательного присоединения отдельных аминокислот в общую цепь. Первый шаг на этом пути - образование димера (цепи из двух звеньев). При этом выделится молекула воды Н2О и будет образована пептидная связь (СО-NН). Будем обозначать боковые радикалы аминокислот буквами R с индексами ( R1 или R2, или Ri ), а их центральные атомы С?.
Тогда можно записать структурную формулу димера в виде
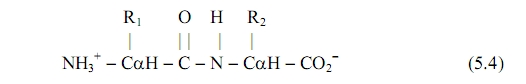
В ней атомы следуют в таком порядке: центральный углерод аминокислоты - пептидная связь. Это чередование сохраняется при дальнейшей полимеризации.
Общая формула белков может быть представлена записью
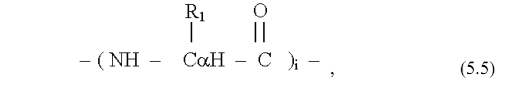
где индекс i может быть одним из интервала (1 - 20), в зависимости от конкретной аминокислоты.
Запись в виде (5.5) представляет первичную структуру белка. При больших значениях i, когда полимерная цепь становится весьма и весьма длинной, организуется вторичная структура в виде спиралей. Это повышает их устойчивость к случайным деформациям и препятствует спутыванию полимерных «ниток» в беспорядочный клубок.
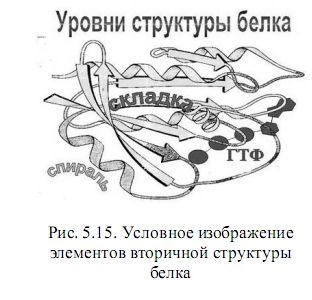
Возможность изменения формы молекул связана с различной «эластичностью» химических связей в них. Отдельные части полимерной цепи могут легко поворачиваться вокруг осей  -связей (С -связей (С - С ) или ( С - С ) или ( С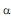 - N ), вращение же вокруг пептидной связи затруднено, поскольку она носит смешанный характер - N ), вращение же вокруг пептидной связи затруднено, поскольку она носит смешанный характер 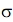 .- и .- и 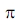 -связей (пептидная связь частично двойная). Поэтому многие белки и ферменты имеют спиральную конфигурацию, которая теряется при денатурации в растворе спирта или при нагревании до относительно высокой температуры (всем знаком пример денатурации яичного белка при кипячении). Если взаимодействуют две близко расположенные полимерные цепи, то возможно образование «гармошки» - складчатой конфигурации, в которой две нити идут параллельными уступами, как лестница. При структурном анализе белков описанные участки называют a-спиралями и -связей (пептидная связь частично двойная). Поэтому многие белки и ферменты имеют спиральную конфигурацию, которая теряется при денатурации в растворе спирта или при нагревании до относительно высокой температуры (всем знаком пример денатурации яичного белка при кипячении). Если взаимодействуют две близко расположенные полимерные цепи, то возможно образование «гармошки» - складчатой конфигурации, в которой две нити идут параллельными уступами, как лестница. При структурном анализе белков описанные участки называют a-спиралями и 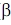 - складками. - складками.
В природе ничего не происходит «просто так». Если есть возможность вращений отдельных частей молекулы - нити, то они будут происходить случайным образом под действием тепловых флуктуаций. Но стабильной конфигурации не получится до тех пор, пока не будет достигнут минимум потенциальной энергии. В чем-то конфигурация спирали должна быть энергетически выгоднее, чем просто линейная или зигзагообразная. По данным рентгеноструктурного анализа нашлось простое объяснение типичности спиралей в белках: минимум общей энергии достигается при таких поворотах, которые позволяют установление дополнительных водородных связей между амминной и карбоксильной группами. Как правило в a-спирали каждая NН-группа одной пептидной связи образует «сшивку» с четвертой от неё СО-группой другой пептидной связи, что задает размер витка спирали. Образование химической связи, даже такой слабой, как водородная, сопровождается выделением энергии так, что полная энергия системы при этом понижается.
Физические и химические свойства органических полимеров определяются не только элементным составом, но и конформацией - пространственным расположением атомов. Мало знать только химический состав, он определит лишь первичную структуру белка или фермента. Для понимания «деятельности» белков и их свойств необходимы данные о вторичной, третичной и надмолекулярной структуре.
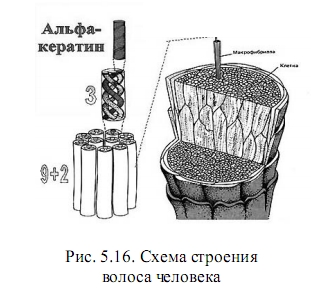
Например, волосы человека (рис. 5.16) состоят из a-кератина. Полипептидная цепь этого белка построена в основном из глицина, лейцина, цистеина и пяти других аминокислот. Первичной структурой цепи здесь является правая a-спираль. Три таких правых спирали скручиваются затем в общую левую спираль, где удерживаются водородными связями и дисульфидными "мостиками". Далее 9 таких левых спиралей образуют длинный цилиндр, по оси которого проходят 2 внутренние левые спирали - так образуется микрофибрилла. Это уровень домена. Сотни доменов входят в макрофибриллы (уровень глобул), сочетание многих макрофибрилл дают клетку, из последних образуется нить волоса. Отсюда понятна большая эластичность столь высокоспирализованного» материала. При нагрузке спирали разных масштабных уровней раскручиваются вплоть до разрыва более слабых водородных связей. После снятия напряжения первоначальная форма восстанавливается, поскольку более прочные связи дисульфидных мостиков не разрушаются и способствуют регенерации a-спиралей.
Шелк (натуральный) является 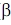 -кератином. В его составе больше аланина и глицина, меньше аминокислот, содержащих серу. Поэтому здесь реализуется другая пространственная структура, в которой -кератином. В его составе больше аланина и глицина, меньше аминокислот, содержащих серу. Поэтому здесь реализуется другая пространственная структура, в которой 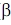 .-складки образуют более плоские «листовые» домены. Шелк менее эластичен, чем волосы или шерсть, но он очень гибок, так как один «лист» (слой) сравнительно легко может скользить по другому. .-складки образуют более плоские «листовые» домены. Шелк менее эластичен, чем волосы или шерсть, но он очень гибок, так как один «лист» (слой) сравнительно легко может скользить по другому.
В 1960 г. была установлена пространственная структура молекулы миоглобина – белка, выделенного из мышц кашалота. В её составе имеется 153 аминокислотных звена, они формируют общую спираль, которая причудливо изогнута в виде жгута, охватывающего гем железа. Затем была расшифрована структура гемоглобина.

Молекула гемоглобина более сложная, она состоит из 4 субъединиц, похожих на молекулу миоглобина. Как переносчик кислорода, гемоглобин более эффективен, чем миоглобин.
Концепции современного естествознания. Стародубцев В.А., 2-е изд., доп. — Томск.: Том. политех. ун-т, 2002. — 184 с.
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|