|
|
|
| Строка 128: |
Строка 128: |
| | Елемент Фосфор — важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор — життєво важливий елемент для всіх організмів. | | Елемент Фосфор — важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор — життєво важливий елемент для всіх організмів. |
| | | | |
| - | Ви вже знаєте, щов молекулі азоту N<sub>2</sub>, за рахунок трьох неспарених електронів кожного з атомів утворюється потрійний з'вязок.йний зв'язок: <br> | + | Ви вже знаєте, щов молекулі азоту N<sub>2</sub>, за рахунок трьох неспарених електронів кожного з атомів утворюється потрійний з'вязок.йний зв'язок: <br> |
| | | | |
| - | N<sub>2 </sub> :N::N: N=N | + | N<sub>2 </sub> :N::N: N=N |
| | | | |
| - | Через це молекула азоту дуже міцна. Потрібно витратити велику кількість енергії на руйнування зв'язку, щоб почалася реакція. Тому молекулярний азот, як правило, вступає в хімічну взаємодію за високих температур. | + | Через це молекула азоту дуже міцна. Потрібно витратити велику кількість енергії на руйнування зв'язку, щоб почалася реакція. Тому молекулярний азот, як правило, вступає в хімічну взаємодію за високих температур. |
| | | | |
| - | Фосфор хімічно активніший, ніж азот. Хімічна активність фосфору залежить від алотропної форми. Так, найактивніший білий фосфор. Ви знаєте, що він легко окислюється на повітрі і світиться в темряві, може самовільно спалахувати. Червоний фосфор менш активний. Він окислюєтьсмя під час нагрівання. Ще менш активний — чорний фосфор. | + | Фосфор хімічно активніший, ніж азот. Хімічна активність фосфору залежить від алотропної форми. Так, найактивніший білий фосфор. Ви знаєте, що він легко окислюється на повітрі і світиться в темряві, може самовільно спалахувати. Червоний фосфор менш активний. Він окислюєтьсмя під час нагрівання. Ще менш активний — чорний фосфор. |
| | | | |
| | У рівняннях хімічних реакцій білий фосфор звичайно позначають формулою Р<sub>4</sub>, що відповідає складу його молекули. Червона і чорна алотропні форми фосфору позначаються символом Р. Такий самий символ використовують, коли форма невідома або може бути будь-якою. Це хімічна формула фосфору умовна для всіх його алотропних форм. | | У рівняннях хімічних реакцій білий фосфор звичайно позначають формулою Р<sub>4</sub>, що відповідає складу його молекули. Червона і чорна алотропні форми фосфору позначаються символом Р. Такий самий символ використовують, коли форма невідома або може бути будь-якою. Це хімічна формула фосфору умовна для всіх його алотропних форм. |
| | | | |
| - | Оскільки Нітроген і Фосфор у сполуках можуть виявляти як позитивний, так і негативний ступені окиснення, їхні прості речовини в реакціях можуть бути як окисниками, так і відновниками. Азот і фосфор поводяться як окисники відносно найактивніших металів і водню. При цьому | + | Оскільки Нітроген і Фосфор у сполуках можуть виявляти як позитивний, так і негативний ступені окиснення, їхні прості речовини в реакціях можуть бути як окисниками, так і відновниками. Азот і фосфор поводяться як окисники відносно найактивніших металів і водню. При цьому |
| | | | |
| - | 0 +6і -3 0 +3і -З<br>N2 -> 2N Р -> Р<br>1. Взаємодія з металами. Азот і фосфор під час нагріван¬ня реагують з багатьма металами, утворюючи відповідно нітриди і фосфіди.<br>3Mg + N2 = Mg3N2<br>3Mg + 2P = Mg3P2<br>Лише з літієм азот реагує за звичайної температури, утворюючи нітрид літію:<br>6Li + N2 = 2Li3N<br>2. Взаємодія з неметалами: а) з воднем азот сполучається за наявності каталізатора, високих тиску і температури, Утворюючи аміак:<br>N2 + ЗН2 £> 2NH3,<br>а Фосфор з воднем практично не взаємодіє;<br>.6) з киснем азот сполучається за температури електрич-1101 Дуги, понад 2000 °С, утворюючи оксид нітрогену(ІІ):<br>N2 + 02 ^ 2NO Фосфор енергійно взаємодіє з киснем. Якщо його підпа-<br>лити, він згоряє в кисні сліпучим яскравим полум ям, утв| рюючи оксид фосфору(У): .. '<br>4Р + 502 = 2Р205<br>Під час повільного окиснення утворюється оксця фосфору(Ш):<br>4Р + 302 = 2Р203 <br>Застосування. Азот у великих кількостях використовуєти ся для добування аміаку і для наповнення електроламі (інертне середовище).<br>Білий фосфор широкого застосування не має. Його використовують для добування інших алотропних *форш фосфатних кислот, як бойову запалювальну речовину, І також для утворення димових завіс.<br>Червоний фосфор використовується для виробництві сірників.<br>У 1831 р. французький винахідник сірників Шарль Соріа почав засто¬совувати білий фосфор для виготовлення сірникових головок. Такі сірни¬ки легко займалися піц час тертя об будь-яку поверхню, але були отруй-1 ними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились.<br>Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до скла- і ду намазки, що наноситься на коробку (разом із сульфідом стибію(Ш) І Sb2S3, залізним суриком Fe203, домішкою кварцу SiQ2 і клею). Головнії сірників складаються, головним чином, з бертолетової солі КС103, моло- 1 того скла, сірки та клею. Під час тертя головки по намазці сірникової І коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.<br>Крім виробництва сірників, фосфор застосовують у ' металургії. Використовують його і для виготовлення напів¬провідників, фосфорорганічних препаратів—засобів зни¬щення комах —шкідників сільськогосподарських рослин.<br>Завдання для самоконтролю<br>65. Запишіть рівняння реакцій, які характеризують хімічні властивості азоту і фосфору. Яка з цих речовин хімічно активніша і чому?<br>66. На кальцій кількістю речовини 1,5 моль за високої темпе ратури подіяли азотом кількістю речовини 1 моль. Які речовини в якій кількості можна виявити після закінчення реакції? 46<br>й7 Обчисліть, чи вистачить 100 л кисню (н. у.) для спалюван¬ім г фосфору. *"* (Я 3 5 т фосфату кальцію, якщо вихід продукту становить «І від теоретичного, можна добути фосфор масою<br>90'^ <br>(б) 2 т;<br>(г) 0,4 т.<br><br> | + | <sub>0 +6e -3 0 +3e -З</sub><br>N<sub>2</sub> → 2N Р → Р |
| | + | |
| | + | ''1. Взаємодія з металами. ''Азот і фосфор під час нагрівання реагують з багатьма металами, утворюючи відповідно нітриди і фосфіди. |
| | + | |
| | + | 3Mg + N<sub>2</sub> = Mg<sub>3</sub>N<sub>2</sub> |
| | + | |
| | + | 3Mg + 2P = Mg<sub>3</sub>P<sub>2</sub> |
| | + | |
| | + | Лише з літієм азот реагує за звичайної температури, утворюючи нітрид літію: |
| | + | |
| | + | 6Li + N<sub>2</sub> = 2Li<sub>3</sub>N |
| | + | |
| | + | ''2. Взаємодія з неметалами:'' а) з воднем азот сполучається за наявності каталізатора, високих тиску і температури, утворюючи аміак: |
| | + | |
| | + | N<sub>2 </sub>+ ЗН<sub>2</sub> ⇔ 2NH<sub>3</sub>, |
| | + | |
| | + | а фосфор з воднем практично не взаємодіє; |
| | + | |
| | + | б) з киснем азот сполучається за температури електричної дуги, понад 2000 °С, утворюючи оксид нітрогену (ІІ): |
| | + | |
| | + | N<sub>2</sub> + 0<sub>2</sub> ⇔ 2NO |
| | + | |
| | + | Фосфор енергійно взаємодіє з киснем. Якщо його підпалити, він згоряє в кисні сліпучим яскравим полум'ям, утворюючи оксид фосфору(V): |
| | + | |
| | + | 4Р + 50<sub>2</sub> = 2Р<sub>2</sub>0<sub>5</sub> |
| | + | |
| | + | Під час повільного окиснення утворюється оксид фосфору(ІІІ): |
| | + | |
| | + | 4Р + 30<sub>2</sub> = 2Р<sub>2</sub>0<sub>3 </sub> |
| | + | |
| | + | ''Застосування. ''Азот у великих кількостях використовується для добування аміаку і для наповнення електроламп (інертне середовище). |
| | + | |
| | + | Білий фосфор широкого застосування не має. Його використовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину, а також для утворення димових завіс. |
| | + | |
| | + | Червоний фосфор використовується для виробництві сірників. |
| | + | |
| | + | У 1831 р. французький винахідник сірників Шарль Соріа почав застосовувати білий фосфор для виготовлення сірникових головок. Такі сірники легко займалися піц час тертя об будь-яку поверхню, але були отруйними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились. |
| | + | |
| | + | Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до складу намазки, що наноситься на коробку (разом із сульфідом стибію () І Sb2S3, залізним суриком Fe203, домішкою кварцу SiQ2 і клею). Головнії сірників складаються, головним чином, з бертолетової солі КС103, моло- 1 того скла, сірки та клею. Під час тертя головки по намазці сірникової І коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.<br>Крім виробництва сірників, фосфор застосовують у ' металургії. Використовують його і для виготовлення напів¬провідників, фосфорорганічних препаратів—засобів зни¬щення комах —шкідників сільськогосподарських рослин.<br>Завдання для самоконтролю<br>65. Запишіть рівняння реакцій, які характеризують хімічні властивості азоту і фосфору. Яка з цих речовин хімічно активніша і чому?<br>66. На кальцій кількістю речовини 1,5 моль за високої темпе ратури подіяли азотом кількістю речовини 1 моль. Які речовини в якій кількості можна виявити після закінчення реакції? 46<br>й7 Обчисліть, чи вистачить 100 л кисню (н. у.) для спалюван¬ім г фосфору. *"* (Я 3 5 т фосфату кальцію, якщо вихід продукту становить «І від теоретичного, можна добути фосфор масою<br>90'^ <br>(б) 2 т;<br>(г) 0,4 т.<br><br> |
| | | | |
| | <u>ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ</u><br>1. Що собою являє озон за звичайних умов? З якою метою він застосовується?<br>2. Які хімічні властивості характерні для кисню і сірки? Наведіть рівняння відповідних реакцій.<br>3. Порівняйте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?<br> 4. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль відіграє сірка в одній і в другій реакціях?<br> 5. Який тип хімічного зв'язку у сполуках Сульфуру з металами?<br> 6. Чому кисень виявляє окисні властивості, а сірка, як окисні, так і відновні?<br> 7. Наведіть кілька прикладів рівнянь реакцій, які засвідчують, що у кисню окисні властивості виявляються сильніше, ніж у<br> сірки.<br> 8. Якщо 31 г заліза взаємодіє з сіркою за умови, що масова частка використання заліза становить 90 %, то в результаті реакції утворюється сульфід феруму масою<br> (а) ~ 12 г; (в) ~ 44 г;<br> (б) ~ 22 г; (г) ~ 88 г.<br> 9. Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів Оксигену і Полонію різко відрізняються один від одного за властивостями. Як ви гадаєте, чим це можна пояснити?<br>10. Якого типу кристалічні гратки в азоту? На підставі яких фізичних властивостей азоту можна про це робити висновок? <br>11. Доведіть розрахунком, що азот трохи легший за повітря. <br>12. Обчисліть густину азоту за воднем.<br>13. Що таке алотропія? Схарактеризуйте найголовніші алотропні форми Фосфору. Розкрийте причину відмінності їхніх властивостей.<br>14. Як ви гадаєте, чому азот — газ, а фосфор — тверда речовина?<br>15. Порівняйте алотропію Оксигену і Фосфору. Що тут спільного і в чому відмінність?<br>16. Розкрийте фізіологічну роль Нітрогену і Фосфору.<br>17. У якому вигляді Нітроген і Фосфор зустрічаються в природі і чому? | | <u>ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ</u><br>1. Що собою являє озон за звичайних умов? З якою метою він застосовується?<br>2. Які хімічні властивості характерні для кисню і сірки? Наведіть рівняння відповідних реакцій.<br>3. Порівняйте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?<br> 4. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль відіграє сірка в одній і в другій реакціях?<br> 5. Який тип хімічного зв'язку у сполуках Сульфуру з металами?<br> 6. Чому кисень виявляє окисні властивості, а сірка, як окисні, так і відновні?<br> 7. Наведіть кілька прикладів рівнянь реакцій, які засвідчують, що у кисню окисні властивості виявляються сильніше, ніж у<br> сірки.<br> 8. Якщо 31 г заліза взаємодіє з сіркою за умови, що масова частка використання заліза становить 90 %, то в результаті реакції утворюється сульфід феруму масою<br> (а) ~ 12 г; (в) ~ 44 г;<br> (б) ~ 22 г; (г) ~ 88 г.<br> 9. Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів Оксигену і Полонію різко відрізняються один від одного за властивостями. Як ви гадаєте, чим це можна пояснити?<br>10. Якого типу кристалічні гратки в азоту? На підставі яких фізичних властивостей азоту можна про це робити висновок? <br>11. Доведіть розрахунком, що азот трохи легший за повітря. <br>12. Обчисліть густину азоту за воднем.<br>13. Що таке алотропія? Схарактеризуйте найголовніші алотропні форми Фосфору. Розкрийте причину відмінності їхніх властивостей.<br>14. Як ви гадаєте, чому азот — газ, а фосфор — тверда речовина?<br>15. Порівняйте алотропію Оксигену і Фосфору. Що тут спільного і в чому відмінність?<br>16. Розкрийте фізіологічну роль Нітрогену і Фосфору.<br>17. У якому вигляді Нітроген і Фосфор зустрічаються в природі і чому? |
Версия 16:23, 7 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Хімія: Основні фізичні та хімічні властивості неметалів
ОСНОВНІ ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ
Кисень 02 і озон 03 — алотропні форми елемента Оксигену.
Порівняння властивостей кисню 02 й озону 03 засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо):
8Ag + 203 = 4Ag20 + 02↑
Таблиця 1. Властивості кисню й озону
Властивості простих речовин
|
Прості речовини
кисень
|
Прості речовини
озон
|
Агрегатний стан за звичайних умов
| Газ
| Газ
|
Колір
| Безбарвний
| Синій
|
Запах
| Без запаху
| Різкий, своєрідний
|
| Розчинність (у 100 об'ємах Н20 при 200С)
| 3 об'єми
| 49 об'ємів
|
Густина газу за н. у.
| 1,43 г/л
| 2,14 г/л
|
| Температура кипіння
| -193 °С
| -112 °С
|
Температура плавлення
| -219 °С
| -192 °С
|
Фізіологічна дія
| Неотруйний
| Дуже отруйний
|
Хімічні властивості
| Окисник
| Дуже сильний окисник
|
Реакційна здатність
| Висока
| Дуже висока
|
Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону 03, і в реакціях окиснення беруть участь саме ці атоми Оксигену.
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива.
Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість.
Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар.
Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі.
Ви вже знаєте, що кисень — дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами і багатьма складними речовинами, виявляючи властивості сильного окисника.
• Які сполуки утворюються під час взаємодії з киснем: а) водню б) алюмінію; в) метану СН4? Напишіть рівняння реакцій, зазначте у кожному з випадків ступінь окиснення елементів окисник і відновник.
Хімічна активність сірки
також доволі висока. При нагріванні вона реагує майже з усіма елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окисника, так і відновника (порівняйте з киснем), бо для неї характерні як позитиви ступені окиснення (+4, +6), так і негативний (-2).
1. Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (окрім золота), утворюючи сульфіди. Так, якщо всипати порошок міді у розплавлену сірку (мал. 3), то відбувається реакція з утворенням чорного сульфіду купруму (І) і виділенням великої кількості теплоти:
2Cu + S = Cu2S
Після початку реакції спиртівку відставляють.
• Сірка безпосередньо сполучається з залізом, цинком, натрієм, алюмінієм. Напишіть рівняння цих реакцій і зазначне назви речовин, що утворилися. 2. Взаємодія з неметалами. Сірка безпосередньо взаємоді з усіма неметалами (окрім йоду й азоту). Реакції відбуваються при нагріванні:
S + 02 = S02↑
H2 + S = H2S↑
Мал. 3. Взаємодія міді і сірки
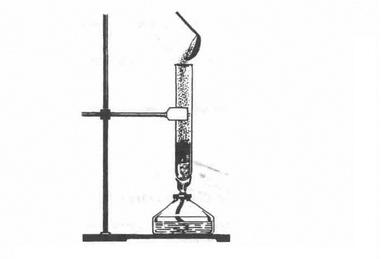
Застосування. Найбільша маса сірки і природних сульфідів витрачається на виробництво сульфатної кислоти. Сірка використовується і в інших галузях хімічної промисловості: для добування сульфітів Na2S03 і Ca(HS03)2 для легкої промисловості, сульфідів Na2S, CaS, BaS для шкіряного виробництва, виготовлення люмінофорів (речовин, здатних світитися). Сірку застосовують у виробництві барвників, гуми, чорного пороху, сірників, ліків, використовують її і в сільському господарстві для боротьби із шкідниками.
Фізичні властивості азоту
За звичайних умов азот — газ без кольору і запаху. Молекули його неполярні, тому взаємодія між ними слабка, вона не може перешкодити їхньому xaoтичному рухові. Цим пояснюється газуватий стан азоту за звичайних умов і це є причиною того, що азот зріджується (-196 °С) і твердне (-210 °С) за дуже низьких температур. У твердому стані має молекулярні кристалічні ґратки. Неполярністю молекул азоту пояснюється його низька розчинність у воді (в 1 об'ємі води за 20 °С розчиняється
0,0154 об'єми азоту). Він трохи легший за повітря, маса 1 л азоту дорівнює 1,25 г.
Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями.
Це — білий, червоний і чорний фосфор.
Білий фосфор — м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але звичайно жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка (tпл. = 44 °С) і легкозаймиста. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули Р4. У воді не розчиняється. Розчиняється у сірковуглеці CS2 та бензині. У темряві на повітрі світиться зеленкувато-жовтим світлом (люмінесценція), при цьому виділяється теплота (хімічна енергія перетворюється на світлову). Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Під час нагрівання або на світлі він перетворюється на червоний фосфор.
Білий фосфор — надзвичайно отруйна речовина, навіть у малих дозах (50 мг) діє смертельно!
Червоний фосфор — порошок від темно-коричневого до червоного і фіолетового кольору, з атомними кристалічними гратками (структура до кінця не з'ясована), без запах, не отруйний на повітрі окиснюється повільно, у темряві не
світиться, загоряється лише при 260 °С. Легко вбирає вологу (гігроскопічний), але у воді і в сірковуглеці CS2 не розчиняється. Під час нагрівання без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор.
Чорний фосфор — речовина, схожа на графіт, має шарувату будову, металічний блиск, виявляє властивості напівпровідника, не отруйний. Це найбільш стійка алотропна форма. Утворюється з білого фосфору при тривалому нагріванні (200 °С) під великим тиском (1220 МПа).
Утворення фосфором кількох алотропних форм пояснюється різним розміщенням атомів один відносно одного у кристалічних ґратках.
У природі Нітроген зустрічається як у вільному стані, так і у зв'язаному. У вільному стані Нітроген у вигляді азоту входить до складу повітря (об'ємна частка N2 становить 78 %, масова — 75,6 %). Оскільки азот з повітря витрачається мало, його запаси в атмосфері залишаються сталими. У вигляді неорганічних сполук Нітроген у невеликих кількостях є в ґрунті. Проте у вигляді складних органічних сполук — білків — він увіходить до складу всіх живих організмів, беручи участь у їх життєдіяльності.
На відміну від Нітрогену Фосфор зустрічається в природі тільки в сполуках (чому?). Найважливіші мінерали, до складу яких уходить фосфат кальцію Са3(Р04)2, — це фосфорити и апатити. Найбільше у світі родовище апатитів на Кольському півострові у Хібінських горах.
В Україні родовища фосфоритів зустрічаються у Придністров'ї, на Харківщині, в Чернігівській та Запорізькій областях.
Елемент Фосфор — важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор — життєво важливий елемент для всіх організмів.
Ви вже знаєте, щов молекулі азоту N2, за рахунок трьох неспарених електронів кожного з атомів утворюється потрійний з'вязок.йний зв'язок:
N2 :N::N: N=N
Через це молекула азоту дуже міцна. Потрібно витратити велику кількість енергії на руйнування зв'язку, щоб почалася реакція. Тому молекулярний азот, як правило, вступає в хімічну взаємодію за високих температур.
Фосфор хімічно активніший, ніж азот. Хімічна активність фосфору залежить від алотропної форми. Так, найактивніший білий фосфор. Ви знаєте, що він легко окислюється на повітрі і світиться в темряві, може самовільно спалахувати. Червоний фосфор менш активний. Він окислюєтьсмя під час нагрівання. Ще менш активний — чорний фосфор.
У рівняннях хімічних реакцій білий фосфор звичайно позначають формулою Р4, що відповідає складу його молекули. Червона і чорна алотропні форми фосфору позначаються символом Р. Такий самий символ використовують, коли форма невідома або може бути будь-якою. Це хімічна формула фосфору умовна для всіх його алотропних форм.
Оскільки Нітроген і Фосфор у сполуках можуть виявляти як позитивний, так і негативний ступені окиснення, їхні прості речовини в реакціях можуть бути як окисниками, так і відновниками. Азот і фосфор поводяться як окисники відносно найактивніших металів і водню. При цьому
0 +6e -3 0 +3e -З
N2 → 2N Р → Р
1. Взаємодія з металами. Азот і фосфор під час нагрівання реагують з багатьма металами, утворюючи відповідно нітриди і фосфіди.
3Mg + N2 = Mg3N2
3Mg + 2P = Mg3P2
Лише з літієм азот реагує за звичайної температури, утворюючи нітрид літію:
6Li + N2 = 2Li3N
2. Взаємодія з неметалами: а) з воднем азот сполучається за наявності каталізатора, високих тиску і температури, утворюючи аміак:
N2 + ЗН2 ⇔ 2NH3,
а фосфор з воднем практично не взаємодіє;
б) з киснем азот сполучається за температури електричної дуги, понад 2000 °С, утворюючи оксид нітрогену (ІІ):
N2 + 02 ⇔ 2NO
Фосфор енергійно взаємодіє з киснем. Якщо його підпалити, він згоряє в кисні сліпучим яскравим полум'ям, утворюючи оксид фосфору(V):
4Р + 502 = 2Р205
Під час повільного окиснення утворюється оксид фосфору(ІІІ):
4Р + 302 = 2Р203
Застосування. Азот у великих кількостях використовується для добування аміаку і для наповнення електроламп (інертне середовище).
Білий фосфор широкого застосування не має. Його використовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину, а також для утворення димових завіс.
Червоний фосфор використовується для виробництві сірників.
У 1831 р. французький винахідник сірників Шарль Соріа почав застосовувати білий фосфор для виготовлення сірникових головок. Такі сірники легко займалися піц час тертя об будь-яку поверхню, але були отруйними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились.
Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до складу намазки, що наноситься на коробку (разом із сульфідом стибію () І Sb2S3, залізним суриком Fe203, домішкою кварцу SiQ2 і клею). Головнії сірників складаються, головним чином, з бертолетової солі КС103, моло- 1 того скла, сірки та клею. Під час тертя головки по намазці сірникової І коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
Крім виробництва сірників, фосфор застосовують у ' металургії. Використовують його і для виготовлення напів¬провідників, фосфорорганічних препаратів—засобів зни¬щення комах —шкідників сільськогосподарських рослин.
Завдання для самоконтролю
65. Запишіть рівняння реакцій, які характеризують хімічні властивості азоту і фосфору. Яка з цих речовин хімічно активніша і чому?
66. На кальцій кількістю речовини 1,5 моль за високої темпе ратури подіяли азотом кількістю речовини 1 моль. Які речовини в якій кількості можна виявити після закінчення реакції? 46
й7 Обчисліть, чи вистачить 100 л кисню (н. у.) для спалюван¬ім г фосфору. *"* (Я 3 5 т фосфату кальцію, якщо вихід продукту становить «І від теоретичного, можна добути фосфор масою
90'^
(б) 2 т;
(г) 0,4 т.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Що собою являє озон за звичайних умов? З якою метою він застосовується?
2. Які хімічні властивості характерні для кисню і сірки? Наведіть рівняння відповідних реакцій.
3. Порівняйте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?
4. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль відіграє сірка в одній і в другій реакціях?
5. Який тип хімічного зв'язку у сполуках Сульфуру з металами?
6. Чому кисень виявляє окисні властивості, а сірка, як окисні, так і відновні?
7. Наведіть кілька прикладів рівнянь реакцій, які засвідчують, що у кисню окисні властивості виявляються сильніше, ніж у
сірки.
8. Якщо 31 г заліза взаємодіє з сіркою за умови, що масова частка використання заліза становить 90 %, то в результаті реакції утворюється сульфід феруму масою
(а) ~ 12 г; (в) ~ 44 г;
(б) ~ 22 г; (г) ~ 88 г.
9. Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів Оксигену і Полонію різко відрізняються один від одного за властивостями. Як ви гадаєте, чим це можна пояснити?
10. Якого типу кристалічні гратки в азоту? На підставі яких фізичних властивостей азоту можна про це робити висновок?
11. Доведіть розрахунком, що азот трохи легший за повітря.
12. Обчисліть густину азоту за воднем.
13. Що таке алотропія? Схарактеризуйте найголовніші алотропні форми Фосфору. Розкрийте причину відмінності їхніх властивостей.
14. Як ви гадаєте, чому азот — газ, а фосфор — тверда речовина?
15. Порівняйте алотропію Оксигену і Фосфору. Що тут спільного і в чому відмінність?
16. Розкрийте фізіологічну роль Нітрогену і Фосфору.
17. У якому вигляді Нітроген і Фосфор зустрічаються в природі і чому?
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Вислано читачами з інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











