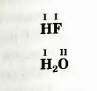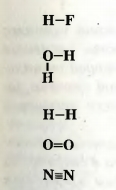|
|
|
| Строка 3: |
Строка 3: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Валентность химических элементов. На досуге. «Конструируем» молекулы<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Валентность химических элементов. На досуге. «Конструируем» молекулы<br> ''' |
| | | | |
| - | <br> Тут будет текст | + | <br> '''Валентность химических элементов'''<br><br><u>'''Материал параграфа поможет вам:'''</u><br> |
| | | | |
| | + | ''> выяснить, что такое валентность элемента;<br>> прогнозировать возможные значения валентности элемента, исходя из его размещения в периодической системе;<br>> определять значения валентности элементов в бинарных соединениях по их формулам;<br>> составлять формулы бинарных соединений, исходя из значений валентности элементов.''<br><br><u>'''Валентность.'''</u><br> |
| | | | |
| | + | Числовые индексы в химических формулах указывают на то, что атомы соединяются друг с другом не произвольно, а в определенных соотношениях.<br> |
| | | | |
| - | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' | + | Способность атома соединяться с определенным количеством таких же или других атомов называют валентностью. <br> |
| | + | |
| | + | Валентность является важным свойством атома. Ее определяют исходя из того, сколько атомов присоединяет данный атом и каким элементам они принадлежат.<br> |
| | + | |
| | + | Значение валентности атома Гидрогена принято считать равным I. Этот атом всегда соединяется только с одним атомом. В результате образуются, например, молекулы водорода H<sub>2</sub>, фтороводорода HF, воды H<sub>2</sub>O:<br> |
| | + | |
| | + | <br>[[Image:18.09-028.jpg]]<br><br>''Гидроген — одновалентный элемент.''<br> |
| | + | |
| | + | В молекуле фтороводорода HF атом Флуора связан с атомом Гидрогена. Поэтому значение валентности Флуора, как и Гидрогена, равно I.<br> |
| | + | |
| | + | Атом Оксигена удерживает в молекуле воды H<sub>2</sub>O два атома Гидрогена. Отсюда вывод: Оксиген двухвалентный элемент. <br> |
| | + | |
| | + | ''<sup>1</sup> Термин происходит от латинского слова valentia — сила.''<br> |
| | + | |
| | + | <br>[[Image:18.09-029.jpg]]<br> |
| | + | |
| | + | [[Image:18.09-031.jpg]]<br><br>Такую валентность Оксиген проявляет всегда — и в молекуле простого вещества (O<sub>2</sub>), и в молекулах сложных веществ.<br> |
| | + | |
| | + | Значение валентности элемента при необходимости указывают в химической формуле римской цифрой над его символом:[[Image:18.09-030.jpg]] В математических расчетах и тексте для этого используют арабские цифры.<br> |
| | + | |
| | + | ► Определите валентность элементов в молекулах аммиака NH<sub>3</sub> и метана CH<sub>4</sub>.<br> |
| | + | |
| | + | Сведения о валентности элементов в веществе можно представить другим способом. Сначала записывают на определенном расстоянии друг от друга символы каждого атома, находящегося в молекуле. Затем одновалентный атом соединяют с другим одной черточкой, от двухвалентного атома проводят две черточки и т. д.:<br><br>[[Image:18.09-032.jpg]]<br><br>Такие формулы называют графическими. Они показывают порядок соединения атомов в молекулах.<br> |
| | + | |
| | + | Молекула простого вещества водорода имеет графическую формулу H-H. Аналогичными являются графические формулы молекул фтора, хлора, брома, иода. Графическая формула молекулы кислорода 0=0, а молекулы азота [[Image:18.09-033.jpg]].<br> |
| | + | |
| | + | Составляя такие формулы для молекул сложных веществ, следует иметь в виду, что атомы одного элемента, как правило, не соединены между собой.<br> |
| | + | |
| | + | ► Изобразите графические формулы молекул аммиака и метана.<br> |
| | + | |
| | + | Из графической формулы молекулы легко определить валентность каждого атома. Значение валентности равно количеству черточек, которые исходят от атома.<br> |
| | + | |
| | + | Для соединений ионного и атомного строения графические формулы не используют.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | <u>'''Валентность элемента и его размещение в периодической системе. '''</u><br> |
| | + | |
| | + | Некоторые элементы имеют постоянную валентность. <br><br><u>'''Это интересно'''</u><br> |
| | + | |
| | + | В начале XIX в. во взглядах на состав химических соединений господствовал<br>принцип «наибольшей простоты». Так, формулу воды записывали HO, а не H<sub>2</sub>O.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Гидроген и Флуор всегда одновалентны, а Оксиген — двухвалентен. Другие элементы с постоянной валентностью находятся в I—III группах периодической системы, причем значение валентности каждого элемента совпадает с номером группы. Так, элемент I группы Литий одновалентен, элемент II группы Магний двухвалентен, а элемент III группы Бор трехвалентен. Исключениями являются элементы I группы Купрум (значения валентности — I и 2) и Аурум (I и 3).<br> |
| | + | |
| | + | Большинство элементов имеют переменную валентность. Приводим ее значения для некоторых из них:<br> |
| | + | |
| | + | Плюмбум (IV группа) — 2,4;<br>Фосфор (V группа) — 3,5;<br>Хром (VI группа) — 2, 3, 6;<br>Сульфур (VI группа) — 2, 4, 6;<br>Манган (VII группа) — 2, 4, 6, 7;<br>Хлор (VII группа) — I, 3, 5, 7.<br> |
| | + | |
| | + | Из этих сведений вытекает важное правило: максимальное значение валентности элемента совпадает с номером группы, в которой он находится1. Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от I до 8.<br> |
| | + | |
| | + | Существует еще одно правило: значение валентности неметаллического элемента в соединении с Гидрогеном или с металлическим элементом равно 8 минус номер группы, в которой размещен элемент. Подтвердим его примерами соединений элементов с Гидрогеном. Элемент VII группы Иод в иодоводороде HI одновалентен (8-7=1), элемент VI группы Оксиген в воде H<sub>2</sub>O двухвалентен (8 - 6 = 2), элемент V группы Нитроген в аммиаке <br>NH3 трехвалентен (8 - 5 = 3).<br><u>'''<br>Определение валентности элементов в бинарном соединении по его формуле.'''</u><br> |
| | + | |
| | + | Бинарным<sup>2</sup> называют соединение, образованное двумя элементами .<br><br>''<sup>1</sup> Существует несколько исключений.<br><sup>2</sup> Термин происходит от латинского слова binarius — двойной; состоящий из двух частей.''<br><br><u>'''Это интересно'''</u> |
| | + | |
| | + | Формулы соединений, образованных тремя и более элементами, составляют иначе. |
| | + | |
| | + | Выяснить значение валентности элемента в соединении нужно тогда, когда элемент имеет переменную валентность. Как выполняют такое задание, покажем на примере. |
| | + | |
| | + | Найдем значение валентности Иода в его соединении с Оксигеном, которое имеет формулу I<sub>2</sub>O<sub>5</sub>.<br><br>Вы знаете, что Оксиген — двухвалентный элемент. Запишем значение его валентности над символом этого элемента в химической формуле соединения: I<sub>2</sub>O<sub>5</sub>. На 5 атомов Оксигена приходится 2 * 5 = 10 единиц валентности. Их нужно «распределить» между двумя атомами Иода (10 : 2 = 5). Из этого следует, что Иод в соединении пятивалентен. |
| | + | |
| | + | Формула соединения с обозначением валентности [[Image:18.09-034.jpg]] элементов — [[Image:18.09-037.jpg]] |
| | + | |
| | + | ► Определите валентность элементов в соединениях с формулами CO<sub>2</sub> и Cl<sub>2</sub>O<sub>7</sub>. |
| | + | |
| | + | Составление химических формул соединений по валентности элементов. |
| | + | |
| | + | Выполним задание, противоположное предыдущему, — составим химическую формулу соединения Сульфура с Оксигеном, в котором Сульфур шестивалентен. |
| | + | |
| | + | Сначала запишем символы элементов, образующих соединение, и укажем над ними значения валентности: [[Image:18.09-035.jpg]] . Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: [[Image:18.09-036.jpg]].<br><br>Для проверки химической формулы используют правило: произведения значений валентности каждого элемента на количество его атомов в формуле одинаковы. Эти произведения для только что выведенной химической формулы: 6 -1 = 2-3. |
| | + | |
| | + | Запомните, что в формулах соединений, в том числе бинарных, сначала записывают символы металлических элементов, а потом — неметаллических. Если соединение образовано только неметаллическими элементами и среди них есть Оксиген или Флуор, то эти элементы записывают последними.<br><br><u>'''Это интересно'''</u> |
| | + | |
| | + | Порядок записи элементов в формуле соединения Оксигена с Флуором такой: OF<sub>2</sub>. |
| | + | |
| | + | <br>► Составьте химические формулы соединений Бора с Флуором и Оксигеном. |
| | + | |
| | + | Причины соединения атомов друг с другом и объяснение значений валентности элементов связаны со строением атомов. Этот материал будет рассмотрен в 8 классе.<br><br><u>'''Выводы'''</u> |
| | + | |
| | + | Валентность — это способность атома соединяться с определенным количеством таких же или других атомов. |
| | + | |
| | + | Существуют элементы с постоянной и переменной валентностью. Гидроген и Флуор всегда одновалентны, Оксиген — двухвалентен. |
| | + | |
| | + | Значения валентности элементов отражают в графических формулах молекул соответствующим количеством черточек возле атомов. |
| | + | |
| | + | Произведения значений валентности каждого элемента на количество его атомов в формуле бинарного соединения одинаковы.<br><br>'''?'''<br>''75. Что такое валентность? Назовите максимальное и минимальное значения валентности химических элементов.'' |
| | + | |
| | + | ''76. Укажите символы элементов, имеющих постоянную валентность: К, Ca, Cu, Cl, Zn, F, Н.<br><br>77. Определите валентность всех элементов в соединениях, которые имеют такие формулы: [[Image:18.09-038.jpg]]'' |
| | + | |
| | + | ''78. Определите валентность элементов в соединениях с такими формулами: <br>a) BaH<sub>2</sub>, V<sub>2</sub>O<sub>5</sub>, MoS<sub>3</sub>, SiF<sub>4</sub>, Li<sub>3</sub>P; б) CuS, TiCI<sub>4</sub>, Ca<sub>3</sub>N<sub>2</sub>, P<sub>2</sub>O<sub>3</sub>, Mn<sub>2</sub>O<sub>7</sub>.'' |
| | + | |
| | + | ''79. Составьте формулы соединений, образованных элементами с постоянной валентностью: Na...H..., Ba...F..., Al...О..., AI...F....'' |
| | + | |
| | + | ''80. Составьте формулы соединений, используя указанные валентности некоторых элементов:<br>[[Image:18.09-039.jpg]]<br><br>81. Напишите формулы соединений с Оксигеном таких элементов: а) Лития; б) Магния; в) Осмия (проявляет валентность 4 и 8).'' |
| | + | |
| | + | ''82. Изобразите графические формулы молекул CI<sub>2</sub>O, PH<sub>3</sub>, SO<sub>3</sub>.'' |
| | + | |
| | + | ''83. Определите валентность элементов по графическим формулам молекул:'' |
| | + | |
| | + | [[Image:18.09-040.jpg]]<br><br>'''На досуге'''<br><br><u>'''«Конструируем» молекулы'''</u><br> |
| | + | |
| | + | [[Image:18.09-041.jpg]]<br>''Рис. 45. Модель молекулы метана CH<sub>4</sub> ''<br><br>По графическим формулам можно изготовлять модели молекул (рис. 45). Самым удобным материалом для этого является пластилин. Из него делают шарикиатомы (для атомов различных элементов используют пластилин разного цвета). Шарики соединяют с помощью спичек; каждая спичка заменяет одну черточку в графической формуле молекулы. |
| | + | |
| | + | Изготовьте модели молекул H<sub>2</sub>, O<sub>2</sub>, H<sub>2</sub>O (имеет угловую форму), NH3 (имеет форму пирамиды), CO<sub>2</sub> (имеет линейную форму). |
| | + | |
| | + | <br> |
| | + | |
| | + | ''Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.'' |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
Версия 13:19, 18 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Валентность химических элементов. На досуге. «Конструируем» молекулы
Валентность химических элементов
Материал параграфа поможет вам:
> выяснить, что такое валентность элемента;
> прогнозировать возможные значения валентности элемента, исходя из его размещения в периодической системе;
> определять значения валентности элементов в бинарных соединениях по их формулам;
> составлять формулы бинарных соединений, исходя из значений валентности элементов.
Валентность.
Числовые индексы в химических формулах указывают на то, что атомы соединяются друг с другом не произвольно, а в определенных соотношениях.
Способность атома соединяться с определенным количеством таких же или других атомов называют валентностью.
Валентность является важным свойством атома. Ее определяют исходя из того, сколько атомов присоединяет данный атом и каким элементам они принадлежат.
Значение валентности атома Гидрогена принято считать равным I. Этот атом всегда соединяется только с одним атомом. В результате образуются, например, молекулы водорода H2, фтороводорода HF, воды H2O:

Гидроген — одновалентный элемент.
В молекуле фтороводорода HF атом Флуора связан с атомом Гидрогена. Поэтому значение валентности Флуора, как и Гидрогена, равно I.
Атом Оксигена удерживает в молекуле воды H2O два атома Гидрогена. Отсюда вывод: Оксиген двухвалентный элемент.
1 Термин происходит от латинского слова valentia — сила.
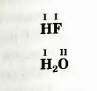
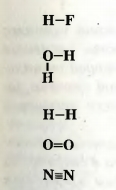
Такую валентность Оксиген проявляет всегда — и в молекуле простого вещества (O2), и в молекулах сложных веществ.
Значение валентности элемента при необходимости указывают в химической формуле римской цифрой над его символом: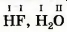 В математических расчетах и тексте для этого используют арабские цифры. В математических расчетах и тексте для этого используют арабские цифры.
► Определите валентность элементов в молекулах аммиака NH3 и метана CH4.
Сведения о валентности элементов в веществе можно представить другим способом. Сначала записывают на определенном расстоянии друг от друга символы каждого атома, находящегося в молекуле. Затем одновалентный атом соединяют с другим одной черточкой, от двухвалентного атома проводят две черточки и т. д.:
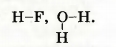
Такие формулы называют графическими. Они показывают порядок соединения атомов в молекулах.
Молекула простого вещества водорода имеет графическую формулу H-H. Аналогичными являются графические формулы молекул фтора, хлора, брома, иода. Графическая формула молекулы кислорода 0=0, а молекулы азота 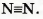 . .
Составляя такие формулы для молекул сложных веществ, следует иметь в виду, что атомы одного элемента, как правило, не соединены между собой.
► Изобразите графические формулы молекул аммиака и метана.
Из графической формулы молекулы легко определить валентность каждого атома. Значение валентности равно количеству черточек, которые исходят от атома.
Для соединений ионного и атомного строения графические формулы не используют.
Валентность элемента и его размещение в периодической системе.
Некоторые элементы имеют постоянную валентность.
Это интересно
В начале XIX в. во взглядах на состав химических соединений господствовал
принцип «наибольшей простоты». Так, формулу воды записывали HO, а не H2O.
Гидроген и Флуор всегда одновалентны, а Оксиген — двухвалентен. Другие элементы с постоянной валентностью находятся в I—III группах периодической системы, причем значение валентности каждого элемента совпадает с номером группы. Так, элемент I группы Литий одновалентен, элемент II группы Магний двухвалентен, а элемент III группы Бор трехвалентен. Исключениями являются элементы I группы Купрум (значения валентности — I и 2) и Аурум (I и 3).
Большинство элементов имеют переменную валентность. Приводим ее значения для некоторых из них:
Плюмбум (IV группа) — 2,4;
Фосфор (V группа) — 3,5;
Хром (VI группа) — 2, 3, 6;
Сульфур (VI группа) — 2, 4, 6;
Манган (VII группа) — 2, 4, 6, 7;
Хлор (VII группа) — I, 3, 5, 7.
Из этих сведений вытекает важное правило: максимальное значение валентности элемента совпадает с номером группы, в которой он находится1. Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от I до 8.
Существует еще одно правило: значение валентности неметаллического элемента в соединении с Гидрогеном или с металлическим элементом равно 8 минус номер группы, в которой размещен элемент. Подтвердим его примерами соединений элементов с Гидрогеном. Элемент VII группы Иод в иодоводороде HI одновалентен (8-7=1), элемент VI группы Оксиген в воде H2O двухвалентен (8 - 6 = 2), элемент V группы Нитроген в аммиаке
NH3 трехвалентен (8 - 5 = 3).
Определение валентности элементов в бинарном соединении по его формуле.
Бинарным2 называют соединение, образованное двумя элементами .
1 Существует несколько исключений.
2 Термин происходит от латинского слова binarius — двойной; состоящий из двух частей.
Это интересно
Формулы соединений, образованных тремя и более элементами, составляют иначе.
Выяснить значение валентности элемента в соединении нужно тогда, когда элемент имеет переменную валентность. Как выполняют такое задание, покажем на примере.
Найдем значение валентности Иода в его соединении с Оксигеном, которое имеет формулу I2O5.
Вы знаете, что Оксиген — двухвалентный элемент. Запишем значение его валентности над символом этого элемента в химической формуле соединения: I2O5. На 5 атомов Оксигена приходится 2 * 5 = 10 единиц валентности. Их нужно «распределить» между двумя атомами Иода (10 : 2 = 5). Из этого следует, что Иод в соединении пятивалентен.
Формула соединения с обозначением валентности 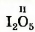 элементов — элементов — 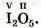
► Определите валентность элементов в соединениях с формулами CO2 и Cl2O7.
Составление химических формул соединений по валентности элементов.
Выполним задание, противоположное предыдущему, — составим химическую формулу соединения Сульфура с Оксигеном, в котором Сульфур шестивалентен.
Сначала запишем символы элементов, образующих соединение, и укажем над ними значения валентности:  . Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: . Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: 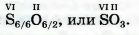 . .
Для проверки химической формулы используют правило: произведения значений валентности каждого элемента на количество его атомов в формуле одинаковы. Эти произведения для только что выведенной химической формулы: 6 -1 = 2-3.
Запомните, что в формулах соединений, в том числе бинарных, сначала записывают символы металлических элементов, а потом — неметаллических. Если соединение образовано только неметаллическими элементами и среди них есть Оксиген или Флуор, то эти элементы записывают последними.
Это интересно
Порядок записи элементов в формуле соединения Оксигена с Флуором такой: OF2.
► Составьте химические формулы соединений Бора с Флуором и Оксигеном.
Причины соединения атомов друг с другом и объяснение значений валентности элементов связаны со строением атомов. Этот материал будет рассмотрен в 8 классе.
Выводы
Валентность — это способность атома соединяться с определенным количеством таких же или других атомов.
Существуют элементы с постоянной и переменной валентностью. Гидроген и Флуор всегда одновалентны, Оксиген — двухвалентен.
Значения валентности элементов отражают в графических формулах молекул соответствующим количеством черточек возле атомов.
Произведения значений валентности каждого элемента на количество его атомов в формуле бинарного соединения одинаковы.
?
75. Что такое валентность? Назовите максимальное и минимальное значения валентности химических элементов.
76. Укажите символы элементов, имеющих постоянную валентность: К, Ca, Cu, Cl, Zn, F, Н.
77. Определите валентность всех элементов в соединениях, которые имеют такие формулы: 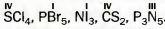
78. Определите валентность элементов в соединениях с такими формулами:
a) BaH2, V2O5, MoS3, SiF4, Li3P; б) CuS, TiCI4, Ca3N2, P2O3, Mn2O7.
79. Составьте формулы соединений, образованных элементами с постоянной валентностью: Na...H..., Ba...F..., Al...О..., AI...F....
80. Составьте формулы соединений, используя указанные валентности некоторых элементов:
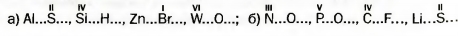
81. Напишите формулы соединений с Оксигеном таких элементов: а) Лития; б) Магния; в) Осмия (проявляет валентность 4 и 8).
82. Изобразите графические формулы молекул CI2O, PH3, SO3.
83. Определите валентность элементов по графическим формулам молекул:
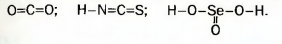
На досуге
«Конструируем» молекулы
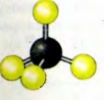
Рис. 45. Модель молекулы метана CH4
По графическим формулам можно изготовлять модели молекул (рис. 45). Самым удобным материалом для этого является пластилин. Из него делают шарикиатомы (для атомов различных элементов используют пластилин разного цвета). Шарики соединяют с помощью спичек; каждая спичка заменяет одну черточку в графической формуле молекулы.
Изготовьте модели молекул H2, O2, H2O (имеет угловую форму), NH3 (имеет форму пирамиды), CO2 (имеет линейную форму).
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|