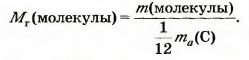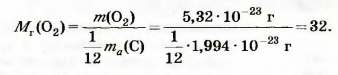|
|
|
| Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Относительная молекулярная, и относительная формульная массы</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Химия, 7 класс, Относительная молекулярная, и относительная формульная массы, атомная масса, молекулы, ионов, атома, Формулами, Оксиген</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Относительная молекулярная и относительная формульная массы<br> ''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 7 класс|Химия 7 класс]]>> Относительная молекулярная и относительная формульная массы<br> ''' |
| Строка 5: |
Строка 5: |
| | <br> '''Относительная молекулярная и относительная формульная массы<br><br><u>Материал параграфа поможет вам</u>:''' | | <br> '''Относительная молекулярная и относительная формульная массы<br><br><u>Материал параграфа поможет вам</u>:''' |
| | | | |
| - | ''> выяснить, что такое относительная молекулярная масса и относительная формульная масса;<br>> правильно вычислять относительные молекулярные и формульные массы.''<br><br>Относительная молекулярная масса. Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами. | + | ''> выяснить, что такое относительная [[Відносна молекулярна маса речовини, її обчислення за хiмічною формулою|'''молекулярная масса''']] и относительная формульная масса;<br>> правильно вычислять относительные молекулярные и формульные массы.''<br><br><u>'''Относительная молекулярная масса.'''</u> |
| | + | |
| | + | Массы молекул, как и атомов, чрезвычайно малы. Поэтому в [http://xvatit.com/vuzi/ '''химии'''] используют относительные массы молекул. Их еще называют относительными молекулярными массами. |
| | | | |
| | '''Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.''' | | '''Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.''' |
| | | | |
| - | Относительную молекулярную массу сокращенно обозначают M<sub>r</sub>. Эта величина, как и относительная атомная масса, не имеет размерности. <br><br>Математическая формула для ее вычисления, исходя из массы молекулы: | + | Относительную молекулярную массу сокращенно обозначают M<sub>r</sub>. Эта величина, как и относительная [[Атомна одиниця маси. Відносна атомна маса хімічних елементів|'''атомная масса''']], не имеет размерности. <br><br>Математическая формула для ее вычисления, исходя из массы молекулы: |
| | | | |
| - | [[Image:18.09-042.jpg]]<br> | + | [[Image:18.09-042.jpg|240px|Формула]]<br> |
| | | | |
| - | Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10<sup>-23</sup> г) и атома Карбона (1,994 • 10<sup>-23</sup> г):<br><br>[[Image:18.09-043.jpg]]<br><br>Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы. | + | Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10<sup>-23</sup> г) и атома Карбона (1,994 • 10<sup>-23</sup> г):<br><br>[[Image:18.09-043.jpg|320px|Формула]]<br><br>Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы. |
| | | | |
| - | Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав. | + | Относительная масса [[Тема 34. Тіла, речовини , молекули|'''молекулы''']] равна сумме относительных масс атомов, которые входят в ее состав. |
| | | | |
| | Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:<br><br>'''M<sub>r</sub>(O<sub>2</sub>) = 2А<sub>r</sub>(0) = 2 • 16 = 32;''' | | Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:<br><br>'''M<sub>r</sub>(O<sub>2</sub>) = 2А<sub>r</sub>(0) = 2 • 16 = 32;''' |
| Строка 23: |
Строка 25: |
| | Наименьшую массу имеют ионы Гидрогена H<sup>+</sup> и H<sup>-</sup> .<br><br><u>'''Относительная формульная масса.'''</u> | | Наименьшую массу имеют ионы Гидрогена H<sup>+</sup> и H<sup>-</sup> .<br><br><u>'''Относительная формульная масса.'''</u> |
| | | | |
| - | Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу. | + | Для [[Ілюстрації до теми «Будова атома. Електрон. Йон»|'''ионов''']], а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу. |
| | | | |
| - | Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:<br><br>'''M<sub>r</sub>(K<sup>+</sup>) = A<sub>r</sub>(K); M<sub>r</sub>(O<sup>2- </sup> ) = A<sub>r</sub>(O).'''<br><br>Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:<br><br>'''M<sub>r</sub>(CO<sup>2-</sup><sub>3</sub> ) =A<sub>r</sub> (C ) + ЗА<sub>r</sub>(0) = 12 + 3 • 16 = 60.'''<br><br>► Вычислите относительные формульные массы ионов NH<sup>+</sup><sub>4</sub> и NO<sup>-</sup><sub>2</sub>.<br><br><u>'''Это интересно'''</u> | + | Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы '''[[42. Будова атома: ядро і електронна оболонка. Склад атомних ядер. Протонне число. Нуклонне число. Сучасне формулювання періодичного закону|атома]]'''. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:<br><br>'''M<sub>r</sub>(K<sup>+</sup>) = A<sub>r</sub>(K); M<sub>r</sub>(O<sup>2- </sup> ) = A<sub>r</sub>(O).'''<br><br>Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:<br><br>'''M<sub>r</sub>(CO<sup>2-</sup><sub>3</sub> ) =A<sub>r</sub> (C ) + ЗА<sub>r</sub>(0) = 12 + 3 • 16 = 60.'''<br><br>► Вычислите относительные формульные массы ионов NH<sup>+</sup><sub>4</sub> и NO<sup>-</sup><sub>2</sub>.<br><br><u>'''Это интересно'''</u> |
| | | | |
| - | Значение относительной формульной массы 100 имеют соединения с Формулами | + | Значение относительной формульной массы 100 имеют соединения с '''[[Хімічні формули речовин. Повні уроки|Формулами]]''' |
| | | | |
| | '''C<sub>r</sub>O<sub>3</sub>, Mg<sub>3</sub>N<sub>2</sub>, CaCO<sub>3</sub>.'''<br><br>Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:<br>'''<br>M<sub>r</sub>(NaCl) =A <sub>r</sub>(Na) +A<sub>r</sub>(Cl) = 23 + 35,5 = 58,5.'''<br><br>В качестве другого примера возьмем алюминий сульфат Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>. Это соединение состоит из простых ионов Al<sub>3</sub><sup>+</sup> и сложных ионов SO<sub>4</sub><sup>-</sup> . | | '''C<sub>r</sub>O<sub>3</sub>, Mg<sub>3</sub>N<sub>2</sub>, CaCO<sub>3</sub>.'''<br><br>Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:<br>'''<br>M<sub>r</sub>(NaCl) =A <sub>r</sub>(Na) +A<sub>r</sub>(Cl) = 23 + 35,5 = 58,5.'''<br><br>В качестве другого примера возьмем алюминий сульфат Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>. Это соединение состоит из простых ионов Al<sub>3</sub><sup>+</sup> и сложных ионов SO<sub>4</sub><sup>-</sup> . |
| | | | |
| - | Относительную формульную массу соединения можно вычислить двумя способами. | + | Относительную формульную массу соединения можно вычислить двумя способами. |
| | | | |
| - | '''''1 способ.''''' Используем относительные атомные массы:<br><br>'''M<sub>r</sub>[Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>] = 2A<sub>r</sub>(Al) + 3A<sub>r</sub>(S) + 3 • 4А<sub>r</sub>(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.'''<br><br>'''''2 способ'''''. Используем относительные формульные массы ионов:<br>'''<br>M<sub>r</sub>(Al<sup>3+</sup>) =A <sub>r</sub>(Al) =27;''' | + | '''''1 способ.''''' Используем относительные атомные массы:<br><br>'''M<sub>r</sub>[Al<sub>2</sub>(SO<sub>4</sub>)<sub>3</sub>] = 2A<sub>r</sub>(Al) + 3A<sub>r</sub>(S) + 3 • 4А<sub>r</sub>(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.'''<br><br>'''''2 способ'''''. Используем относительные формульные массы ионов:<br>'''<br>M<sub>r</sub>(Al<sup>3+</sup>) =A <sub>r</sub>(Al) =27;''' |
| | | | |
| - | '''M<sub>r</sub>(SO<sup>2-</sup><sub>4</sub>) = A<sub>r</sub>(S) + 4Аr(0) = 32 + 4 • 16 = 96;''' | + | '''M<sub>r</sub>(SO<sup>2-</sup><sub>4</sub>) = A<sub>r</sub>(S) + 4Аr(0) = 32 + 4 • 16 = 96;''' |
| | | | |
| - | '''M<sub>r</sub>[Al<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>] = 2M<sub>r</sub>(Al<sup>3+</sup>) + 3Mr(S0<sup>2-</sup><sub>4</sub> ) = 2 • 27 + 3 • 96 = 342.'''<br><br>Относительная формульная масса — это относительная масса формульной единицы вещества. | + | '''M<sub>r</sub>[Al<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>] = 2M<sub>r</sub>(Al<sup>3+</sup>) + 3Mr(S0<sup>2-</sup><sub>4</sub> ) = 2 • 27 + 3 • 96 = 342.'''<br><br>Относительная формульная масса — это относительная масса формульной единицы '''[[Відео до уроку: Речовини. Чисті речовини і суміші|вещества]]'''. |
| | | | |
| - | Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.<br><u>'''<br>Выводы'''</u> | + | Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.<br><u>'''<br>Выводы'''</u> |
| | | | |
| - | Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы. | + | Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы. |
| | | | |
| - | Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.<br><br>?<br>84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы? | + | Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.<br><br>'''?'''<br>''84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы?'' |
| | | | |
| - | 85. У какого вещества наименьшая относительная молекулярная масса? | + | ''85. У какого вещества наименьшая относительная молекулярная масса?'' |
| | | | |
| - | 86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы: | + | ''86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы:'' |
| | | | |
| - | '''a) Cl<sub>2</sub>, O<sub>3</sub>, P<sub>4</sub>; б) CO, H<sub>2</sub>S, H<sub>3</sub>PO<sub>4</sub>.'''<br><br>87. Рассчитайте относительные формульные массы веществ с такими формулами: | + | '''''a) Cl<sub>2</sub>, O<sub>3</sub>, P<sub>4</sub>; б) CO, H<sub>2</sub>S, H<sub>3</sub>PO<sub>4</sub>.'''<br><br>87. Рассчитайте относительные формульные массы веществ с такими формулами: '' |
| | | | |
| - | '''a) CaH<sub>2</sub>, AIH<sub>3</sub>; б) Li<sub>2</sub>O, MgO; в) Cu(OH)<sub>2</sub>, (NH<sub>4</sub> )<sub>2</sub>S.'''<br><br>88. Во сколько раз масса атома Оксигена больше или меньше массы: | + | '''''a) CaH<sub>2</sub>, AIH<sub>3</sub>; б) Li<sub>2</sub>O, MgO; в) Cu(OH)<sub>2</sub>, (NH<sub>4</sub> )<sub>2</sub>S.'''<br><br>88. Во сколько раз масса атома Оксигена больше или меньше массы:'' |
| | | | |
| - | а) молекулы водорода; б) молекулы метана CH<sub>4</sub>; в) иона Купрума Cu<sup>2+</sup>; г) иона '''S0<sup>2-</sup><sub>4</sub>'''? Попробуйте выполнить расчеты устно. | + | ''а) молекулы водорода; б) молекулы метана CH<sub>4</sub>; в) иона Купрума Cu<sup>2+</sup>; г) иона '''S0<sup>2-</sup><sub>4</sub>'''? Попробуйте выполнить расчеты устно.'' |
| | | | |
| - | 89. Относительная молекулярная масса соединения Хлора с Оксигеном равна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества? | + | ''89. Относительная молекулярная масса соединения Хлора с ''[[Відео до уроку: Поширеність та колообіг Оксигену в природі. Застосування кисню, його біологічна роль|'''''Оксигеном''''']]''равна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества?'' |
| | | | |
| - | 90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения. | + | ''90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения.'' |
| | | | |
| - | 91. Масса молекулы воды равна 3 • 10<sup>-23</sup> г, а атома Карбона — 2 • 10<sup>-23 </sup>г. | + | ''91. Масса молекулы воды равна 3 • 10<sup>-23</sup> г, а атома Карбона — 2 • 10<sup>-23 </sup>г. '' |
| | | | |
| - | Вычислите по этим данным относительную молекулярную массу воды.<br> | + | ''Вычислите по этим данным относительную молекулярную массу воды.''<br> |
| | | | |
| | <br> | | <br> |
Версия 14:37, 18 сентября 2012
Гипермаркет знаний>>Химия>>Химия 7 класс>> Относительная молекулярная и относительная формульная массы
Относительная молекулярная и относительная формульная массы
Материал параграфа поможет вам:
> выяснить, что такое относительная молекулярная масса и относительная формульная масса;
> правильно вычислять относительные молекулярные и формульные массы.
Относительная молекулярная масса.
Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами.
Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают Mr. Эта величина, как и относительная атомная масса, не имеет размерности.
Математическая формула для ее вычисления, исходя из массы молекулы:
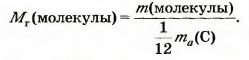
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10-23 г) и атома Карбона (1,994 • 10-23 г):
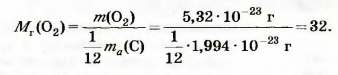
Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
Mr(O2) = 2Аr(0) = 2 • 16 = 32;
Mr(H2O) = 2Ar(H) +Ar(O) = 2 • I + 16 = 18.
► Вычислите относительные молекулярные массы азота N2 и аммиака NH3.
Это интересно
Наименьшую массу имеют ионы Гидрогена H+ и H- .
Относительная формульная масса.
Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу.
Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:
Mr(K+) = Ar(K); Mr(O2- ) = Ar(O).
Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:
Mr(CO2-3 ) =Ar (C ) + ЗАr(0) = 12 + 3 • 16 = 60.
► Вычислите относительные формульные массы ионов NH+4 и NO-2.
Это интересно
Значение относительной формульной массы 100 имеют соединения с Формулами
CrO3, Mg3N2, CaCO3.
Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:
Mr(NaCl) =A r(Na) +Ar(Cl) = 23 + 35,5 = 58,5.
В качестве другого примера возьмем алюминий сульфат Al2(SO4)3. Это соединение состоит из простых ионов Al3+ и сложных ионов SO4- .
Относительную формульную массу соединения можно вычислить двумя способами.
1 способ. Используем относительные атомные массы:
Mr[Al2(SO4)3] = 2Ar(Al) + 3Ar(S) + 3 • 4Аr(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.
2 способ. Используем относительные формульные массы ионов:
Mr(Al3+) =A r(Al) =27;
Mr(SO2-4) = Ar(S) + 4Аr(0) = 32 + 4 • 16 = 96;
Mr[Al2(S04)3] = 2Mr(Al3+) + 3Mr(S02-4 ) = 2 • 27 + 3 • 96 = 342.
Относительная формульная масса — это относительная масса формульной единицы вещества.
Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.
Выводы
Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.
?
84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы?
85. У какого вещества наименьшая относительная молекулярная масса?
86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы:
a) Cl2, O3, P4; б) CO, H2S, H3PO4.
87. Рассчитайте относительные формульные массы веществ с такими формулами:
a) CaH2, AIH3; б) Li2O, MgO; в) Cu(OH)2, (NH4 )2S.
88. Во сколько раз масса атома Оксигена больше или меньше массы:
а) молекулы водорода; б) молекулы метана CH4; в) иона Купрума Cu2+; г) иона S02-4? Попробуйте выполнить расчеты устно.
89. Относительная молекулярная масса соединения Хлора с Оксигеномравна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества?
90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения.
91. Масса молекулы воды равна 3 • 10-23 г, а атома Карбона — 2 • 10-23 г.
Вычислите по этим данным относительную молекулярную массу воды.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|