|
|
|
| Строка 5: |
Строка 5: |
| | <br> | | <br> |
| | | | |
| - | ''<u>Завдання</u>'' | + | ''<u>Застосуйте свої знання й уміння</u>'' |
| | | | |
| - | Виберіть ті пари електролітів, реакції між якими у розчині відбуваються практично до кінця (необоротно):<br> | + | 1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення: |
| | | | |
| - | А Н<sub>2</sub>S0<sub>4</sub> і К<sub>2</sub>С0<sub>3</sub>; Б Na<sub>2</sub>S і НСІ; В НNO<sub>3 </sub>і Na<sub>2</sub>S0<sub>4</sub>; Г KNO<sub>3 </sub>і НСІ.<br>
| + | A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;<br>Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;<br>В Числа молекул у розчині до числа молекул, які дисоціювали;<br>Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони. |
| | | | |
| - | Виконані досліди доводять, що реакції обміну між електролітами у розчині необоротні, якщо поміж продуктів реакції є осад, газ, вода або інший слабкий електроліт.<br>
| + | 2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони: |
| | | | |
| - | Якщо виконується хоча б одна з цих умов, реакція відбувається до кінця. Якщо ж ні, то внаслідок змішування розчинів утворюється суміш йонів. Про це свідчить повне йонне рівняння реакції між натрій хлоридом і калій нітратом у розчині<br>
| + | А 0,2; Б 20; В 0,02; Г 2. |
| | | | |
| - | Na<sup>+ </sup>+ Сl<sup>-</sup> + К<sup>+ </sup>+ N0<sup>-</sup><sub>3</sub> = Na<sup>+</sup> + NO<sup>-</sup>з+ К<sup>+</sup> + Сl<sup>-</sup>
| + | 3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %): |
| | | | |
| - | Аби дістати більше експериментальних підтверджень правильності зроблених висновків, виконайте лабораторні досліди.
| + | A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2. |
| | + | |
| | + | 4. Виберіть слабкі електроліти: А HCl; Б H<sub>2</sub>S; В Н<sub>2</sub>0; Г H<sub>2</sub>S0<sub>4</sub>. |
| | + | |
| | + | 5. Виберіть сильну кислоту: |
| | + | |
| | + | А Бромідна; Б Сульфідна; В Молочна; Г Силікатна. |
| | + | |
| | + | 6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві? |
| | + | |
| | + | 7.Встановіть відповідність між електролітами та ступенем дисоціації. |
| | + | |
| | + | {| cellspacing="1" cellpadding="1" border="1" width="400" |
| | + | |- |
| | + | | |
| | + | Електроліт |
| | + | |
| | + | 1 Сильний |
| | + | |
| | + | 2 Слабкий <br> |
| | | | |
| | <br> | | <br> |
| | + | |
| | + | | |
| | + | Ступінь дисоціації |
| | + | |
| | + | А а = 0 |
| | + | |
| | + | Б а → 1 |
| | + | |
| | + | В 0 < а < 0,03 |
| | + | |
| | + | |} |
| | + | |
| | + | 8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот. |
| | + | |
| | + | [[Image:Chemistry_79.jpg]] |
| | + | |
| | + | 9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом. |
| | + | |
| | + | [[Image:Chemistry_79_1.jpg]] |
| | + | |
| | + | ЛАБОРАТОРНІ ДОСЛІДИ |
| | + | |
| | + | Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ |
| | + | |
| | + | <u>Реакції обміну в розчинах електролітів</u> |
| | + | |
| | + | <u>''Завдання''</u>'' '' |
| | + | |
| | + | 1. Проробіть досліди (варіант виконання вкаже вчитель хімії). Для ліпшого спостереження за перебігом реакцій використовуйте чорно-білий екран. Якщо досліди виконуєте у заглибинах пластини, беріть реактивів удвічі менше порівняно з кількостями, потрібними для дослідів у пробірках. |
| | + | |
| | + | 2. Опишіть і поясніть спостереження, складіть рівняння реакцій, запишіть їх у повній і (де це можливо) скороченій йонній формі. За потреби скористайтесь таблицею «Розчинність кислот, основ і солей у воді» (див. додаток). |
| | + | |
| | + | 3. Після завершення роботи обговоріть свої спостереження та складені скорочені йонні рівняння із сусідом по парті, який виконував інший варіант дослідів. Порівняйте висновки, яких ви дійшли. Які рівняння, на вашу думку, відображають суть реакцій обміну між електролітами у розчині? |
| | + | |
| | + | [[Image:Chemistry_84jpg.jpg]] |
| | + | |
| | + | Обладнання: штатив з пробірками або пластина із заглибинами, скляні палички, чорно-білий екран. |
| | + | |
| | + | ''І варіант'' |
| | + | |
| | + | Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій нітрату, калій гідроксиду; хлоридна кислота. |
| | + | |
| | + | ''№ 2. Реакції обміну в розчинах електролітів з випаданням осаду'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 5 крапель розчину купрум(ІІ) сульфату і добавте 5 крапель розчину калій гідроксиду. |
| | + | |
| | + | ''№ 3. Реакції обміну в розчинах електролітів з виділенням газу'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі хлоридної кислоти. |
| | + | |
| | + | ''№ 4. Реакції обміну в розчинах електролітів з утворенням води'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 3-4 краплі розчину калій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину? |
| | + | |
| | + | Добавте краплю хлоридної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився. |
| | + | |
| | + | Додатково.* Змішування розчинів купрум(ІІ) сульфату і натрій нітрату. |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій нітрату. Чи є ознаки перебігу реакції? Складіть рівняння реакції, запишіть його у повному йонному вигляді. Поясніть, чи можна скласти скорочене йонне рівняння. Зробіть висновок, чи відбулася хімічна реакція. |
| | + | |
| | + | ''II варіант'' |
| | + | |
| | + | Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій хлориду, натрій гідроксиду, сульфатної кислоти. |
| | + | |
| | + | ''№ 2. Реакції обміну в розчинах електролітів з випаданням осаду'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 5 крапель розчину купрум(П) сульфату і добавте 5 крапель розчину натрій гідроксиду. |
| | + | |
| | + | ''№ 3. Реакції обміну в розчинах електролітів з виділенням газу'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі розчину сульфатної кислоти. |
| | + | |
| | + | ''№ 4. Реакції обміну в розчинах електролітів з утворенням води'' |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 3-4 краплі розчину натрій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину?<br>Добавте краплю розчину сульфатної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився. |
| | + | |
| | + | Додатково. * Змішування розчинів купрум(П) сульфату і натрій хлориду. |
| | + | |
| | + | Інструкція |
| | + | |
| | + | У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій хлориду. Чи є ознаки перебігу реакції? Поясніть, чи можна скласти скорочене йонне рівняння цієї реакції. Зробіть висновок, чи відбулася хімічна реакція. |
| | + | |
| | + | ''<u>Застосуйте свої знання й уміння</u>'' |
| | + | |
| | + | 1. Запишіть у повній і скороченій йонних формах рівняння реакцій між:<br>а) натрій карбонатом і кальцій хлоридом; б) хлоридною кислотою та магній карбонатом; в) нітратною кислотою та барій гідроксидом. |
| | + | |
| | + | 2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині:<br>А Мg<sup>2+</sup> і NО[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; Б Мg<sup>2+</sup> і Ва<sup>2+</sup>; В Ва<sup>2+</sup> і SО<sup>2-</sup><sub>4</sub>; Г NО[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]] і SО<sup>2-</sup><sub>4</sub>. |
| | + | |
| | + | 3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині:<br>А К<sup>+</sup> і NO[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; Б H+ і N0[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; В Н<sup>+</sup> і ОН<sup>-</sup>; Г К<sup>+</sup> і ОН<sup>-</sup>. |
| | + | |
| | + | 4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією:<br>а) катіонів Плюмбуму(ІІ) і хлорид-аніонів; б) катіонів Гідрогену і гідроксид-аніонів; в) катіонів Гідрогену і силікат-аніонів; г) катіонів Гідрогену і купрум(ІІ) гідроксиду; д) катіонів Гідрогену і сульфід-анюнів. |
| | + | |
| | + | 5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині: <br>А Са<sup>2+ </sup>і РО<sup>3-</sup><sub>4</sub>; Б Fе<sup>3+ </sup>і ОН<sup>-</sup>; В СО<sup>2-</sup><sub>3</sub> і Сl<sup>-</sup>; Г NО<sup>-</sup><sub>3</sub> і Ва<sup>2+</sup>. |
| | + | |
| | + | 6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння. |
| | + | |
| | + | [[Image:Chemistry_88.jpg]] |
| | + | |
| | + | 7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах. |
| | + | |
| | + | [[Image:Chemistry_88_1.jpg]] |
| | + | |
| | + | 8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь. |
| | + | |
| | + | 9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС0<sub>3</sub>) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою. |
| | + | |
| | + | |
| | + | |
| | + | |
| | | | |
| | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| - | <br> <sub>Підручники та [[Гіпермаркет_Знань_-_перший_в_світі!|книги]] по всім предметам, домашня робота, онлайн бібліотеки книжок, плани конспектів уроків [[Хімія|з хімії]], реферати та конспекти уроків [[Хімія_9_клас|з хімії для 9 класу]]</sub> | + | <br> <sub>Підручники та [[Гіпермаркет Знань - перший в світі!|книги]] по всім предметам, домашня робота, онлайн бібліотеки книжок, плани конспектів уроків [[Хімія|з хімії]], реферати та конспекти уроків [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
Версия 08:21, 7 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розв'язування розрахункових задач №5
РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №5
Застосуйте свої знання й уміння
1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення:
A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;
Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;
В Числа молекул у розчині до числа молекул, які дисоціювали;
Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони.
2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони:
А 0,2; Б 20; В 0,02; Г 2.
3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %):
A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2.
4. Виберіть слабкі електроліти: А HCl; Б H2S; В Н20; Г H2S04.
5. Виберіть сильну кислоту:
А Бромідна; Б Сульфідна; В Молочна; Г Силікатна.
6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві?
7.Встановіть відповідність між електролітами та ступенем дисоціації.
|
Електроліт
1 Сильний
2 Слабкий
|
Ступінь дисоціації
А а = 0
Б а → 1
В 0 < а < 0,03
|
8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот.
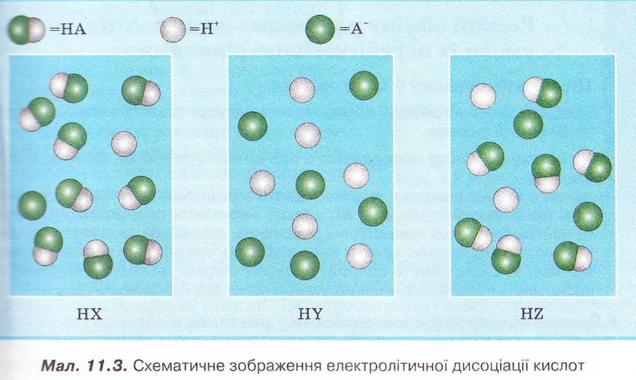
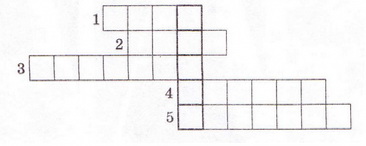
9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом.
ЛАБОРАТОРНІ ДОСЛІДИ
Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ
Реакції обміну в розчинах електролітів
Завдання
1. Проробіть досліди (варіант виконання вкаже вчитель хімії). Для ліпшого спостереження за перебігом реакцій використовуйте чорно-білий екран. Якщо досліди виконуєте у заглибинах пластини, беріть реактивів удвічі менше порівняно з кількостями, потрібними для дослідів у пробірках.
2. Опишіть і поясніть спостереження, складіть рівняння реакцій, запишіть їх у повній і (де це можливо) скороченій йонній формі. За потреби скористайтесь таблицею «Розчинність кислот, основ і солей у воді» (див. додаток).
3. Після завершення роботи обговоріть свої спостереження та складені скорочені йонні рівняння із сусідом по парті, який виконував інший варіант дослідів. Порівняйте висновки, яких ви дійшли. Які рівняння, на вашу думку, відображають суть реакцій обміну між електролітами у розчині?

Обладнання: штатив з пробірками або пластина із заглибинами, скляні палички, чорно-білий екран.
І варіант
Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій нітрату, калій гідроксиду; хлоридна кислота.
№ 2. Реакції обміну в розчинах електролітів з випаданням осаду
Інструкція
У пробірку внесіть 5 крапель розчину купрум(ІІ) сульфату і добавте 5 крапель розчину калій гідроксиду.
№ 3. Реакції обміну в розчинах електролітів з виділенням газу
Інструкція
У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі хлоридної кислоти.
№ 4. Реакції обміну в розчинах електролітів з утворенням води
Інструкція
У пробірку внесіть 3-4 краплі розчину калій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину?
Добавте краплю хлоридної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився.
Додатково.* Змішування розчинів купрум(ІІ) сульфату і натрій нітрату.
Інструкція
У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій нітрату. Чи є ознаки перебігу реакції? Складіть рівняння реакції, запишіть його у повному йонному вигляді. Поясніть, чи можна скласти скорочене йонне рівняння. Зробіть висновок, чи відбулася хімічна реакція.
II варіант
Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій хлориду, натрій гідроксиду, сульфатної кислоти.
№ 2. Реакції обміну в розчинах електролітів з випаданням осаду
Інструкція
У пробірку внесіть 5 крапель розчину купрум(П) сульфату і добавте 5 крапель розчину натрій гідроксиду.
№ 3. Реакції обміну в розчинах електролітів з виділенням газу
Інструкція
У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі розчину сульфатної кислоти.
№ 4. Реакції обміну в розчинах електролітів з утворенням води
Інструкція
У пробірку внесіть 3-4 краплі розчину натрій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину?
Добавте краплю розчину сульфатної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився.
Додатково. * Змішування розчинів купрум(П) сульфату і натрій хлориду.
Інструкція
У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій хлориду. Чи є ознаки перебігу реакції? Поясніть, чи можна скласти скорочене йонне рівняння цієї реакції. Зробіть висновок, чи відбулася хімічна реакція.
Застосуйте свої знання й уміння
1. Запишіть у повній і скороченій йонних формах рівняння реакцій між:
а) натрій карбонатом і кальцій хлоридом; б) хлоридною кислотою та магній карбонатом; в) нітратною кислотою та барій гідроксидом.
2. Виберіть пару йонів, яка бере участь у хімічній реакції між магній сульфатом і барій нітратом у розчині:
А Мg2+ і NО[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; Б Мg2+ і Ва2+; В Ва2+ і SО2-4; Г NО[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]] і SО2-4.
3. Виберіть пару йонів, яка бере участь у хімічній реакції між калій гідроксидом і нітратною кислотою у розчині:
А К+ і NO[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; Б H+ і N0[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Znak4_1.jpg|[[Image:|Image:Znak4 1.jpg]]]]; В Н+ і ОН-; Г К+ і ОН-.
4. Доберіть не менше двох пар речовин, реакції між якими у розчині зумовлені взаємодією:
а) катіонів Плюмбуму(ІІ) і хлорид-аніонів; б) катіонів Гідрогену і гідроксид-аніонів; в) катіонів Гідрогену і силікат-аніонів; г) катіонів Гідрогену і купрум(ІІ) гідроксиду; д) катіонів Гідрогену і сульфід-анюнів.
5. Виберіть пари йонів, які не можуть одночасно перебувати у розчині:
А Са2+ і РО3-4; Б Fе3+ і ОН-; В СО2-3 і Сl-; Г NО-3 і Ва2+.
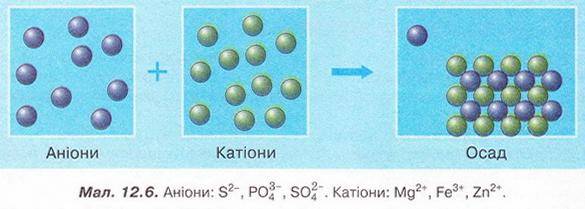
6. Роздивіться малюнок 12.6. Виберіть пари йонів, які відповідають схематичному зображенню скороченого йонного рівняння.
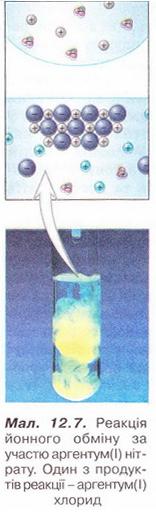
7. На малюнку 12.7 на мікро- і макрорівні зображено реакцію йонного обміну за участю аргентум(І) нітрату. Один з її продуктів - аргентум(І) хлорид. Визначте, як електроліти могли б бути другим реагентом у цій реакції. Складіть хімічні рівняння, запишіть їх у повній і скороченій йонній формах.
8. У хімічний стакан із розчином сульфатної кислоти занурили електроди приладу для дослідження електропровідності й увімкнули електричний струм. Де досліджуваного розчину почали повільно доливати розчин барій гідроксиду. Спрогнозуйте зміни, які відбуватимуться у розчині та з індикатором приладу Поясніть спостереження за допомогою повних і скорочених йонних рівнянь.
9. До складу начинки карамельок «Шипучка» входить питна сода (натрій гідрогенкарбонат NaНС03) та лимонна кислота. Поясніть, чому ці речовини починають взаємодіяти між собою лише під час контакту з вологою.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Підручники та книги по всім предметам, домашня робота, онлайн бібліотеки книжок, плани конспектів уроків з хімії, реферати та конспекти уроків з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|















