|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 клас|Химия 8 класс]]>> Химия: Электролитическая диссоциация<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Электролитическая диссоциация</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Электролитическая диссоциация<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Электролитическая диссоциация</metakeywords>''' |
| | | | |
| | Как вы знаете из уроков физики, растворы одних веществ способны проводить электрический ток, а других нет. Чтобы опытным путем проверить эту способность у растворов различных веществ, воспользуемся следующим пробором. | | Как вы знаете из уроков физики, растворы одних веществ способны проводить электрический ток, а других нет. Чтобы опытным путем проверить эту способность у растворов различных веществ, воспользуемся следующим пробором. |
Версия 08:33, 15 июня 2010
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Электролитическая диссоциация
Как вы знаете из уроков физики, растворы одних веществ способны проводить электрический ток, а других нет. Чтобы опытным путем проверить эту способность у растворов различных веществ, воспользуемся следующим пробором.
Он состоит из стакана, в который наливают раствор исследуемого вещества. На стакан ставят пластинку из эбонита с вмонтированными в нее двумя угольными электродный, к клеммам которых присоединены провода. Один из них соединен с лампочкой. Выходной контакт от лампочки и провод от другой клеммы идут к источнику тока. Если раствор, налитый в стакан, проводит электрический ток, то лампочка загорается, и чем лучше эта способность, тем ярче горит лампочка. Проводят электрический ток растворы солей, щелочей, кислот.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других ществ не проводят электрический ток.
Вещества, растворы которых не проводят злектрический ток, называются неэлектролитами.
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванге Аррениус, изучая электропроводность растворов различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируются на ионы. Они считали, что в растворах находятся не свободные, не "голые" ионы, а гидратированные, то есть «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104.5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
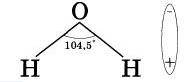
Как правило, легче всего диссоциируют вещества с ионной связью и. соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряжен-и |.: ми концами вокруг положительных и отрицательных ионов электролита. Между ионами электролита и диполями йоды возникают силы взаимного притяжения. В результате связь между нонами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
а) ориентация молекул — диполей воды около ионов кристалла
б) гидратация ( взаимодействие ) молекул воды с ионами поверхностного слоя кристалла
в) диссоциация (распад) кристалла электролита на гидротированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:
NaCl = Na+ + Cl-
Аналогично диссоциируются и электролиты, в молекулах которых ковалентная полярная связь (например, молекулы хло-роводорода НС1, рис. 43), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, будет такая:
а) ориентация молекул воды вокруг полюсов молекулыэлектролита
б) гидратация (взаимодействие) молекул воды с молекулами электролита
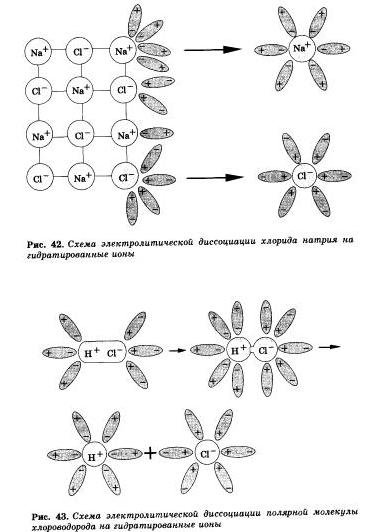
в)ионизация молекул электролита
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
HCl = H+ + Cl-
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Также необходимо учитывать, что свойства гид ратированных ионов отличаются от свойств негидратированные иоиов. Например, негидратироваииый ион меди Си 2+ — белый в безводных кристаллах сульфата меди (II) СиSО4 и имеет голубой цвет, когда гидратированный. Гидратировешиые ионы имеют как постоянное, так и переменное число молекул воды.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой а («альфа»).
Степень диссоциации — это отношение числи частиц, распавшихся на ионы (Nд) к общему числу растворенных частиц (Nр):
а= Nд / Nр
Степень диссоциации электролита определяется опытным путем и выражается в долях или в процентах. Если то диссоциация отсутствует, а если а - I или 100%. то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, то есть степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты — такие электролиты, которые при растворении в воде практически полностью диссоциируют на иоиы. У таких электролитов значение степени диссоциация стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли

1. Электролиты и неэлектролиты. 2. Электролитические диссоциации и ассоциация. 3. Механизм диссоциации веществ с различным типом связи. 4. Степень электролитической диссоциации. 5. Сильные и слабые электролиты.
Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы— нет?
Является ли соль СаСО, электролитом? Почему?
Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
Докажите, что деление химических связей на ковалентную полярную и ионную условно.
Как отличается по своей природе электропроводность металлов и электролитов?
Как объяснить электрическую проводимость водных растворов электролитов?
обсуждения по химии, методические рекомендации, рефераты для 8 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













