|
|
|
| Строка 1: |
Строка 1: |
| - | <p><b><a href="Гипермаркет знаний - первый в мире!">Гипермаркет знаний</a>>><a href="Химия">Химия</a>>><a href="Химия 10 класс">Химия 10 класс</a>>> Химия: Гибридизация электронных орбиталей и геометрия молекул<span class="fck_mw_special" _fck_mw_customtag="true" _fck_mw_tagname="metakeywords">химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Гибридизация электронных орбиталей и геометрия молекул, геометрия молекул</span></b>
| + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Гибридизация электронных орбиталей и геометрия молекул<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Гибридизация электронных орбиталей и геометрия молекул</metakeywords>''' |
| - | </p><p>Ковалентная связь наиболее распространена в мире органических и неорганических веществ и характеризуется насыщаемостью, поляризуемостью и направленностью в пространстве.<br /><br />Насыщаемость ковалентной связи состоит в том, что число общих электронных пар, которые способен образовать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав. Поэтому, например, существуют молекулы Н2, N2, СН4, но нет молекул Н3, N4, СН5.<br /><br />Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля.<br /><br />В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы — превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов:<br /><img src="ef=" _fck_mw_filename="Him11R-8.jpg" alt="" /><br />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>Направленность ковалентной связи обусловлена тем, что р-, d и f орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, то есть на геометрию молекул.<br /><br />В результате образования ковалентной связи атомы неметаллов получают завершенную электронную конфигурацию внешнего слоя из восьми электронов. Получившиеся при этом четыре электронные пары располагаются в пространстве из-за взаимного отталкивания так, чтобы быть максимально удаленными друг от друга. Ученые рассчитали, что наибольшее расстояние между четырьмя электронными парами достигается при их тетраэдриче-ском расположении, то есть тогда, когда каждая из четырех электронных пар занимает область пространства, направленную к одной из вершин тетраэдра.<br />
| + | |
| - | </p><p>Например, в молекуле метана СН4 атом углерода получил «заветный» октет электронов за счет образования четырех общих электронных пар с четырьмя атомами водорода.<br /><br />Атом углерода, как вы помните из курса органической химии, расположен в центре тетраэдра, а атомы водорода — в четырех вершинах. Угол Н—С—Н будет равен 109°28' (рис. 10).<br /><img src="ef=" _fck_mw_filename="Him11R-9.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>Аналогичное тетраэдрическое расположение имеют и связи атомов углерода в молекулах других алканов, например в молекуле этана.<br /><br />В молекуле метана все четыре общие электронные пары образовались за счет спаривания непарных электронов атома углерода с четырьмя электронами четырех атомов водорода — в ней нет не-поделенных электронных пар. А вот, например, в молекулах аммиака NH3, воды Н20 и фтористого водорода НF, во внешнем электронном слое атомов азота, кислорода и фтора они имеются (у азота — одна электронная пара, у кислорода — две, и у фтора — три).<br /><br />Эти неподеленные электронные пары отталкивают общие электронные пары, и поэтому в молекулах аммиака, воды и фторо-водорода связи стремятся также принять тетраэдрическую направленность, но только в одной (NН3), двух (Н20) и трех (НF) вершинах этих тетраэдров будут располагаться неподеленные электронные пары (рис. 11).<br /><br />Следовательно, форма молекул с ковалентными связями определяется несложной закономерностью:<br /><br /><i>электронные пары завершенного внешнего слоя отталкиваются друг от друга и стремятся расположиться на максимальных расстояниях друг от друга.</i><br />
| + | |
| - | </p><p><img src="ef=" _fck_mw_filename="Him11R-10.jpg" alt="" /><br />
| + | |
| - | </p><p><br />Неподеленные электронные пары сильнее отталкивают от себя общие электронные пары о-связей, чем эти пары отталкивают друг друга. Этим объясняется уменьшение углов связей по сравнению с тетраэдрическим углами (109°28') в ряду:<br /><img src="ef=" _fck_mw_filename="Him11R-11.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>Более полное представление о форме молекул органических и неорганических веществ можно составить на основе гипотезы о гибридизации электронных орбиталей атомов. Она была предложена Л. Полингом (США) для объяснения установленного с помощью новых физических методов исследования веществ факта равноценности всех химических связей и симметричного расположения их относительно центра молекул СН4, ВF3, ВеСl2. В образовании о-связей в каждом случае от центрального атома (С, В, Ве) должны были участвовать орбитали разных типов (s- и р), поэтому они не могли быть равноценными. Теория оказалась неспособной объяснить факты, возникло противоречие, которое было разрешено с помощью новой гипотезы. Это один из примеров, показывающих путь развития познания человеком окружающего мира, возможность все более глубокого проникновения в сущность явлений.<br /><br />С гипотезой гибридизации электронных орбиталей вы знакомились в курсе органической химии на примере атома углерода. Напомним об этом еще раз.<br /><br />При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное:<br /><img src="ef=" _fck_mw_filename="Him11R-12.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>Внешний электронный слой возбужденного атома углерода содержит один в- и три р-неспаренных электрона, которые и дадут четыре о-связи с четырьмя s-электронами атомов водорода. При этом следует ожидать, что три связи С—Н, образованные за счет спаривания трех р-электронов атома углерода с тремя s-электронами трех атомов водорода (s—р гамма-связь), должны бы отличаться от четвертой (s—s) связи прочностью, длиной, направленностью. Изучение электронной плотности в молекулах метана показывает, что все связи в молекуле метана равноценны и направлены к вершинам тетраэдра. Это объясняется тем, что при образовании молекулы метана четыре ковалентные связи возникают не за счет «чистых» орбиталей, а за счет так называемых гибридных, то есть усредненных по форме и размерам (а следовательно, и по энергии), орбиталей.
| + | |
| - | </p><p><br />Гибридизацией электронных орбиталей называют процесс их взаимодействия, приводящий к выравниванию по форме и энергии.<br /><br />Число гибридных орбиталей равно числу исходных орбиталей. Гибридные орбитали выгоднее по геометрической форме, чем s- и р-орбитали, их электронная плотность распределена иначе, что обеспечивает более полное перекрывание с в-орбиталями атомов водорода, чем было бы у «чистых» s- и р-орбиталей.<br /><br />В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода находятся в состоянии sр<sup>3</sup>-гибридизации, то есть у атома углерода гибридизации подверглись одна s- и три р-орбитали и образовались четыре одинаковые гибридные вр3-орбита-ли.<br /><br />В результате перекрывания четырех гибридных sр3-орби-талей атома углерода и в орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми гамма-связями под углом в 109°28' (рис. 12).<br /><br />Этот тип гибридизации атомов и, следовательно, тетраэдрическое строение будет характеризовать также молекулы соединений аналога углерода — кремния: SiН<sub>4</sub>, SіСl<sub>4</sub>.<br /><br />А в молекулах воды и аммиака происходит sр<sup>3</sup>-гибридизация орбиталей атомов кислорода и азота. Однако если у атома углерода все четыре гибридные sр3-орбитали заняты общими электронными парами, то у атома азота одна ер-орбиталь занята неподеленной электронной парой, а у атома кислорода ими заняты уже две sр3-орбитали.<br /><br />Таким образом, на изменение величины угла связей в тетраэдре (109°28') оказывают действие отталкивающие свойства неподеленных (свободных) электронных пар, занимающих гибридные sр<sup>3</sup>-орбитали: у атома азота одна электронная пара (< Н—N—Н = 107°30'), а у атома кислорода — две (< Н—О—Н = 104°27').<br /><img src="ef=" _fck_mw_filename="Him11R-13.jpg" alt="" />
| + | |
| - | </p><p><br />sр<sup>3</sup>-Гибридизация наблюдается не только у атомов в сложных веществах, но и у атомов в простых веществах. Например, у атомов такой аллотропной модификации углерода, как алмаз.<br /><br />В молекулах некоторых соединений бора имеет место §р2-гибридизация внешних орбиталей атома бора.<br /><img src="ef=" _fck_mw_filename="Him11R-14.jpg" alt="" />
| + | |
| - | <br />
| + | |
| - | У атома бора в возбужденном состоянии в гибридизации участвуют одна из е- и две р-орбитали, в результате чего образуются три §р2-гибридные орбитали, расположенные в плоскости под углом 120° друг к другу (рис. 13).<br /><br />Поэтому молекулы таких соединений, например ВF3, имеют форму плоского треугольника (рис. 14).<br /><br /><img src="ef=" _fck_mw_filename="Him11R-15.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>В органических соединениях, как вы знаете, sр<sup>2</sup>-гибридизация характерна для атомов углерода в молекулах алкенов по месту двойной связи, чем и объясняется плоскостное строение этих частей молекул, а также молекул диенов и аренов. sр<sup>2</sup>-Гибридизация наблюдается также у атомов углерода и в такой аллотропной модификации углерода, как графит.<br /><br />В молекулах некоторых соединений бериллия наблюдается ер-гибридизация внешних орбиталей возбужденного атома бериллия.<br /><br /><img src="ef=" _fck_mw_filename="Him11R-16.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>Аналогичный тип гибридизации электронных орбиталей существует у атомов углерода в алкинах — углеводородах ряда ацетилена — по месту тройной связи.<br /><br />Такая гибридизация орбиталей характерна для атомов углерода в еще одной его аллотропной модификации, карбине:<br /><br />...-С-= С -С-=С- ...<br /><br />В таблице 8 приведены виды геометрических конфигураций молекул, соответствующие некоторым типам гибридизации орбиталей центрального атома А с учетом влияния числа свободных (несвязывающих) электронных пар.<br /><br /><i>Таблица 8 Геометрические конфигурации молекул, соответствующие различным типам гибридизации — внешних электронных орбиталей центрального атома</i><br /><img src="ef=" _fck_mw_filename="Him11R-17.jpg" alt="" />
| + | |
| - | </p><p><br />
| + | |
| - | </p><p>1. В молекулах водородных соединений углерода, азота и кислорода СН4, NН3 и Н20 валентные орбитали центральных атомов неметаллов имеют одинаковое состояние вр3-гибридизации, но разные углы между связями — 109°28', 107°30' и 104°27' соответственно. Чем это можно объяснить?<br />
| + | |
| - | </p><p>2. Почему графит электропроводен, а алмаз нет?<br />
| + | |
| - | </p><p>3. Какую геометрическую форму будут иметь молекулы двух фторидов — бора и азота (ВF3 и NF3 соответственно)? Дайте обоснованный ответ.<br />
| + | |
| - | </p><p>4. Молекула фторида кремния SiF4 имеет тетраэдрическое строение, а молекула хлорида брома ВСl3 — форму треугольника — плоскостное. Почему?
| + | |
| - | </p><p><br />
| + | |
| - | </p><p><br /> <sub>подсказки <a href="Химия 11 класс">для учеников 11 класса</a>, методические рекомендации <a href="Гипермаркет знаний - первый в мире!">для учителей</a>, тесты и <a href="Химия">решения к ним</a></sub>
| + | |
| - | </p>
| + | |
| - | <pre class="_fck_mw_lspace"><b><u>Содержание урока</u></b>
| + | |
| - | <u></u><b><img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> конспект урока </b>
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> опорный каркас
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> презентация урока
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> акселеративные методы
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> интерактивные технологии
| + | |
| | | | |
| - | <b><u>Практика</u></b>
| + | Ковалентная связь наиболее распространена в мире органических и неорганических веществ и характеризуется насыщаемостью, поляризуемостью и направленностью в пространстве.<br><br>Насыщаемость ковалентной связи состоит в том, что число общих электронных пар, которые способен образовать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав. Поэтому, например, существуют молекулы Н2, N2, СН4, но нет молекул Н3, N4, СН5.<br><br>Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля.<br><br>В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы — превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов:<br>[[Image:Him11R-8.jpg]]<br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> задачи и упражнения
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> самопроверка | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> практикумы, тренинги, кейсы, квесты | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> домашние задания
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> дискуссионные вопросы
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> риторические вопросы от учеников | + | |
| - |
| + | |
| - | <b><u>Иллюстрации</u></b> | + | |
| - | <u></u><b><img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> аудио-, видеоклипы и мультимедиа </b>
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> фотографии, картинки | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> графики, таблицы, схемы | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> юмор, анекдоты, приколы, комиксы
| + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> притчи, поговорки, кроссворды, цитаты | + | |
| | | | |
| - | <b><u>Дополнения</u></b> | + | <br> |
| - | <u></u><b><img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> рефераты</b> | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> статьи | + | Направленность ковалентной связи обусловлена тем, что р-, d и f орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, то есть на геометрию молекул.<br><br>В результате образования ковалентной связи атомы неметаллов получают завершенную электронную конфигурацию внешнего слоя из восьми электронов. Получившиеся при этом четыре электронные пары располагаются в пространстве из-за взаимного отталкивания так, чтобы быть максимально удаленными друг от друга. Ученые рассчитали, что наибольшее расстояние между четырьмя электронными парами достигается при их тетраэдриче-ском расположении, то есть тогда, когда каждая из четырех электронных пар занимает область пространства, направленную к одной из вершин тетраэдра.<br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> фишки для любознательных | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> шпаргалки | + | Например, в молекуле метана СН4 атом углерода получил «заветный» октет электронов за счет образования четырех общих электронных пар с четырьмя атомами водорода.<br><br>Атом углерода, как вы помните из курса органической химии, расположен в центре тетраэдра, а атомы водорода — в четырех вершинах. Угол Н—С—Н будет равен 109°28' (рис. 10).<br>[[Image:Him11R-9.jpg]]<br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> учебники основные и дополнительные | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> словарь терминов | + | <br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> прочие | + | |
| - | <b><u></u></b> | + | Аналогичное тетраэдрическое расположение имеют и связи атомов углерода в молекулах других алканов, например в молекуле этана.<br><br>В молекуле метана все четыре общие электронные пары образовались за счет спаривания непарных электронов атома углерода с четырьмя электронами четырех атомов водорода — в ней нет не-поделенных электронных пар. А вот, например, в молекулах аммиака NH3, воды Н20 и фтористого водорода НF, во внешнем электронном слое атомов азота, кислорода и фтора они имеются (у азота — одна электронная пара, у кислорода — две, и у фтора — три).<br><br>Эти неподеленные электронные пары отталкивают общие электронные пары, и поэтому в молекулах аммиака, воды и фторо-водорода связи стремятся также принять тетраэдрическую направленность, но только в одной (NН3), двух (Н20) и трех (НF) вершинах этих тетраэдров будут располагаться неподеленные электронные пары (рис. 11).<br><br>Следовательно, форма молекул с ковалентными связями определяется несложной закономерностью:<br><br>''электронные пары завершенного внешнего слоя отталкиваются друг от друга и стремятся расположиться на максимальных расстояниях друг от друга.''<br> |
| - | <u>Совершенствование учебников и уроков | + | |
| - | </u><b><img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> исправление ошибок в учебнике</b> | + | [[Image:Him11R-10.jpg]]<br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> обновление фрагмента в учебнике | + | |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> элементы новаторства на уроке | + | <br>Неподеленные электронные пары сильнее отталкивают от себя общие электронные пары о-связей, чем эти пары отталкивают друг друга. Этим объясняется уменьшение углов связей по сравнению с тетраэдрическим углами (109°28') в ряду:<br>[[Image:Him11R-11.jpg]]<br> |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> замена устаревших знаний новыми
| + | |
| | + | <br> |
| | + | |
| | + | Более полное представление о форме молекул органических и неорганических веществ можно составить на основе гипотезы о гибридизации электронных орбиталей атомов. Она была предложена Л. Полингом (США) для объяснения установленного с помощью новых физических методов исследования веществ факта равноценности всех химических связей и симметричного расположения их относительно центра молекул СН4, ВF3, ВеСl2. В образовании о-связей в каждом случае от центрального атома (С, В, Ве) должны были участвовать орбитали разных типов (s- и р), поэтому они не могли быть равноценными. Теория оказалась неспособной объяснить факты, возникло противоречие, которое было разрешено с помощью новой гипотезы. Это один из примеров, показывающих путь развития познания человеком окружающего мира, возможность все более глубокого проникновения в сущность явлений.<br><br>С гипотезой гибридизации электронных орбиталей вы знакомились в курсе органической химии на примере атома углерода. Напомним об этом еще раз.<br><br>При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное:<br>[[Image:Him11R-12.jpg]]<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Внешний электронный слой возбужденного атома углерода содержит один в- и три р-неспаренных электрона, которые и дадут четыре о-связи с четырьмя s-электронами атомов водорода. При этом следует ожидать, что три связи С—Н, образованные за счет спаривания трех р-электронов атома углерода с тремя s-электронами трех атомов водорода (s—р гамма-связь), должны бы отличаться от четвертой (s—s) связи прочностью, длиной, направленностью. Изучение электронной плотности в молекулах метана показывает, что все связи в молекуле метана равноценны и направлены к вершинам тетраэдра. Это объясняется тем, что при образовании молекулы метана четыре ковалентные связи возникают не за счет «чистых» орбиталей, а за счет так называемых гибридных, то есть усредненных по форме и размерам (а следовательно, и по энергии), орбиталей. |
| | + | |
| | + | <br>Гибридизацией электронных орбиталей называют процесс их взаимодействия, приводящий к выравниванию по форме и энергии.<br><br>Число гибридных орбиталей равно числу исходных орбиталей. Гибридные орбитали выгоднее по геометрической форме, чем s- и р-орбитали, их электронная плотность распределена иначе, что обеспечивает более полное перекрывание с в-орбиталями атомов водорода, чем было бы у «чистых» s- и р-орбиталей.<br><br>В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода находятся в состоянии sр<sup>3</sup>-гибридизации, то есть у атома углерода гибридизации подверглись одна s- и три р-орбитали и образовались четыре одинаковые гибридные вр3-орбита-ли.<br><br>В результате перекрывания четырех гибридных sр3-орби-талей атома углерода и в орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми гамма-связями под углом в 109°28' (рис. 12).<br><br>Этот тип гибридизации атомов и, следовательно, тетраэдрическое строение будет характеризовать также молекулы соединений аналога углерода — кремния: SiН<sub>4</sub>, SіСl<sub>4</sub>.<br><br>А в молекулах воды и аммиака происходит sр<sup>3</sup>-гибридизация орбиталей атомов кислорода и азота. Однако если у атома углерода все четыре гибридные sр3-орбитали заняты общими электронными парами, то у атома азота одна ер-орбиталь занята неподеленной электронной парой, а у атома кислорода ими заняты уже две sр3-орбитали.<br><br>Таким образом, на изменение величины угла связей в тетраэдре (109°28') оказывают действие отталкивающие свойства неподеленных (свободных) электронных пар, занимающих гибридные sр<sup>3</sup>-орбитали: у атома азота одна электронная пара (< Н—N—Н = 107°30'), а у атома кислорода — две (< Н—О—Н = 104°27').<br>[[Image:Him11R-13.jpg]]<br> |
| | + | |
| | + | <br>sр<sup>3</sup>-Гибридизация наблюдается не только у атомов в сложных веществах, но и у атомов в простых веществах. Например, у атомов такой аллотропной модификации углерода, как алмаз.<br><br>В молекулах некоторых соединений бора имеет место sр<sup>2</sup>-гибридизация внешних орбиталей атома бора.<br>[[Image:Him11R-14.jpg]]<br> |
| | + | |
| | + | <br> У атома бора в возбужденном состоянии в гибридизации участвуют одна изs- и две р-орбитали, в результате чего образуются три §р2-гибридные орбитали, расположенные в плоскости под углом 120° друг к другу (рис. 13).<br><br>Поэтому молекулы таких соединений, например ВF3, имеют форму плоского треугольника (рис. 14).<br><br>[[Image:Him11R-15.jpg]]<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | В органических соединениях, как вы знаете, sр<sup>2</sup>-гибридизация характерна для атомов углерода в молекулах алкенов по месту двойной связи, чем и объясняется плоскостное строение этих частей молекул, а также молекул диенов и аренов. sр<sup>2</sup>-Гибридизация наблюдается также у атомов углерода и в такой аллотропной модификации углерода, как графит.<br><br>В молекулах некоторых соединений бериллия наблюдаетсяsр-гибридизация внешних орбиталей возбужденного атома бериллия.<br><br>[[Image:Him11R-16.jpg]]<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Аналогичный тип гибридизации электронных орбиталей существует у атомов углерода в алкинах — углеводородах ряда ацетилена — по месту тройной связи.<br><br>Такая гибридизация орбиталей характерна для атомов углерода в еще одной его аллотропной модификации, карбине:<br><br>...-С-= С -С-=С- ...<br><br>В таблице 8 приведены виды геометрических конфигураций молекул, соответствующие некоторым типам гибридизации орбиталей центрального атома А с учетом влияния числа свободных (несвязывающих) электронных пар.<br><br>''Таблица 8 Геометрические конфигурации молекул, соответствующие различным типам гибридизации — внешних электронных орбиталей центрального атома''<br>[[Image:Him11R-17.jpg]]<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | 1. В молекулах водородных соединений углерода, азота и кислорода СН4, NН3 и Н20 валентные орбитали центральных атомов неметаллов имеют одинаковое состояние sр<sup>3</sup>-гибридизации, но разные углы между связями — 109°28', 107°30' и 104°27' соответственно. Чем это можно объяснить?<br> |
| | + | |
| | + | 2. Почему графит электропроводен, а алмаз нет?<br> |
| | + | |
| | + | 3. Какую геометрическую форму будут иметь молекулы двух фторидов — бора и азота (ВF3 и NF3 соответственно)? Дайте обоснованный ответ.<br> |
| | + | |
| | + | 4. Молекула фторида кремния SiF4 имеет тетраэдрическое строение, а молекула хлорида брома ВСl3 — форму треугольника — плоскостное. Почему?<br> |
| | + | |
| | + | <br> <sub>подсказки для учеников [[Химия_11_класс|11 класса]], методические рекомендации [[Гипермаркет_знаний_-_первый_в_мире!|для учителей]], тесты и [[Химия|решения к ним]]</sub> |
| | + | |
| | + | '''<u>Содержание урока</u>''' |
| | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' |
| | + | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас |
| | + | [[Image:1236084776 kr.jpg|10x10px]] презентация урока |
| | + | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы |
| | + | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии |
| | | | |
| - | <b><u>Только для учителей</u></b>
| + | '''<u>Практика</u>''' |
| - | <u></u><b><img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> идеальные уроки </b> | + | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px]] самопроверка |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> методические рекомендации
| + | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> программы | + | [[Image:1236084776 kr.jpg|10x10px]] домашние задания |
| - | <img src="/images/9/95/1236084776_kr.jpg" _fck_mw_filename="1236084776 kr.jpg" _fck_mw_width="10" _fck_mw_height="10" alt="" /> обсуждения | + | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы |
| | + | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников |
| | + | |
| | + | '''<u>Иллюстрации</u>''' |
| | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' |
| | + | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки |
| | + | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы |
| | + | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы |
| | + | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты |
| | + | |
| | + | '''<u>Дополнения</u>''' |
| | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' |
| | + | [[Image:1236084776 kr.jpg|10x10px]] статьи |
| | + | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных |
| | + | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки |
| | + | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные |
| | + | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов |
| | + | [[Image:1236084776 kr.jpg|10x10px]] прочие |
| | + | '''<u></u>''' |
| | + | <u>Совершенствование учебников и уроков |
| | + | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' |
| | + | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике |
| | + | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке |
| | + | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми |
| | + | |
| | + | '''<u>Только для учителей</u>''' |
| | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' |
| | + | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год |
| | + | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации |
| | + | [[Image:1236084776 kr.jpg|10x10px]] программы |
| | + | [[Image:1236084776 kr.jpg|10x10px]] обсуждения |
| | + | |
| | + | |
| | + | '''<u>Интегрированные уроки</u>'''<u> |
| | + | </u> |
| | + | |
| | + | <br> |
| | | | |
| | + | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| | | | |
| - | <b><u>Интегрированные уроки</u></b><u>
| + | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
| - | </u>
| + | |
| - | </pre>
| + | |
| - | <p><br />
| + | |
| - | </p><p>Если у вас есть исправления или предложения к данному уроку, <a href="http://xvatit.com/index.php?do=feedback">напишите нам</a>.
| + | |
| - | </p><p>Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - <a href="http://xvatit.com/forum/">Образовательный форум</a>.
| + | |
| - | </p>
| + | |
Версия 08:43, 30 июня 2010
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Гибридизация электронных орбиталей и геометрия молекул
Ковалентная связь наиболее распространена в мире органических и неорганических веществ и характеризуется насыщаемостью, поляризуемостью и направленностью в пространстве.
Насыщаемость ковалентной связи состоит в том, что число общих электронных пар, которые способен образовать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав. Поэтому, например, существуют молекулы Н2, N2, СН4, но нет молекул Н3, N4, СН5.
Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля.
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы — превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов:
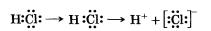
Направленность ковалентной связи обусловлена тем, что р-, d и f орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, то есть на геометрию молекул.
В результате образования ковалентной связи атомы неметаллов получают завершенную электронную конфигурацию внешнего слоя из восьми электронов. Получившиеся при этом четыре электронные пары располагаются в пространстве из-за взаимного отталкивания так, чтобы быть максимально удаленными друг от друга. Ученые рассчитали, что наибольшее расстояние между четырьмя электронными парами достигается при их тетраэдриче-ском расположении, то есть тогда, когда каждая из четырех электронных пар занимает область пространства, направленную к одной из вершин тетраэдра.
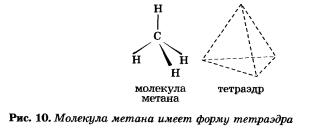
Например, в молекуле метана СН4 атом углерода получил «заветный» октет электронов за счет образования четырех общих электронных пар с четырьмя атомами водорода.
Атом углерода, как вы помните из курса органической химии, расположен в центре тетраэдра, а атомы водорода — в четырех вершинах. Угол Н—С—Н будет равен 109°28' (рис. 10).
Аналогичное тетраэдрическое расположение имеют и связи атомов углерода в молекулах других алканов, например в молекуле этана.
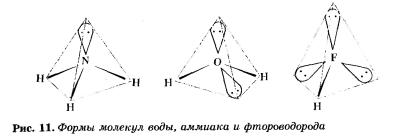
В молекуле метана все четыре общие электронные пары образовались за счет спаривания непарных электронов атома углерода с четырьмя электронами четырех атомов водорода — в ней нет не-поделенных электронных пар. А вот, например, в молекулах аммиака NH3, воды Н20 и фтористого водорода НF, во внешнем электронном слое атомов азота, кислорода и фтора они имеются (у азота — одна электронная пара, у кислорода — две, и у фтора — три).
Эти неподеленные электронные пары отталкивают общие электронные пары, и поэтому в молекулах аммиака, воды и фторо-водорода связи стремятся также принять тетраэдрическую направленность, но только в одной (NН3), двух (Н20) и трех (НF) вершинах этих тетраэдров будут располагаться неподеленные электронные пары (рис. 11).
Следовательно, форма молекул с ковалентными связями определяется несложной закономерностью:
электронные пары завершенного внешнего слоя отталкиваются друг от друга и стремятся расположиться на максимальных расстояниях друг от друга.
Неподеленные электронные пары сильнее отталкивают от себя общие электронные пары о-связей, чем эти пары отталкивают друг друга. Этим объясняется уменьшение углов связей по сравнению с тетраэдрическим углами (109°28') в ряду:

Более полное представление о форме молекул органических и неорганических веществ можно составить на основе гипотезы о гибридизации электронных орбиталей атомов. Она была предложена Л. Полингом (США) для объяснения установленного с помощью новых физических методов исследования веществ факта равноценности всех химических связей и симметричного расположения их относительно центра молекул СН4, ВF3, ВеСl2. В образовании о-связей в каждом случае от центрального атома (С, В, Ве) должны были участвовать орбитали разных типов (s- и р), поэтому они не могли быть равноценными. Теория оказалась неспособной объяснить факты, возникло противоречие, которое было разрешено с помощью новой гипотезы. Это один из примеров, показывающих путь развития познания человеком окружающего мира, возможность все более глубокого проникновения в сущность явлений.
С гипотезой гибридизации электронных орбиталей вы знакомились в курсе органической химии на примере атома углерода. Напомним об этом еще раз.
При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное:
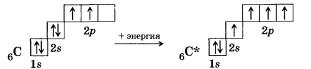
Внешний электронный слой возбужденного атома углерода содержит один в- и три р-неспаренных электрона, которые и дадут четыре о-связи с четырьмя s-электронами атомов водорода. При этом следует ожидать, что три связи С—Н, образованные за счет спаривания трех р-электронов атома углерода с тремя s-электронами трех атомов водорода (s—р гамма-связь), должны бы отличаться от четвертой (s—s) связи прочностью, длиной, направленностью. Изучение электронной плотности в молекулах метана показывает, что все связи в молекуле метана равноценны и направлены к вершинам тетраэдра. Это объясняется тем, что при образовании молекулы метана четыре ковалентные связи возникают не за счет «чистых» орбиталей, а за счет так называемых гибридных, то есть усредненных по форме и размерам (а следовательно, и по энергии), орбиталей.
Гибридизацией электронных орбиталей называют процесс их взаимодействия, приводящий к выравниванию по форме и энергии.
Число гибридных орбиталей равно числу исходных орбиталей. Гибридные орбитали выгоднее по геометрической форме, чем s- и р-орбитали, их электронная плотность распределена иначе, что обеспечивает более полное перекрывание с в-орбиталями атомов водорода, чем было бы у «чистых» s- и р-орбиталей.
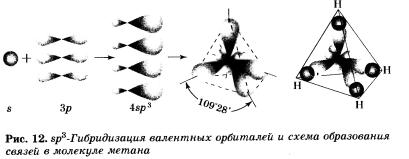
В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода находятся в состоянии sр3-гибридизации, то есть у атома углерода гибридизации подверглись одна s- и три р-орбитали и образовались четыре одинаковые гибридные вр3-орбита-ли.
В результате перекрывания четырех гибридных sр3-орби-талей атома углерода и в орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми гамма-связями под углом в 109°28' (рис. 12).
Этот тип гибридизации атомов и, следовательно, тетраэдрическое строение будет характеризовать также молекулы соединений аналога углерода — кремния: SiН4, SіСl4.
А в молекулах воды и аммиака происходит sр3-гибридизация орбиталей атомов кислорода и азота. Однако если у атома углерода все четыре гибридные sр3-орбитали заняты общими электронными парами, то у атома азота одна ер-орбиталь занята неподеленной электронной парой, а у атома кислорода ими заняты уже две sр3-орбитали.
Таким образом, на изменение величины угла связей в тетраэдре (109°28') оказывают действие отталкивающие свойства неподеленных (свободных) электронных пар, занимающих гибридные sр3-орбитали: у атома азота одна электронная пара (< Н—N—Н = 107°30'), а у атома кислорода — две (< Н—О—Н = 104°27').
sр3-Гибридизация наблюдается не только у атомов в сложных веществах, но и у атомов в простых веществах. Например, у атомов такой аллотропной модификации углерода, как алмаз.
В молекулах некоторых соединений бора имеет место sр2-гибридизация внешних орбиталей атома бора.
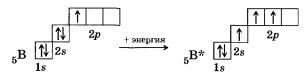
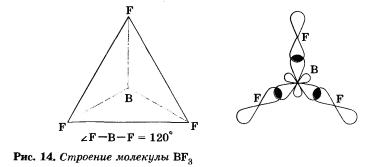
У атома бора в возбужденном состоянии в гибридизации участвуют одна изs- и две р-орбитали, в результате чего образуются три §р2-гибридные орбитали, расположенные в плоскости под углом 120° друг к другу (рис. 13).
Поэтому молекулы таких соединений, например ВF3, имеют форму плоского треугольника (рис. 14).
В органических соединениях, как вы знаете, sр2-гибридизация характерна для атомов углерода в молекулах алкенов по месту двойной связи, чем и объясняется плоскостное строение этих частей молекул, а также молекул диенов и аренов. sр2-Гибридизация наблюдается также у атомов углерода и в такой аллотропной модификации углерода, как графит.
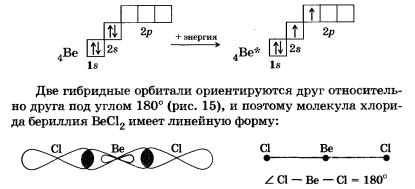
В молекулах некоторых соединений бериллия наблюдаетсяsр-гибридизация внешних орбиталей возбужденного атома бериллия.
Аналогичный тип гибридизации электронных орбиталей существует у атомов углерода в алкинах — углеводородах ряда ацетилена — по месту тройной связи.
Такая гибридизация орбиталей характерна для атомов углерода в еще одной его аллотропной модификации, карбине:
...-С-= С -С-=С- ...
В таблице 8 приведены виды геометрических конфигураций молекул, соответствующие некоторым типам гибридизации орбиталей центрального атома А с учетом влияния числа свободных (несвязывающих) электронных пар.
Таблица 8 Геометрические конфигурации молекул, соответствующие различным типам гибридизации — внешних электронных орбиталей центрального атома
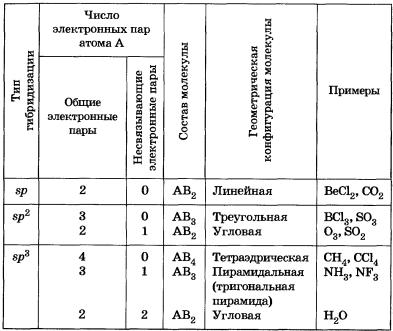
1. В молекулах водородных соединений углерода, азота и кислорода СН4, NН3 и Н20 валентные орбитали центральных атомов неметаллов имеют одинаковое состояние sр3-гибридизации, но разные углы между связями — 109°28', 107°30' и 104°27' соответственно. Чем это можно объяснить?
2. Почему графит электропроводен, а алмаз нет?
3. Какую геометрическую форму будут иметь молекулы двух фторидов — бора и азота (ВF3 и NF3 соответственно)? Дайте обоснованный ответ.
4. Молекула фторида кремния SiF4 имеет тетраэдрическое строение, а молекула хлорида брома ВСl3 — форму треугольника — плоскостное. Почему?
подсказки для учеников 11 класса, методические рекомендации для учителей, тесты и решения к ним
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|



















