|
Версия 19:56, 5 июля 2010
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Электролитическая диссоциация
В первой половине XIX в. М. Фарвдей ввел понятие об электролитах и неэлектролитах. Электролитами он назвал вещества, водные растворы которых проводят электрический ток) а неэлектролитами — веществе, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Арреииус (1859—1927) в 1887 г. предложил теорию электролитической диссоциации.
Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Но эта теория не ответила на некоторые вопросы: почему одни вещества являются электролитами, а другие нет? Какую роль в образовании ионов играет растворитель?
Представления о диссоциации электролитов получили развитие в работах русских химиков И. А. Каблукова и В. А. Кистаковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д. И. Менделеева. Как известно, он экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. .Эти ионы связаны с молекулами воды, то есть являются гид рати ронянными. Гидратированные ионы в растворе находятся в постоянном хаотическом движении. Бели же в этот раствор поместить противоположно заряженные электроды, то положительные ионы начнут двигаться к катоду — их назвали катионами, а отрицательные будут двигаться к аноду — и потому их назвали анионами.
Проникнуть в сущность процесса электролитической диссоциации помогло установление природы химической связи.
Вы, очевидно, помните синие кристаллы медного купороса, эту окраску ему придают гидратированные ноны меди.
По свойствам ионы отличаются от атомов. Так, атомы натрии образуют простое вещество — металл натрий. Он активно взаимодействуете водой, вытесняя водород, а гидратированные ионы натрия этой способностью не обладают. Атомы хлора объединяются в двухатомные молекулы Сl2. Простое вещество хлор Сl2 имеет желто-зеленую окраску, удушливый запах, а гидратированные ионы хлора бесцветны и не имеют запаха. Молекулы водорода, состоящие из двух атомов Н... образуют бесцветный горючий газ, который плохо растворяется в воде, а ноны водорода не горят и существуют в водных растворах в виде иона оксония CuS04, окрашивающего лакмус в красный цвет.
Электролитами могут быть только вещества с ионной и ковал ент ной полярной связями. Вы знаете такие вещества — это соли, основания, кислоты. Вспомните определения классов этих веществ с точки зрения теории электролитической диссоциации.
Степень электролитической диссоциации. Сильные и слабые электролиты
С. Аррениус для количественной характеристики электролитической диссоциации ввел понятие степени электроли-тической диссоциации, обозначаемой греческой буквой a.
Степень электролитической диссоциации — это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул .
a=Число молекул, распавшихся на ион/ Общее число растворенных молекул
Если а = 0, то вещество совсем не распадается на ионы, оно является неэлектролитом. К неэлектролитам относятся вещества с ковал битным и малополярными и менолярныыи связями, такие, как эфиры, углеводороды, кислород, азот и др.
Степень электролитической диссоциации может иметь значение от 0 до 1(в процентах от 0 до 100%).
Сильные электролиты — это такие электролиты, которые в водных растворах (даже концентрированных) практически полиостью диссоциируют на ноны. У таких электролитов степень диссоциации стремится к 1 (100%). К сильным электролитам относятся почти все соли, неорганические кислоты, щелочи.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. Их степень диссоциации значительно меньше 1 (100%), в большинстве случаев она стремится к нулю. Но при разбавлении, как вы помните, степень диссоциации увеличивается.
К слабым электролитам относятся: многие неорганические кислоты , органические кислоты, основания (за исключением щелочей), гидрат аммиака , некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между педиссоцииро ванны ми молекулами и ионами.
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия.
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации. Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадется на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Фториводородная кислота более сильный электролит, чем уксусная.
Многоосновние кислоты, а также миогокпелотные основания диссоциируют ступенчато.
Диссоциация воды. Водородный показатель. Среды водных растворов электролитов
Вода, как было отмечено ранее, слабый электролит. Без учета гидратации ионов Н2 уравнение диссоциации воды имеет вид:
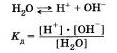
Произведение концентрации ионов водорода и гидроксид-ионов называют ионным произведением воды.
В разбавленных водных растворах электролитов, как и в воде, произведение концентраций ионов водорода Н2 и гидроксид-ионов ОН — величина постоянная при определенной температуре. Ионное произведение воды дает возможность вычислить концентрацию гидроксид-ионов ОН" в любом водном растворе, если известна концентрация ионов водорода Н и наоборот.
Различают три типа сред: нейтральную, щелочную, кислотную.
Нейтральная — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
[Н+] = [ОН-] =10-7 моль/л
Кислотная — это среда, в которой концентрация ионов водорода больше концентрации гндроксид-ионов:
[Н+] > [ОН-], [Н+] > 10-7 моль/л
Щелочная — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
[Н+] < [0Н-], [Н+] < 10-7 моль/л
Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш), введенный датским химиком Серенсеном.
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода.
Чем рН больше 7, тем больше щелочность раствори. Наглядно зависимость между концентрацией ионов водорода, значением рН с реакцией среды раствора показана на схеме:
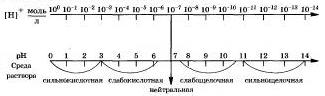
Существуют различные методы измерения рН. Качественно тип среды и рН водных растворов электролитов определяют с помощью индикаторов — веществ, которые обратимо изменяют свой цвет в зависимости от среды растворов, то есть рН растворов. На практике, кик вы знаете. дли зтого применяют такие индикаторы, как лакмус, метиловый оранжевый, фенолфталеин, универсальный.
Водородный показатель имеет большое значение в химических и биологических процессах, так как в зависимости от типа среды эти процессы могут протекать с разными скоростями и в разных направлениях.
Измерение рН крови или желудочного сока является диагностическим тестом в медицине.
Свойства растворов электролитов
Свойства растворов слабых электролитов обусловлены и молекулами, и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул СН3СООН. кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов Н*.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Например, общие свойства кислот, такие, как кислый вкус, изменение окраски индикаторов и др.. обусловлены наличием в их растворах катионов водорода Н~ (точнее ионов Н30+). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др. связаны с присутствием в их растворах гидроксид-ионов ОН-, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как вы знаете, большая скорость многих химических реакций в растворах электролитов объясняется тем. что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, то есть протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ноны, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
СН3СО0Н + КОН СН3СО0К + H2O
слабый слабый
электролит электролит
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
1. Какие вещества относят к электролитам, а какие — к неэлектролитам ?
2. Какие из следующих жидкостей проводит электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор натрия, раствор кислорода в воде, водный раствор карбоната натрия, расплав гидроксида калия? Ответ объясните.
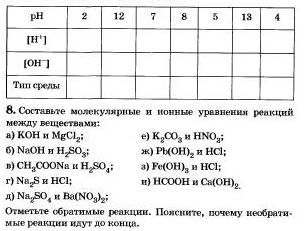
3*. Заполните следующую таблицу:
9. Определите возможность протекания реакций обмена между водными растворами веществ:
а) сульфата калия и гилроксилн бария;
б) карбонита натрия и хлорида кальция; нитрита меди(ІІ) и сульфата железа(ІІ);
г) пцроксцяа натрия и серной кислоты;
д) сульфита калия и азотной кислоты;
е) нитрата алюминия и хлорида калия.
Составьте уравнения возможных реакций в молекулярной, полной и сокращенной ионных формах.
элементы новаторства на уроке химии, химия 11 класс, фишки для любознательных
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|