|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Багатоманітність речовин. Прості й складні речовини. Метали й неметали. Повні уроки
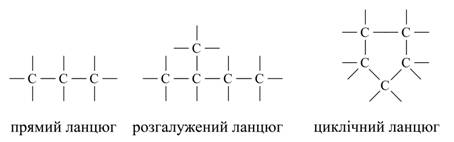
В даний час відомо близько 400 алотропних видозмін простих речовин. Різноманіття складних речовин зумовлена їх різним якісним і кількісним складом. Наприклад, відомо для азоту п'ять форм оксидів: N2O, NO, N2O3, NO2, N2O5; для водню дві форми: Н2О і Н2О2 і ін. З точки зору теорії будови атома кількісний склад неорганічних сполук визначається кількістю електронів в електронній оболонці атома і кількістю протонів і нейтронів в атомному ядрі. Органічних речовин в даний час описано близько двох мільйонів, і щорічно вчені-хіміки усього світу синтезують близько 30000 нових речовин, в той час як неорганічних речовин налічується кілька сотень тисяч. У зв'язку з цим виникає питання: як пояснити таке різноманіття органічних речовин? Пояснюється це наступним. Так як до складу молекул органічних речовин в якості обов'язкового елемента входить вуглець, то, очевидно, він і визначає різноманіття, властивості і особливості органічних речовин. Вуглець в періодичній системі займає положення між типовими металами і неметалами. Як по відношенню до кисню, так і до водню він однаково чотиривалентним. Його атоми здатні з'єднуватися з атомами великого числа інших хімічних елементів. Крім того, атоми вуглецю здатні до взаємного з'єднання з утворенням лінійних, розгалужених і кільчастих ланцюжків, наприклад:
Контролюючий блок №1 1. Розкажіть чим зумовлена різноманіття складних речовин? 2. Як пояснити таке різноманіття органічних речовин? 3. Приведіть приклади ланцюгів атомів вуглецю.
Частина 2 Прості й складні речовини Хімічні речовини підрозділяються на прості і складні. Прості речовини — це речовини, утворені з атомів одного елемента. Наприклад, проста речовина вугілля утворене атомами елемента вуглецю, простої речовина залізо — атомами елемента заліза, простої речовина азот — атомами елемента азоту. Поняття “проста речовина” не можна ототожнювати з поняттям “хімічний елемент”. Проста речовина характеризується визначеною щільністю, розчинністю, температурами плавлення і кипіння і т.п. Ці властивості відносяться до сукупності атомів і для різних простих речовин вони різні. Хімічний елемент характеризується визначеним позитивним зарядом ядра атома порядковим номером), ступенем окислювання, ізотопною сполукою і т.д. Властивості елементів відносяться до його окремих атомів. Складні речовини, чи хімічні сполуки, — це речовини, утворені атомами різних елементів. Так, оксид міді (II) утворений атомами елементів міді і кисню, вода — атомами елементів водню і кисню. Малюнок 3. Кристалічна решітка оксиду міді
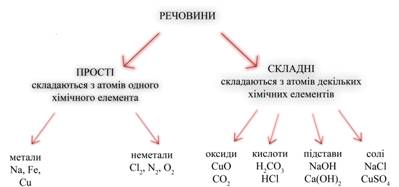
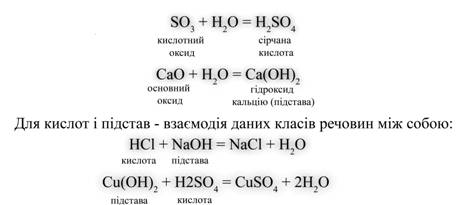
Складні речовини складаються не з простих речовин, а з елементів. Наприклад, вода складається не з простих речовин водню і кисню, а з елементів водню і кисню. Назви елементів звичайно збігаються з назвами відповідних їм простих речовин (виключення: вуглець і одне з простих речовин кисню — озон). Які ж бувають речовини? Відповіддю на це питання може служити схема, в основі якої лежить класифікація речовин за кількісним та якісним складом. Використовуючи схему, можна коротко охарактеризувати речовини прості і складні, склад речовин різних класів, навести приклади.  Малюнок 4. Схема розподілу речовин Звернемо увагу на схему на якому зображена таблиця розподілу речовин: складні речовини у свою чергу також поділяються – Оксиди - це складні речовини, що складаються з двох елементів, один з яких кисень. Кислоти - це електроліти, при дисоціації яких з позитивних іонів утворюються тільки іони водню (Н +). Підстави - це електроліти, при дисоціації яких з негативних іонів утворюються тільки гідроксид-іони (ОН-). Солі - це електроліти, при дисоціації яких утворюються катіони металів і аніони кислотного залишку. Далі слід привести рівняння реакцій, що характеризують основні властивості кожного класу сполук. Для оксидів такою властивістю є взаємодія з водою: Файл:Him7 8 6.gif
Більшість неметалів - Гази; тверді ж неметали, як правило, тендітні, іноді прозорі і не проводять електрики. Неметали - прості хімічні речовини, які з металами мають схожість і відмінність. Відмінності у властивостях металів і неметалів стають зрозумілими, якщо знати будову їх атомів, їх електронну конфігурацію. Зовнішня електронна оболонка атомів металів заповнена менше ніж наполовину, тому, вступаючи в хімічні реакції, всі метали прагнуть позбутися від зовнішніх електронів, набуваючи стабільну електронну конфігурацію Таким чином, вони схильні утворювати позитивні іони. Саме ці зовнішні (рухливі) електрони відповідають за електропровідність металів, а також за їх механічні властивості. Навпаки, зовнішня електронна оболонка атомів неметалів практично не заповнена. Малюнок 7. Таблиця «Неметали. Галогени» До неметалів, зокрема, відносяться інертні гази, у яких на зовнішній електронній оболонці максимальне число електронів: у гелію два, у решти вісім. У хімічних реакціях неметали або приєднують електрони, перетворюючись в негативні іони, або утворюють ковалентний зв'язок.
Над уроком працювали Горбатко С. М. Літвін Л. В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: