|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Розрахунки за хімічними рівняннями маси та кількості речовини
Тобі треба
знати: алгоритм розв'язування розрахункової задачі;
уміти обчислювати: масу речовини за відомою кількістю речовини; кількість речовини за відомою масою; об'єм газуватої речовини (н. у.) за відомою масою або кількістю речовини.
Ти вже знаєш, що хімічне рівняння — умовний запис хімічної реакції за допомогою хімічних формул. Його складають на основі закону збереження маси речовин, згідно з яким маса речовин, що вступають у реакцію, дорівнює масі речовин, що утворюються внаслідок реакції. Добираючи коефіцієнти до формул речовин, ти зрівнюєш число атомів кожного елемента в лівій і правій частинах і дістаєш хімічне рівняння, що відповідає закону збереження маси.
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній
За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини і їх позначення (табл. 2).
Таблиця 2. Співвідношення деяких фізико-хімічних величин та одиниць вимірювання
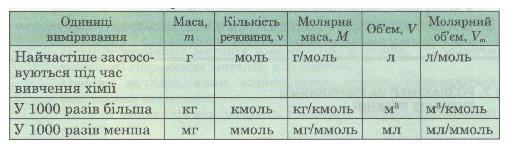
Рівняння хімічної реакції дає змогу здійснювати розрахунки маси, об'єму або кількості речовини вихідних речовин чи продуктів реакції.
Розглянемо конкретні приклади.
Приклад 1. Яку масу гашеного вапна Са(ОН)2 можна добути внаслідок взаємодії з водою кальцій оксиду масою 280 г?
Передусім запиши скорочену умову задачі та склади рівняння хімічної реакції.
Дано:
m(СаО) = 280 г
m(Са(ОН)2) — ?
Розв'язування:
СаО + Н20 = Са(ОН)2
Варіант 1
Прочитай ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами простав вихідні дані з умови задачі:
280 г х
СаО + Н20 = Са(ОН)2
Під формулами речовин запиши дані, які можна дістати з рівняння реакції:
280 г х
СаО + Н20 = Са(ОН)2
_______________ __________________
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/моль
v = 1 моль v = 1 моль
m = 1 моль•56 г/моль = 56 г m = 1 моль•74 г/моль = 74 г
Розв'язання задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин
З рівняння реакції виходить, що внаслідок взаємодії з водою 56 г СаО можна добути 74 г гашеного вапна Са(ОН)2, а якщо взяти не 56 г, а 280 г СаО, то можна добути гашеного вапна у стільки разів більше, у скільки 280 г більше за 56 г. Тобто ти бачиш, що між величинами існує пряма пропорційна залежність. Отже, ти можеш скласти пропорцію і розв'язати її:
56 г : 280 г = 74 г : х;
x = (280 г • 74 г)/(56 г) = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Варіант 2
СаО + Н20 = Са(ОН)2
<sub</sub>___________ ________________
v = 1 моль v = 1 моль
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/моль
Обчисли, яку кількість речовини становлять 280 г.
v = m/M; v(CaO)=(280 г)/(56 г/моль) = 5 моль.
З рівняння реакції видно, якщо взаємодіє з водою кальцій оксид кількістю речовини 1 моль, то й утворюється кальцій гідроксид кількістю речовини 1 моль.
Отже, якщо в реакцію вступає кальцій оксид кількістю речовини 5 моль, то й утвориться кальцій гідроксид кількістю речовини 5 моль, тобто:
m = v • М.
m(Са(ОН)2) = 5 моль • 74 г/моль = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Приклад 2. Яка кількість речовини нітроген(V) оксиду прореагувала з водою, якщо утворилася нітратна кислота HN03 кількістю речовини 10 моль?
Дано: v(HN03) = 10 моль
v(N205)-?
Розв'язування:
х 10 моль
N205 + Н20 = 2HN03
1 моль : х = 2 моль : 10 моль;
х = (1 моль • 10 моль)/(2 моль) = 5 моль
Відповідь. Якщо утворилася нітратна кислота HN03 кількістю речовини 10 моль, то з водою прореагував нітроген(У) оксид кількістю речовини 5 моль (v(N205) = = 5 моль).
Приклад 3. Магній масою 3 г взаємодіє з киснем. Яка кількість речовини магній оксиду утвориться при цьому?
Дано: m(Mg) = 3 г
v(MgO) — ?
Розв'язування:
З г х
2Mg + 02 = 2MgO
v = 2 моль v = 2 моль
Оскільки відносно магнію виявились різні одиниці вимірювання (грами і молі), треба визначити, яку кількість речовини становлять 3 г магнію:
n = m/M M(Mg) = 24 г/моль;
v(Mg) = (3 г)/(24 г/моль) = 0,125 моль
Рівняння реакції показує, якщо у взаємодію з киснем вступає 2 моль магнію, то утворюється 2 моль MgO. Отже, якщо в реакцію вступає 0,125 моль Mg, то й утворюється 0,125 моль MgO.
Відповідь. Якщо з киснем взаємодіє магній масою 3 г, то утворюється магній оксид MgO кількістю речовини 0,125 моль (v(MgO) = 0,125 моль).
Приклад 4. Який об'єм кисню (н. у.) необхідний для окиснення алюмінію масою 54 г?
Дано:
m(Аl) = 54 г
V(O2)-?
Розв'язування:
Варіант 1
4А1 + 302 = 2А1203
v = 4 моль v = 3 моль
М = 27 г/моль Vm = 22,4 л/моль
V = 22,4 л/моль • 3 моль = 67,2 л
v = m/M; v(Al) = (54 г)/(27 г/моль) = 2 моль
4 моль : 2 моль = 67,2 л : х;
2 моль -67,2 л оп п
х = (2 моль • 67,2 л)/(4 моль) = 33,6 л.
Відповідь. Для окиснення алюмінію масою 54 г необхідно витратити кисень об'ємом 33,6 л (н. у.) (У(02) = 33,6 л).
Варіант 2
54 г х
4А1 + 3О2 = 2Аl203
v = 4 моль v = 3 моль
М- 27 г/моль Vm = 22,4 л/моль
m = 27 г/моль • 4 моль = 108 г V = 22,4 л/моль • 3 моль = 67,2 л
108 г : 54 г = 67,2 л : х;
x = (54г • 67,2 л)/(108 г) = 33,6 л.
Відповідь. Для окиснення алюмінію масою 54 г необхідно витратити кисень об'ємом 33,6 л (н. у.) (V(02) = 33,6 л).
Для розв'язування задачі треба знати формули, що виражають взаємозв'язок між величинами
Виконуючи дії з іменованими числами і використовуючи при цьому будь-які зручні одиниці вимірювання, стеж за тим, у яких одиницях має бути відповідь.
Зверни увагу, майже кожна хімічна задача може бути розв'язана кількома способами. Намагайся знаходити різні варіанти розв'язування конкретної задачі, а обирай той з них, який є найраціо-нальнішим.
Для розв'язування розрахункової задачі використовуй такий алгоритм:
1. Запиши скорочену умову задачі.
2. Склади рівняння хімічної реакції.
3. Підкресли в рівнянні формули речовин, про які йдеться в умові задачі (відомої і невідомої).
4. Над формулами речовин з умови задачі запиши відому величину й невідому з відповідними одиницями вимірювання (йдеться лише про чисті речовини, без домішок).
5. Під формулами речовин з відомою і невідомою величиною запиши відповідні значення цих величин, знайдені за рівнянням реакції.
6. Склади й розв'яжи пропорцію на підставі двох даних, узятих з рівняння реакції, і двох даних — з умови задачі.
7. Запиши повне формулювання відповіді.
ВИСНОВКИ
Рівняння хімічної реакції відображає матеріальний баланс процесу, тому воно дає змогу здійснювати розрахунки маси, об'єму або кількості речовини продуктів реакції чи вихідних речовин.
Щоб розв'язати хімічну задачу треба правильно написати формули речовин, вміти правильно скласти рівняння хімічної реакції і пам'ятати, що розв'язування задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин.
Для розв'язування задачі треба знати формули, що виражають взаємозв'язок між величинами (див. форзац).
Можна використовувати будь-які величини, але для кожної з речовин (чи взятої з умови задачі, чи з рівняння реакції) потрібно застосовувати одну й ту саму величину.
Завдання для самоконтролю
1. У виробництві гуми як наповнювач використовують сажу (являє собою майже чистий вуглець). її добувають неповним спалюванням природного газу метану СН4 за рівнянням
СН4 + 02 = С + 2Н20
Обчисли масу метану, необхідного для добування сажі масою 1000 т.
2. Унаслідок взаємодії магнію кількістю речовини 0,1 моль з киснем утворюється магній оксид масою (а) 1г; (б) 2 г; (в) 3 г; (г) 4 г.
3. Якщо в кисні спалити 4 г кальцію, то при цьому утвориться кальцій оксид масою (а) 112 г; (б) 11,2 г; (в) 5,6 г; (г) 2,8 г.
4. Якщо утворився купрум(ІІ) оксид масою 4 г, то з міддю прореагував кисень кількістю речовини і масою
(а) 0,025 моль, 0,8 г; (в) 1 моль, 160 г;
(б) 0,05 моль, 1,6 г; (г) 2 моль, 320 г.
5. Об'єм вуглекислого газу (н. у.), що утворюється внаслідок повного згоряння вуглецю кількістю речовини 0,3 моль, становить
(а) 3,36 л; (б) 6,72 л; (в) 13,44 л; (г) 22,2 л.
Додаткові завдання
6. Обчисли маси ртуті й кисню, необхідні для добування меркурій(ІІ) оксиду кількістю речовини 0,1 моль.
7. В якому випадку витратиться більший об'єм кисню (н. у.) — у разі спалювання літію кількістю речовини 1 моль чи спалювання такої ж кількості речовини кальцію? Відповідь підтвердь розрахунком.
8*. У зерносховищах для звільнення приміщення від шкідників зерна часто спалюють сірку з розрахунку, аби кожний кубічний метр повітря містив не менше, як 50 г сульфур(ІV) оксиду S02. Обчисли масу сірки, яку потрібно спалити в приміщенні об'ємом 5000 м3.
9*. Барій спалили в кисні об'ємом 5,6 л (н. у.). Яку масу барій гідроксиду Ва(ОН)2 можна добути з утвореного оксиду?
10*. Фосфор масою 248 г спалили в кисні. Утворений оксид прокип'ятили з водою. Яка кількість речовини і якої з фосфатних кислот утворилася при цьому?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Шкільна бібіотека онлайн, підручники по всім предметам, уроки хімії для учнів 8 класів
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











