|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Фізичні властивості основ. Класифікація основ. Хімічні властивості основ: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації. Розкладання нерозчинних основ під час нагрiвання. Заходи безпеки під час роботи з лугами. Використання основ
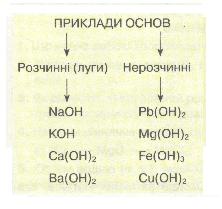
Класифікація основ. За розчинністю у воді основи поділяють на:
а) розчинні, або луги, — NaOH, КОН, Са(ОН)2, Ва(ОН)2 тощо;
б) нерозчинні — купрум(ІІ) гідроксид Си(ОН)2, ферум(ІІІ) гідроксид Fe(OH)3 та ін.
Фізичні властивості основ. За стандартних умов усі луги — тверді речовини білого кольору, добре розчинні у воді. NaOH і КОН — милкі на дотик, дуже їдкі. Вони роз'їдають шкіру, тканини, папір та інші матеріали. За цю властивість їх називають їдкими лугами. Так, натрій гідроксид NaOH — їдкий натр, а калій гідроксид КОН — їдке калі.
Їдкі луги (NaOH, КОН) роз'їдають шкіру, тканини та інші речовини, їх не можна брати руками (спричиняють опіки), а тільки пінцетом
Чи знаєш ти, звідки походить слово «луг»? Так називали милкий настій попелу, що використовувався для прання
У зв'язку з тим, що кристалічні їдкі луги, що потрапили на шкіру, спричиняють опіки, їх не можна брати руками, а тільки пінцетом. Якщо ж розчин лугу все ж таки потрапив на шкіру, необхідно відразу ж змити його великою кількістю води, аж доки щезне відчуття милкості, а потім нейтралізувати розчином борної кислоти Н3ВО3.
Нерозчинні основи також тверді речовини, але вони по-різному забарвлені. Так, купрум(ІІ) гідроксид Сu(ОН)2 має блакитний із зеленкуватим відтінком колір, ферум(ІІІ) гідроксид Fe(OH)3 — бурий, a Fe(OH)2 — блідо-зеленкуватий, майже білий.
Хімічні властивості основ. Хімічні властивості лугів різноманітніші, ніж нерозчинних гідроксидів. Для ознайомлення з ними виконай лабораторні досліди, наведені нижче.
Дослід 1. У дві пробірки налий розчини: в першу — натрій гідроксиду, в другу — кальцій гідроксиду, а в третю — насип трохи ферум(ІІІ) гідроксиду і додай сюди 1—2 мл води. У кожну пробірку додай по 1—2 краплі фенолфталеїну (або лакмусу). Що спостерігаєш? Що це засвідчує? Далі до вмісту перших двох пробірок краплями додавай розбавленої хлоридної кислоти до повної нейтралізації лугу — натрій гідроксиду та кальцій гідроксиду. Що спостерігаєш? Які речовини утворилися? Запиши рівняння відповідних реакцій:
NaOH + НСІ = NaCl + Н20
Са(ОН)2 + 2НСl = СаСl2 + 2Н20
Дослід 2. На дно двох пробірок поклади за допомогою мікрошпателя або лопатки: в першу — купрум(ІІ) гідроксид, у другу — ферум(ІІІ) гідроксид. В одну пробірку долий 0,5 мл розбавленої хлоридної кислоти, а в другу — стільки само розчину сульфатної кислоти. Перемішай вміст пробірок струшуванням. Що спостерігаєш? Якого кольору набули розчини? Які нові речовини утворилися? Запиши рівняння реакцій:
Cu(OH)2 + 2НСІ = СuСІ2 + 2Н20
2Fe(OH)3 + 3H2S04 = Fe2(S04)3 + 6Н20
Реакції між основами і кислотами, внаслідок яких утворюються сіль і вода, називають реакціями нейтралізації. Вони належать до реакцій обміну.
Дослід 3. У пробірку налий 1 мл вапняної води (прозорий розчин кальцій гідроксиду Са(ОН)2). Через одноразову скляну трубочку (або поліетиленову для коктейлю) обережно видихай повітря у вапняну воду. Розчин каламутніє, оскільки утворюється нерозчинна сіль СаС03 — кальцій карбонат:
Са(ОН)2 + С02 = СаС03 і + Н20
Що засвідчує даний дослід? Дослід засвідчує те, що розчинні основи (луги) можуть взаємодіяти з оксидами неметалів, тобто кислотними оксидами, утворюючи сіль і воду.
Зверни увагу, утворюється сіль тієї кислоти, яка відповідає даному кислотному оксиду. У даному разі кислотному оксиду С02 відповідає кислота Н2С03, ось чому у формулі солі поряд з хімічним символом металу Са стоїть не оксид С02, а кислотний залишок С03 тієї кислоти, яка відповідає цьому оксиду.
Дослід 4. На дно сухої пробірки вмісти трохи купрум(ІІ) гідроксиду. Пробірку закріпи похило в тримачі лабораторного штатива. Спочатку прогрій усю пробірку, а потім нагрівай те місце, де міститься купрум(ІІ) гідроксид. Які зміни відбуваються з речовиною? Що спостерігаєш на стінках пробірки? Якого кольору утворюється нова тверда речовина? Запиши рівняння реакції:
t
Cu(OH)2 = CuO + Н20
блакитний чорний
Отже, нерозчинні основи під час нагрівання розкладаються на оксид металу (основний оксид) і воду.
Реакції нейтралізації належать до реакцій обміну
Узагальнимо набуті знання, порівнюючи хімічні властивості розчинних і нерозчинних основ (табл. 6).
Таблиця 6. Хімічні властивості основ

Застосування основ. Натрій гідроксид NaOH використовують у виробництві мила, паперу, штучного волокна, для очищення нафтопродуктів. Калій гідроксид КОН — у виробництві рідкого мила та як електроліт для лужних акумуляторів. Кальцій гідроксид Са(ОН)2 (гашене вапно) — як будівельний матеріал.
Чи знаєш ти, що суміш піску, подрібненого каменю та вапна Са(ОН)2 використовували в будівельній справі ще 2 000 років тому?
ВИСНОВКИ
Основи мають немолекулярну будову. Завдяки наявності гідроксильної групи в їхньому складі, водні розчини основ (луги) мають спільні властивості — змінюють колір індикаторів: лакмус у лужному середовищі синіє, фенолфталеїн набуває малинового забарвлення, а метилоранж — жовтого. Нерозчинні основи на індикатори не діють.
Спільною властивістю для всіх основ (і розчинних, і нерозчинних) е здатність взаємодіяти з кислотами, тобто вступати в реакцію нейтралізації, утворюючи сіль і воду. Розчинні основи — луги — взаємодіють з кислотними оксидами (оксидами неметалів), утворюючи сіль тієї кислоти, що відповідає взятому оксиду, і воду.
Нерозчинні основи, на відміну від лугів, розкладаються під час нагрівання на основний оксид і воду.
Завдання для самоконтролю
1. Які речовини належать до основ і як їх класифікують? Наведи приклади.
2. Чому гідроксильна група має валентність 1?
3. Розкажи, що тобі відомо про натрій гідроксид?
4. Напиши рівняння реакцій, які ілюструють властивості таких основ: КОН і Fe(OH)3.
5. Як здійснити такі перетворення:
Са → СаО → Са(ОН)2 → Ca(N03)2? Напиши відповідні рівняння реакцій.
6. Де більша масова частка Купруму: у купрум(І) гідроксиді чи у купрум(ІІ) гідроксиді? Відповідь обґрунтуй, не вдаючись до обчислень.
7. Який об'єм (н.у.) сульфур(І\/) оксиду можна поглинути розчином, що містить барій гідроксид кількістю речовини 3 моль?
Додаткові завдання
8. У результаті прожарювання алюміній гідроксиду масою 312 т можна добути алюміній оксид масою
(а) 21 т; (б) 51 т; (в) 102 т; (г) 204 т.
9. Як здійснити такі перетворення: Р → Р205 → Н3Р04 → Мg3(Р04)2? Напиши відповідні рівняння реакцій.
10*. Який об'єм (н. у.) водню виділиться, якщо розчинити у воді лужний метал кількістю речовини 1 моль?
11 *. До розчину, що містить 2 моль натрій гідроксиду, додали розчин, що містить 2 моль сульфатної кислоти. Утворений розчин випарили досуха. Яка сіль утворилася при цьому? Визнач масу цієї солі.
12*. Скільки молекул води припадатиме на кожну молекулу натрій гідроксиду в розчині, добутому дією натрію масою 2,3 г на воду масою 19,8 г?
13*. Унаслідок спалювання двовалентного металу масою 6 г утворився його оксид масою 8,4 г. Який це метал? Яку масу гідроксиду цього металу можна добути, якщо утворений оксид розчинити у воді?
14*. Унаслідок взаємодії з водою одновалентного металу масою 19,5 г виділився водень об'ємом 5,6 л (н.у.). Назви метал і обчисли кількість речовини води, необхідної для взаємодії з металом зазначеної маси.
Скачати підручник з хімії 8 клас, допомога учням, шкільна програма онлайн
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












