|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Електронні формули молекул речовин
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%90%D1%82%D0%BE%D0%BC%D0%B8_%D0%93%D1%96%D0%B4%D1%80%D0%BE%D0%B3%D0%B5%D0%BD%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D0%B2%D0%BE%D0%B4%D0%BD%D1%8E.jpg|[[Image:|Image:Атоми Гідрогену в молекулі водню.jpg]]]] [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D1%96%D0%B4%D0%B2%D0%B8%D1%89%D0%B5%D0%BD%D0%B0_%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0_%D0%B3%D1%83%D1%81%D1%82%D0%B8%D0%BD%D0%B0.jpg|[[Image:|Image:Підвищена електронна густина.jpg]]]] Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений: [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A3%D1%82%D0%B2%D0%BE%D1%80%D0%B5%D0%BD%D0%BD%D1%8F_%D0%BA%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D0%B3%D0%BE_%D0%B7%D0%B2%27%D1%8F%D0%B7%D0%BA%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D1%84%D1%82%D0%BE%D1%80%D1%83_F.jpg|[[Image:|Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg]]]] [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D0%B5%D1%80%D0%B5%D0%BA%D1%80%D0%B8%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%85%D0%BC%D0%B0%D1%80_%D0%B4%D0%B2%D0%BE%D1%85_%D0%BD%D0%B5%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D1%85_%D1%80-%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D1%96%D0%B2.jpg|[[Image:|Image:Перекривання хмар двох неспарених р-електронів.jpg]]]] [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A1%D0%BF%D1%96%D0%BB%D1%8C%D0%BD%D0%B0_%D0%B5%D0%BB._%D0%BF%D0%B0%D1%80%D0%B0_-2.jpg|[[Image:|Image:Спільна ел. пара -2.jpg]]]] У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
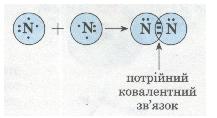
Схеа утворення потрійного ковалентного зв'язку в молекулі азоту N2:
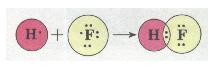
Ковалентний полярний зв'язок у молекулі флуороводню HF:
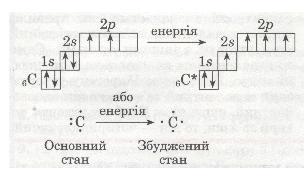
Згадаємо електронну формулу Карбону:
Н.М. Буринська, Хімія, 8 клас
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: