|
Гипермаркет знаний>>Химия>>Химия 7 класс>> Феррум. Железо. Экспериментируем дома. Ржавление железа. Для любознательных. О чугуне и стали
> о химическом элементе Ферруме и его распространенности в природе; Это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума играют особую роль в живой природе. ► Охарактеризуйте положение Феррума в периодической системе, укажите относительную атомную массу элемента, порядковый номер, заряд ядра атома и количество электронов в атоме. Атом Феррума может потерять 2 электрона и превратиться в ион Fe2+. Возможна потеря атомом еще и третьего электрона. В этом случае образуется ион Fe3+. Ионы Fe2+ содержатся в соединениях Ферру ма(II), a Fe3+ — в соединениях Феррума(III). ► Составьте формулы соответствующих оксидов Феррума.
Распространенность Феррума в природе. По распространенности в земной коре Феррум разделяет с Кальцием 6—7-е места (в каждой тысяче атомов содержится по 18 атомов этих элементов). Известно много природных соединений Феррума. Соединения Феррума с Оксигеном — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из крупнейших в мире. По утверждениям ученых, железо вместе с никелем образуют ядро нашей планеты. В организме взрослого человека содержится 3—5 г Феррума. Кроме соединений Феррума, в природе иногда встречается метеоритное железо. Небольшое количество Феррума содержится в природной воде (в виде ионов Fe2+). При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума. В живых существах Феррума очень мало. Ионы Fe2+ входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.
Железо. Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда человек использовал метеоритное железо, а позднее научился получать металл из руды.
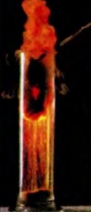
Физические свойства железа. Железо — серовато-серебристый пластичный металл, который плавится при температуре 1539 °С, притягивается магнитом. Образует много сплавов с различными металлами. Рассмотрите выданные вам железные предметы — гвозди, скрепки или кнопки. Опишите внешний вид металла. Поместите железный предмет в стакан с водой. Железо тяжелее или легче воды? Растворяется ли этот металл в воде? Выясните, притягивается ли железо магнитом. Закрепите железный предмет в щипцах или пробиркодержателе и нагревайте в пламени спиртовки (сухого горючего). Удается ли расплавить железо в таких условиях? Запишите результаты экспериментов. Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот металл самовозгорается на воздухе. Довольно чистое железо (например, метеоритное) не ржавеет. В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами1. При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла. Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла):
1 Реакции между металлами не происходят.
t Раньше с помощью этой реакции получали в промышленности водород. С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желтобурый налет — ржавчина. Разрушение железа под Использовав для ржавчины формулу Fe(OH)3, запишем уравнение реакции: 4Fe + 6Н20 + 302 = 4Fe(OH)3. Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).
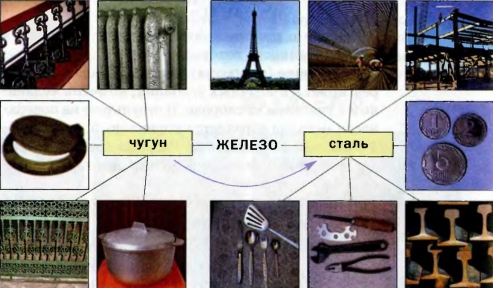
Применение железа. Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из Схема 10. стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, промышленное оборудование и т. п. (схема 10). Феррум — металлический элемент; его простое вещество — металл железо. Кроме атомов Феррума, существуют ионы Fe2+ и Fe3+, которые входят в состав соединений Феррума(II) и Феррума(III). Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами. Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода. Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией. Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем. Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях. 159. Сколько электронов содержат ионы Fe2+ и Fe3+? 160. Напишите формулы соединений Феррума с Флуором, которые содержат ионы Fe2+ и Fe3+. 161. Вычислите массовые доли Феррума в соединениях: a) FeO; б) Fe2O3; в) Fe3O4. t 165. В сплаве железа с марганцем массовая доля марганца равна 10 %, а примесей — 2%. Вычислите массу железа, которая содержится в 20 г сплава. 166. При нагревании 11,2 г железа с 6,4 г серы образовалось 13,2 г феррум(II) сульфида. Какой вывод можно сделать на основании результатов эксперимента? 167. в нержавеющей стали на каждые 10 атомов Феррума приходится 3 атома Хрома и I атом Никеля. Вычислите массовые доли металлов в этой стали. Докажем, что ржавление железа происходит при одновременном участии воды (водяного пара) и кислорода, а также ускоряется в растворе поваренной соли. Для опыта возьмите пять одинаковых чистых гвоздей длиной 2— 3 см, кнопок или скрепок и четыре аптечные бутылочки емкостью 100 мл с пробками. В первую бутылочку налейте водопроводной воды до половины объема, в другую — столько же свежепрокипяченной и охлажденной воды, в третью — такой же объем раствора поваренной соли в водопроводной воде, а в четвертую — воды слоем в 2— 3 мм. В первые три бутылочки с жидкостью погрузите по одному железному предмету, а в четвертой подвесьте предмет на нитке, чтобы он не касался воды. Все бутылочки закройте пробками. Пятый предмет положите возле бутылочек на чистый лист бумаги. Дважды в день рассматривайте железные предметы. Какой из них начинает ржаветь первым, а какой — последним? На всех ли предметах появляется ржавчина? Объясните результаты эксперимента и сделайте выводы. Примите во внимание, что из воды во время кипения выделяется растворенный воздух, а над водой всегда существует водяной пар. И чугун, и сталь можно упрощенно считать железом, содержащим примеси. Оба вещества различаются прежде всего внешним видом (сравните чугунную сковороду со стальной). Чугун — сероватый, со слабым металлическим блеском, а сталь — светлая и блестящая. Примесей в чугуне больше, чем в обычной стали. Они придают чугуну твердость, хрупкость. А сталь нехрупкая и поддается механической обработке. Чугун получают из железной руды с помощью химических реакций, а сталь — переплавкой чугуна в определенных условиях (рис. 70). Отрасль промышленности по производству чугуна и стали называют черной металлургией. По объему ее продукции Украина занимает одно из ведущих мест в мире.
Содержание урока Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: