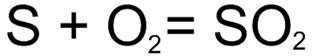|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Оксиди, їх склад, назви. Повні уроки
Тема
Мета уроку
Задачі уроку
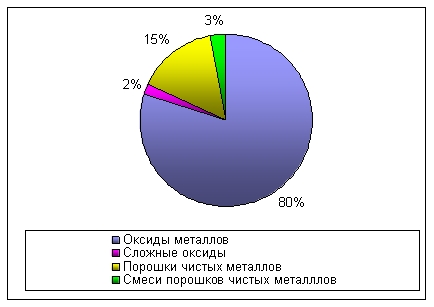
Основні терміниОксиди (або оксили) - складні речовини, до яких входять два елементи, один з яких Оксиген зі ступенем окиснення -2. Бінарні сполуки – ті, що включають у себе два елемента, які знаходяться у взаємодії. Вищі оксиди - це такі сполуки, в яких хімічний елемент має вищу ступінь окислення. Пероксиди – активно взаємодіючі речовини, які являються сильними окиснювачами і легко розкладаються. IUPAC (Міжнародний союз фундаментальної та прикладної хімії) – така міжнародна недержавна організація, що займається розвитком хімії в різних напрямах. Хід урокуСутність оксидівОксидами (або оксилами) називаються складні речовини, до яких входять два елементи, один з яких Оксиген зі ступенем окиснення -2, а інший характеризується одним ступенем окиснення, не має зв’язків Е-Е та О-О. Крім прости оксидів, Оксиген може створювати й інші бінарні сполуки, такі як: подвійні оксиди, складні оксиди, пероксиди. Вищі оксиди - це такі бінарні сполуки, в яких хімічний елемент має вищу ступінь окислення. Мал. 1. Доля оксидів у природі. За можливими валентностями елементів від 1 до 8, нам відомо 8 типів простих оксидів: Мал. 2. Типи простих оксидів. Майже всі хімічні елементи здатні утворювати оксиди, окрім благородних газів: гелію, неону та аргону. Контролюючий блок 1
Склад і назви оксидівДля початку, пропонуємо вам переглянути відео щодо поняття оксидів, складання їх формул та номенклатури, щоб мати практичне уявлення з теми. Відео 1. Оксиди.
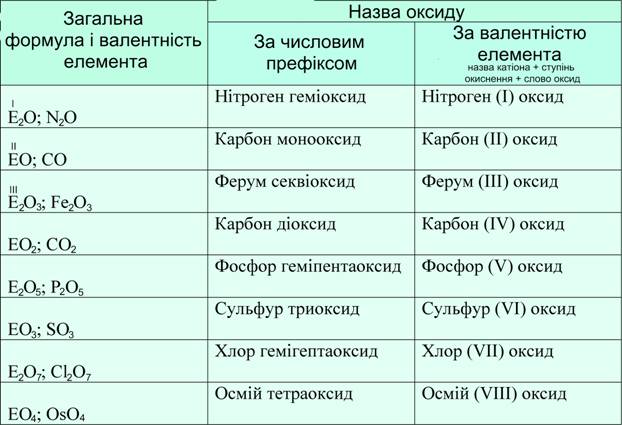
Назви оксидів можна утворити двома способами: • за допомогою числових префіксів - раціональна номенклатура, в основу якої покладено застосування грецьких числівників, які вказують кількість атомів оксисену, що припадає на один атом оксидоутворюючого елемента. Наприклад: N2O - нітроген геміоксид, NO – нітроген монооксид, N2O3 – динітроген триоксид (або нітроген секвіоксид), NO2 - нітроген діоксид, N2O5 – динітроген пентаоксид (або нітроген геміпентаоксид). • за валентністю елемента у формі катіона - згідно з правилами IUPAC (Міжнародного союзу фундаментальної та прикладної хімії), назви оксидів складаються з назви елемента та слова «оксид». Наприклад: N2O - нітроген (І) оксид, NO – нітроген (ІІ) оксид, N2O3 – нітроген (ІІІ) оксид, NO2 - нітроген (ІV) оксид, N2O5 - нітроген (V) оксид. Мал. 3. Класифікація назв оксидів. Якщо ж елемент утворює декілька оксидів, то в їх назвах зазначається ступінь окиснення елемента римською цифрою в дужках відразу після назви. Наприклад, Н2О – гідроген оксид (вода), Na2O – натрій оксид, Р2О3 – фосфор (ІІІ) оксид, Р2О5 – фосфор (V) оксид, Cu2O – купрум (І) оксид, CuO – купрум (ІІ) оксид. Мал. 4. Види деяких наукових назв оксидів. Пероксиди утворюють пероксидну групу пероксо: — О — О —. У пероксиді ступінь окиснення Оксигену становить -1. Ангідриди – це оксиди кислот, які утворюються при їх взаємодії з водою. Мал. 5. Ангідрид бору. Для кращого розуміння теми, можете переглянути як певні оксиди взаємодіють з водою. Відео 2. Взаємодія оксидів з водою.
Контролюючий блок 2
Добування оксидівВиділяють декілька способів добування оксидів: 1) Взаємодія простих речовин з диоксигеном: Мал 6. Взаємодія простих речовин з диоксигеном. Мал. 7. Оксид сульфуру. 2) Спалювання водневих сполук: Мал. 8. Спалювання водневих сполук. 3) Спалювання сульфідів, фосфідів, боридів, карбідів тощо: Мал. 9. Спалювання карбідів. 4) Розклад кислот, основ, амфотерних гідроксидів: Мал. 10. Розклад кислот. 5) Нагрівання солей кисневмісних кислот: Мал. 11. Нагрівання солей. Мал. 12. Оксид магнію. 6) Взаємодія кислот-окисників з металами та неметалами: Мал. 13. Взаємодія сульфатної кислоти з сульфуром. 7) Взаємодія солей деяких металів з лугами та кислотами: Мал. 14. Взаємодія хлорної кислоти з сіллю. 8) Відновлення або розкладання оксидів деяких елементів з високими ступенями окиснення: Мал 15. Розкладання оксидів. Пропонуємо вам переглянути як відбувається добування оксидів. Відео 3. Добування оксиду феруму.
Контролюючий блок 3
Самостійне завданняПроаналізуйте та наведіть приклади всіх методів добування оксидів. Цікаво знати, що…«Діючий вулкан» Амоній дихромат [(NH4)2Cr2O7] під час нагрівання енергійно розкладається з виділенням газу та пари води, які захоплюють частинки твердої речовини – хром (ІІІ) оксиду. Процес розкладу нагадує виверження вулкана. Його можна подати таким рівнянням: Мал. 16. Процес розкладу амонію. Отже, азот та водяна пара захоплюють частинки хром (ІІІ) оксиду і створюють уявлення про дію вулкана. Спробу зробіть так. Розітріть у ступці на дрібний порошок сіль [(NH4)2Cr2O7]. Помістіть розтерту сіль у фарфоровий тигель. Зробіть у порошку невеликий отвір («кратер»), налийте в нього 5-6 мл спирту починається розклад солі з виділенням азоту і пари води, який весь час прискорюється. Реакція досить ефектна. Список використаних джерел1. Урок на тему «Сутність оксидів та їх властивості» Хаврюти Р.Ю., вчителя хімії, м. Дніпродзержинськ, сш №12.
Хаврюти Р.Ю. Вдовченко М.В. Горбатко С.М
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: