|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Кислоти, їх склад, назви. Повні уроки
Тема
Мета уроку
Задачі уроку
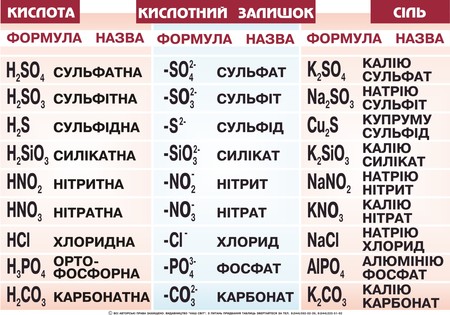
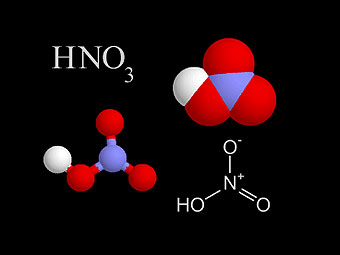
Основні терміниКислоти – це електроліти, які у воді дисоціюють на йони Гідрогену (жодних інших катіонів кислоти не утворюють) і кислотні залишки – аніони. Аніон – це негативно заряджений йон. Дисоціація – це розклад частинки (молекули, радикала, йона) на декілька більш простих частинок. Інгібітор – це хімічна речовина, яка придушує активність ферментів. Інгібітори хімічні – це речовини, яки понижують швидкість хімічних реакцій. Хід урокуСутність кислотКислотами називаються сполуки, що містять катіони Гідрогену, які здатні заміщуватись металом (або металоподібною групою атомів), і аніони кислотного залишку. Група атомів, що залишається при відщепленні від молекули кислоти йонів Гідрогену, називається кислотним залишком Числом йонів Гідрогену, що утворюються кожною молекулою під час дисоціації, визначається заряд кислотного залишку (аніона). Мал. 1. Види кислот, їх формули, назви та кислотний залишок. Контролюючий блок 11. Що являють собою кислоти? Склад і назви кислотДо складу будь-якої кислоти входять катіони Гідрогену та аніони кислотного залишку.Кількість йонів Гідрогену, здатних заміщуватися на метал з утворенням солей, визначає основність кислоти. За цим параметром розрізняють одноосновні (HCl, HNO3), двоосновні (H2SO4, H2CrO4), триосновні (H3PO4, H3BO3)і багатоосновні (H4P2O7, H4SiO4) кислоти. А за складом виділяють безоксигенні та оксигеновмісні кислоти. Систематичні назви кислот утворюють з назви катіону, тобто «гідроген», та назви аніона, з використанням принципів номенклатури координаційних сполук. Наприклад : HMnO4 — гідрогентетраоксоманганат (VII) HAuCl4 — гідрогентетрахлороаурат (III) H2SeO3 — дигідрогентриоксоселенат (IV) HNO3 — гідрогентриоксонітрат, гідроген нітрат, гідроген нітрат (V) H2SO4 — дигідрогентетраоксосульфат, дигідроген сульфат (VI) Якщо оксигеновмісна кислота містить елемент у найвищому ступені окиснення, то ступінь окиснення елемента можна не вказувати: H3PO4 — тригідрогенфосфат. Для поширених звичайних кислот можна задавати назву за аніоном: H2SeO4 — селенатна кислота, HNO3— нітратна кислота, H2CrO4 — хроматна кислота, H2SO4 — сульфатна кислота. Безоксигенні кислоти називаються: HCl — гідроген хлорид, H2S— дигідрогенсульфід, HCN — гідрогенціанід, HN3 — гідрогеназид. Мал.2 . Азотна кислота. Для орієнтації в темі, та розуміння механіки утворення кислот, пропонуємо до вашої уваги наступне відео. Відео 1. Синтез азотної кислоти.
Щоб підкреслити належність водних розчинів цих сполук до кислот, їх назви утворюють з назви аніона з закінченням -на та слова «кислота». Наприклад HCl— хлоридна кислота. Контролюючий блок 21. З чого складається кислота? Добування кислотВиділяють декілька методів добування кислот: 1) Взаємодія кислотних оксидів з водою: SO2 + H2O = H2SO3 Спостерігати взаємодію кислоти з водою ви можете на наступному відео. Відео 2. Взаємодія соляної кислоти і соди.
2) Взаємодія активних неметалів з водою: Cl2 + H2O = HCl + HOCl Мал. 3. Хлоридна кислота Щоб зрозуміти як взаємодіють кислоти з металами, пропонуємо переглянути наступне відео. Відео 3. Взаємодія хлоридної кислоти з металами.
3) Безпосереднє сполучення неметалів з дигідрогеном з наступним розчиненням одержаних сполук у воді: H2 + Cl2 = 2HCl 4) Окиснення деяких простих речовин: P + 5HNO3 = H3PO4 + 5NO2 + H2O 5) Взаємодія між солями та кислотами (реакція витіснення): NaCl + H2SO4 = HCl 6) Гідроліз галоген ангідридів: PCl5 + 4H2O = H3PO4 + 5 HCl 7) Окиснення сульфідів неметалів: As2S3 + 28HNO3 = 2H3AsO4 + 3H2SO4 + 28NO2 + 8 H2O Мал. 4. Сульфатна кислота. Контролюючий блок 3
Самостійне завдання
Цікаво знати, що…
Негативні каталізатори (тобто ті, що зменшують швидкість реакції) відомі для різноманітних процесів і, між іншим, для взаємодії між металами та кислотами. Сповільнювачі взаємодії між металами і кислотами мають назву інгібіторів. Цікаво, що інгібітори сповільнюють розчинення металів у кислотах і зовсім не впливають на швидкість реакції між окислами там гідроксидами металів і кислотами. Це дає можливість вживати кислоти з добавками інгібітору для позбавлення від іржі, котельного накипу тощо. Як інгібітори застосовують переважно органічні речовини, наприклад, формалін, анілін, різні аміни та амінокислоти тощо. Список використаних джерел1. Урок на тему «Поняття кислот та їх особливості» Шевчука А.Н., вчителя хімії, м. Київ, ЗОШ №125.
Шевчук А.Н Войтюк І.В Горбатко С. Н.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: