|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Узагальнення знань про оксиди та кислоти. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
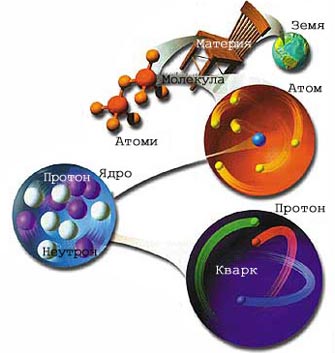
Хід урокуУзагальнення знань про кислотиЗ точки зору протонної теорії кислот та основ до кислот відносяться ті речовини, які здатні віддавати йон водню, тобто бути донорами протонів. Мал. 1. Склад ядра. Кількість іонів водню в молекулі кислоти, здатних замішуватися на метал або металоподібну групу атомів з утворенням солей, визначає її основність. Розрізняють кислоти одноосновні(HNO3, HCl, HClO), двохосновні (H2SO4, H2S, H2CO3), триосновні (H3PO4), чотириосновні (H4P2O7, H4SiO4), п’ятиосновні (H5IO6), шестиосновні (H6TeO6). В деяких кислотах кількість водню не відповідає їх основності: H3PO3 - двохосновна, H3PO2 - одноосновна кислота. Група атомів, що залишається після відщеплення від молекули кислоти іонів водню, називається кислотним залишком. За хімічним складом розрізняють без кисневі, звичайні кисневмісні, полі-, тіо-, пероксокислоти. До без кисневих кислот належать HCl, HBr, HI, H2S, H2Se, HCN, HSCN тощо. Звичайні кисневмісні кислоти є гідратами кислотних оксидів. Деякі кислоти (H3PO2, HBrO3 тощо) не мають відповідних кислотних оксидів. Утворення звичайних кисневмісних кислот можна уявити як продукт приєднання однієї або декількох молекул води до молекули кислотного оксиду. Реакцію обміну між оксидом і кислотою ви можете спостерігати на наступному відео. Відео 1. Реакція обміну між оксидом міді і сірчаною кислотою.
Контролюючий блок 1
Узагальнення знань про оксидиОксидами називаються бінарні сполуки елемента з Оксигеном, в яких елемент характеризується одним ступенем окиснення, не має зв’язків Е-Е та О-О, а Оксиген має ступінь окиснення – виключно -2. За можливими валентностями елементів від 1 до 8, відомо 8 типів простих оксидів: Е2О, ЕО, Е2О3, ЕО2, Е2О5, ЕО3, Е2О7, ЕО4. Назви оксидів складаються із слова оксид та назви елемента в родовому відмінку. Якщо елемент утворює декілька оксидів, то ступінь окислення елемента зазначається в дужках римською цифрою. Вживається також номенклатура, в якій підкреслюється кількість атомів кисню, що припадає на один атом іншого елемента. При цьому на перше місце ставлять слово оксид з відповідним числівниковим префіксом (моно-, ди-, три-, тетра- тощо), на друге – назву відповідного елемента у родовому відмінку. За хімічним характером оксиди поділяються на дві групи: солетворні і несолетворні. До останніх належать CO, N2O, NO, SiO та ін.. Перші, в свою чергу, поділяються на основні, кислотні та амфотерні. Основними оксидами називаються оксиди металів, гідрати яких є основами. Взаємодію основних оксидів з водою ви можете спостерігати на наступному відео.
Кислотними (ангідридами кислот) називаються оксиди, гідрати яких є кислотами. Амфотерними оксидами називаються оксиди, яким відповідають амфотерні гідроксиди, здатні в залежності від умов реакції виявляти властивості як кислотних, так і основних оксидів. Якщо метал утворює декілька оксидів, то, як правило, оксиди, в яких метал має найнижчий ступінь окиснення, є основними, оксиди, в яких метал в середньому ступені окиснення, - амфотерними, а у вищому ступені окиснення – кислотними. Наприклад, серед оксидів Мангану MnO і Mn2O3 – основні, MnO2 – амфотерний, Mn2O7 - кислотний. Взаємодію оксиду и кисню ви можете побачити на наступному відео. Відео 3. Взаємодія оксиду фосфору і кисню.
Контролюючий блок 2
Домашнє завданняСкладіть порівняльну таблицю-характеристику оксидів та кислот за такими пунктами: 1. Утворення назви; 2. Класифікації (спільні/відмінні), та види за ними. 3. Фізичні властивості. 4. Хімічні властивості. 5. Добування. 6. Використання у побуті. Цікаво знати, що…З обвуглюванням органічних речовин (наприклад, деревини) доводиться зустрічатися досить часто. Усі органічні речовини завжди мають у своєму складі елемент Карбон, який існує в природі у вигляді алмазу та графіту. Майже чистим вуглецем є також деревне вугілля, сажа. До складу цукру входять три хімічні елементи: Карбон, Гідроген і Окисген. При нагріванні цукор обвуглюється, втрачаючи Гідроген та Оксиген, які виділяються у вигляді води. Проте, таке виділення води можна зробити не лише нагріваючи цукор, а також і іншим шляхом, наприклад, використовуючи для цього концентровану сульфатну кислоту. Концентрована сульфатна кислота надзвичайно жадібно приєднує до себе воду і може забирати її від багатьох сполук. Цим пояснюється обвуглюючи дія сульфатної кислоти на деревину, папір, цукор, тощо. Розітріть у дрібний порошок 40 г цукру і висипте його у вузьку склянку, додайте біля 3-4 мл води і добре перемішайте скляною паличкою. Поставте склянку на тарілку, додайте 20-25 мл концентрованої сульфатної кислоти і знов добре перемішайте суміш. Через кілька хвилин суміш почне темніти, розігріватися, із склянки виходитиме водяна пара і почне утворюватися пухка маса, яка підійметься із склянки у вигляді стовпа. Маса, яка утворюється при цьому, являє собою дуже пористе вугілля, одержане з цукру. Під час реакції виділяється також і сульфур (IV) оксид, який утворюється внаслідок відновлення сульфатної кислоти вугіллям. Утворені при реакції гази і пара води викликають спучування обвугленого цукру. Список використаних джерел1. Урок на тему «Оксиди та їх місце у нашому житті» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Сисикова Р.Ф. Лісняк. А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: