|
Гіпермаркет Знань>>Фізика і астрономія>>
Фізика 9 клас>> Фізика: Будова атома. Електрон. Йон
Тема
Мета
Хід урокуПоняття "атом"З грецької слово «атом» перекладається як неподільний. Проте, відкриття носія негативного електричного заряду – електрона, дозволило Джозефу Томсону висунути модель внутрішньої будови атома. Оскільки відношення заряду до маси позитивної частини атома свідчило про значну перевагу її над масою електрона, Томсон уявляв атом як кулю, радіусом 10-10 м, на поверхні та всередині якої знаходяться негативно заряджені частки – електрони. Така модель згодом отримала назву «пудинг з родзинками».
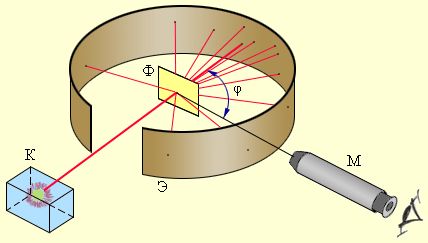
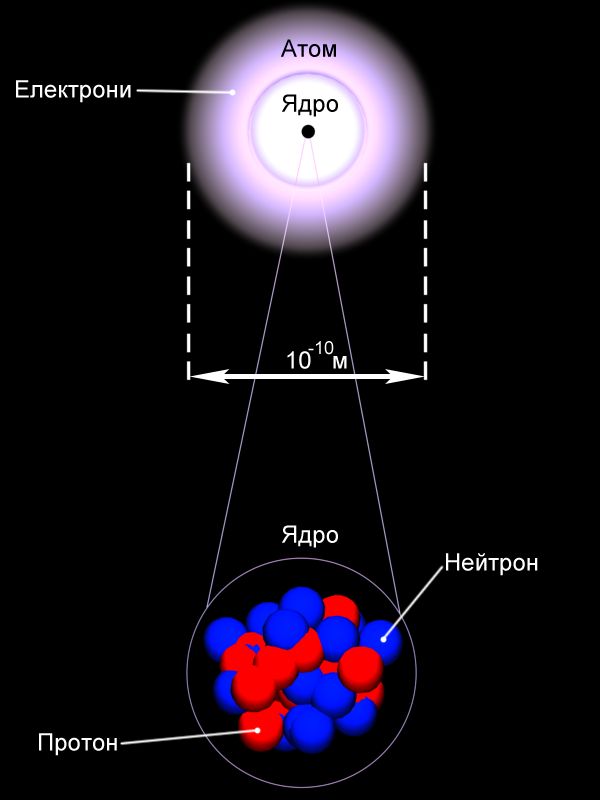
Сукупний заряд електронів компенсував заряд позитивної частини атома. 1911 року, під керівництвом британського дослідника Ернста Резерфорда, було проведено експеримент по зондуванню внутрішньої будови атома. Для цього було використано попередньо відкриті ним позитивно заряджені частки, які отримали назву α-часток. Частки самовільно викидалися речовиною радій і рухалися з найбільшою на той час можливою швидкістю. Направивши такий потік на золоту фольгу, Резерфорд підраховував кількість часток, що відхилялася на різні кути (відео 1). Рис. 14 Модель атома за Томсоном Будова атома. Електрон. ЙонЗа цими даними він зробив висновок, що позитивний заряд не може бути розмитий по всьому об’єму атома, а мусить міститися в центральній його частині. Ця частина за оцінками Резерфорда має розмір 10-15 м. Вона отримала назву атомне ядро. Для електронів Резерфорд відводить місце на орбітах навколо ядра атома. Атом усередині виявився порожнім! Така модель атома отримала надалі назву планетарної моделі атома. Згодом Резерфорд встановлює існування частки з найменшим позитивним зарядом – протона. Ця частка виявилася ядром атома найлегшої речовини – гідрогену. 1932 року, британський фізик Джеймс Чедвік відкриває існування в ядрах атомів часток без електричного заряду, маса яких складала 1,67×10-27 кг, на долі відсотка перевищуючи масу протона. Ії назвали нейтроном. З відкриттям нейтрона склад атомів було повністю пояснено, хоча внутрішня будова ще тривалий час з’ясовувалася.
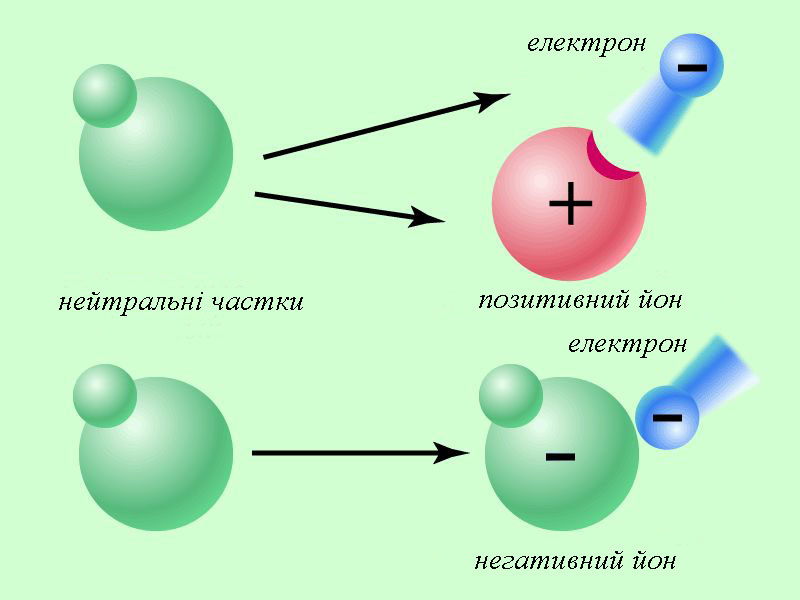
Склад атома речовини визначається за її розміщенням у періодичній системі Менделєєва. Кожний елемент у системі має порядковий номер Z та масове число A. Порядковий номер Z відповідає кількості протонів у атомному ядрі. Кількість електронів буде такою ж, якщо атом у цілому нейтральний. Масове число А вказує загальну кількість протонів та нейтронів. Для прикладу склад атому урану : кількість протонів Z=92, кількість електронів в нейтральному атомі – 92, кількість нейтронів N = 238 – 92 = 146. Питання про розміщення електронів у атомах виявилося набагато складнішим, оскільки на рівні мікросвіту працюють закони квантової фізики, що відрізняються від звичайних уявлень про простір та час. Ділянки в яких можуть перебувати електрони в атомах називають електронними орбіталями. Взаємодія електронів з атомними ядрами залежить від їхньої орбіталі, що також визначається позицією елемента в періодичній системі Менделєєва. Наслідком цього є те, що в різних атомів взаємодія електронів з ядрами різна! Рис. 17 Утворення йонів
Контролюючий блок1. На чому ґрунтується твердження про те, що матеріальні тіла всередині порожні?
Чернецький Ігор Станіславович
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: