|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас>> Хімія: Закон як форма наукових знань. Закон збереження маси речовин
Тобі вже відомо, як хіміки пізнають світ речовин. Вони здійснюють експерименти, вивчаючи хімічні властивості речовин, спостерігають зміни, що відбуваються з речовинами, вивчають умови перебігу хімічних реакцій тощо. У результаті нагромаджується багато фактів, які потребують пояснення та узагальнення. Внаслідок цього виявляються закономірності, що об'єктивно існують у природі, й формулюються закони. Так трапилося і з законом збереження маси, відкритим й експериментально підтвердженим російським хіміком М. В. Ломоносовим та французьким ученим А.Л. Лавуазьє.

Щоб зрозуміти суть закону, виконаємо демонстраційні досліди.
Дослід 1. Мідну пластинку прожаримо в полум'ї. Поверхня її вкривається чорним нальотом. Це утворився купрум(ІІ) оксид СuО.
Дослід 2. Пластинку з чорним нальотом зануримо в хлоридну кислоту HCl. Розчин набуває зеленкувато-блакитного забарвлення. Це пояснюється тим, що в розчині утворився купрум(ІІ) хлорид СuСl2.
Дослід 3. У добутий розчин зануримо залізний цвях. Через деякий час його поверхня вкриється червоним нальотом міді Сu.
Отже, відбулися хімічні перетворення речовин, які можна виразити схемою:
Сu -> СuО -> СuСl2 -> Сu
Зі схеми видно, що атоми Купруму під час реакцій не зникали, а лише з'єднувалися з атомами інших елементів, утворюючи нові речовини, а потім виділилися у вигляді простої речовини — міді, тобто відбулося лише перегрупування атомів.
Суть хімічної реакції полягає в перегрупуванні атомів.
Звідси виходить, що загальна маса атомів зберігається. Отже, маса речовин до і після реакції також зберігається.
Такого висновку дійшов Михайло Ломоносов (1748), проводячи досліди, аналогічні тим, які раніше виконував Роберт Бойль із прожарювання металів у запаяних скляних посудинах (ретортах). Виявилося, якщо посудину, яка містить метал, зважити до і після прожарювання, не розкриваючи її, то маса залишається незмінною. А якщо нагрівати метал у відкритій реторті, то маса збільшується за рахунок сполучення металу з киснем повітря. Але свої праці у цій галузі він своєчасно не опублікував.
Незалежно від Ломоносова цей закон відкрив (1789) і ввів його в хімію французький хімік Антуан Лавуазьє. Сучасне формулювання закону таке:
загальна маса речовин, які вступили в хімічну реакцію, дорівнює загальній масі речовин, що утворилися внаслідок реакції.
Спробуємо експериментально перевірити цей закон. Скористаємося приладом, зображеним на мал. 58.
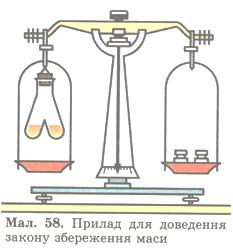
Дослід 4. В одне коліно двоколійної пробірки наллємо безбарвний розчин барій хлориду ВаСl2, а в інше — безбарвний розчин натрій сульфату Na2SO4. Перед проведенням реакції зрівноважимо прилад на технохімічних терезах. Нахиливши пробірку, змішаємо прозорі розчини. Одразу з'являється каламуть, і випадає білий осад.
Про що свідчить така ознака? Поява такої ознаки засвідчує, що між речовинами відбулася хімічна реакція, в результаті якої утворилася нова нерозчинна речовина білого кольору. При цьому рівновага терезів не порушилась (чому?). Тому що атоми під час хімічної реакції зберігаються. Відповідно зберігається й маса речовин, які вступили в реакцію, і маса тих речовин, які утворилися внаслідок реакції, тобто маса атомів залишається без змін. Той факт, що атоми мають сталу масу, й спричинює збереження маси речовин.
Відкриття закону збереження маси сприяло дальшому розвитку хімії як науки. Велике значення мало відкриття цього закону й для організації хімічних виробництв, для успішної роботи яких потрібно точно знати масу сировини, що надходить на завод, маси кінцевих і побічних продуктів. Не менш важливе значення має закон збереження маси і для утвердження наукового світорозуміння, адже він доводить, що
у природі ніщо не виникає з нічого і не зникає безслідно.
Тепер ти знаєш, чому маса речовин під час хімічних реакцій зберігається, бо зберігаються атоми елементів.
Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
Планування уроків з хімії , відповіді на тести, завдання та відповіді по класам , домашнє завадання та робота з хімії 7 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












