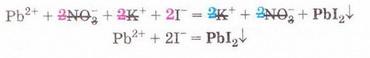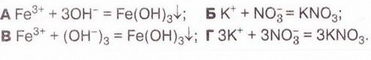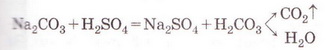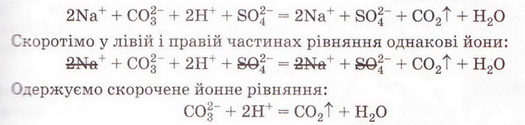|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Реакції обміну між електролітами
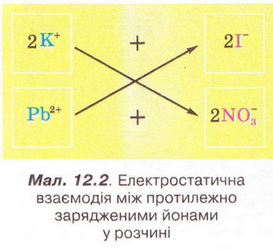
Реакції обміну у розчинах електролітів, умови їх перебігу. Йонні рівняння Після опрацювання § 12 ви зможете: складати рівняння реакцій обміну у розчинах електролітів у повній і скороченій йонній формах. На шляху до успіху пригадаємо з вивчених курсів хімії, фізики, математики: що таке хімічне рівняння; як взаємодіють заряди; що таке подібні доданки та у який спосіб їх зводять; які реакції називають реакціями: а) обміну; б) нейтралізації; що таке ступінь окиснення; які оксиди та гідрати оксидів реагують із кислотами; за яких умов відбуваються до кінця реакції у розчинах між: а) кислотами та солями; б) двома солями; в) солями і лугами; як позначають у хімічних рівняннях утворення осаду й виділення газу. • Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. Уточнімо: йонними рівняннями можуть бути зображені будь-які реакції, що відбуваються за участю електролітів у розчинах. Якщо вони не супроводжуються зміною зарядів йонів (не змінюються ступені окиснення елементів), то їх називають реакціями йонного обміну. Скласти йонне рівняння досить просто. Виконаймо дослід і розгляньмо послідовність складання йонного рівняння на прикладі реакції між калій йодидом і плюмбум(ІІ) нітратом у розчині. Про її перебіг свідчить утворення яскраво-жовтого осаду плюмбум(ІІ) йодиду (мал. 12.1). Спочатку запишімо рівняння реакції без урахування дисоціації електролітів: Аби скласти рівняння цієї реакції у йонній формі, слід зважити на те, що електроліти у розчині дисоціюють на йони. За таблицею «Розчинність кислот, основ і солей у воді» (див. додаток) визначмо, які з-поміж реагентів є сильними електролітами. Обидві розчинні солі - плюмбум(ІІ) нітрат і калій йодид - у водному розчині практично повністю дисоціюють за йони. Тож запишімо їхні формули у йонному вигляді: РЬ2+ + 2NO-3 + 2К+ + 2I- Проаналізуймо, які з цих йонів взаємодіятимуть між собою з огляду знаки їхніх зарядів. Це потрібно, аби пересвідчитися, що ми правильно визначили продукти реакції. Електростатичні сили зумовлюватимуть притягування різнойменних і відштовхування однойменно заряджених йонів (мал. 12.2).
РЬ2+ + 2NO-3 + 2К+ + 2I- = 2K++ 2N0-3 + Рbl2 Зверніть увагу: у йонному рівнянні коефіцієнти перед формулами кожного з йонів записують з урахуванням індексів у формулах електролітів та коефіцієнтів перед ними. Приміром, унаслідок дисоціації однієї формульної одиниці плюмбум(ІІ) нітрату утворюється один катіон Плюмбуму(ІІ) і два нітрат-аніони. А під час дисоціації двох формульних одиниць калій йодиду утворюються два катіони Калію та два йодид-аніони. Очевидно, що в лівій і правій частинах йонного рівняння є однакові йони (які саме?). Оскільки вони не беруть участі в реакції, їхні формули ножна скоротити: Вилучімо з лівої та правої частин рівняння формули катіонів Калію й - нітрат-аніонів, аби одержати скорочене йонне рівняння. У ньому записані тільки ті частинки, які реально взаємодіють у розчині з утворенням яскраво-жовтого осаду плюмбум(ІІ) йодиду. Тобто скорочене йонне рівняння відбиває суть реакції обміну між електролітами у розчині. Воно показує, які йони взаємодіють і яка речовина є продуктом реакції. Виконаний дослід дає підстави стверджувати, що однією з умов необоротності реакції між електролітами у розчині є утворення осаду. Завдання Виберіть скорочене йонне рівняння, яке відповідає реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині: З'ясуймо, за яких ще умов, окрім утворення осаду, реакції обміну у розчинах електролітів будуть необоротними - тобто відбуватимуться до кінця. Дослідімо реакцію між натрій гідроксидом і нітратною кислотою у розчині. Наочно пересвідчитися у перебігу реакції нейтралізації допоможе застосування індикатора. До розчину натрій гідроксиду добавмо кілька крапель спиртового розчину фенолфталеїну - специфічного індикатора лужного середовища. Ви, звичайно, пам'ятаєте, що під дією гідроксид-аніонів фенолфталеїн набуває малинового забарвлення. Краплями, щоразу обережно струшуючи колбу, добавлятимемо розбавлену нітратну кислоту (мал. 12.3), аж поки малинове забарвлення фенолфталеїну не зникне. Знебарвлення розчину свідчить про нейтралізацію лугу кислотою: NaOH + HNO3 = NaN03 + Н20 За допомогою таблиці розчинності (див. додаток) визначмо, що з чотирьох речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій гідроксид (луг), нітратна кислота і натрій нітрат розчинна сіль. Вода - дуже слабкий електроліт, тож практично не дисоціює. З огляду на це, запишімо повне йонне рівняння реакції між натрій гідроксидом і нітратною кислотою у розчині: Очевидно, що молекули води утворюються внаслідок взаємодії у розчині катіонів Гідрогену й гідроксид-аніонів. Завдання Виберіть ті пари електролітів, реакції між якими у розчині відбуваються практично до кінця (необоротно): А Н2S04 і КОН; Б К2SiO3 і НN03; В НСІ і КN03; Г КN03 і NaОН. Розгляньмо ще один випадок перебігу до кінця реакції між електролітами у розчині. Змішаймо розчин натрій карбонату з розбавленою сульфатною кислотою. Завдання За малюнком 12.4 опишіть на макрорівні хімічну реакцію між натрій карбонатом і сульфатною кислотою у розчині. Поясніть, чому не можна для проведення досліду брати розчини соди та кислоти у більших (мал. 12.4, 1), ніж вказано в інструкції (мал. 12.4, 2), кількостях. Скориставшись таблицею розчинності і див. додаток), запишімо рівняння реакції (пам'ятаймо, карбонатна кислота нестійка, існує у розчині як гідрат): З-поміж п'яти речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій карбонат, сульфатна кислота і натрій сульфат. Вода - дуже слабкий електроліт, а карбон(IV) оксид (вуглекислий газ) видаляється зі сфери реакції. Очевидно, що утворення молекул води й вуглекислого газу є наслідком взаємодії між катіонами Гідрогену й карбонат-аніонами у розчині. Ця реакція необоротна (відбувається до кінця), оскільки вода - дуже слабкий електроліт, а вуглекислий газ видаляється зі сфери реакції. Завдання Виберіть ті пари електролітів, реакції між якими у розчині відбуваються практично до кінця (необоротно): А Н2S04 і К2С03; Б Na2S і НСІ; В НNO3 і Na2S04; Г KNO3 і НСІ. Виконані досліди доводять, що реакції обміну між електролітами у розчині необоротні, якщо поміж продуктів реакції є осад, газ, вода або інший слабкий електроліт. Якщо виконується хоча б одна з цих умов, реакція відбувається до кінця. Якщо ж ні, то внаслідок змішування розчинів утворюється суміш йонів. Про це свідчить повне йонне рівняння реакції між натрій хлоридом і калій нітратом у розчині Na+ + Сl- + К+ + N0-3 = Na+ + NO-з+ К+ + Сl- Аби дістати більше експериментальних підтверджень правильності зроблених висновків, виконайте лабораторні досліди.
Г. А. Лашевська, Геометрія, 9 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: