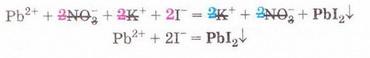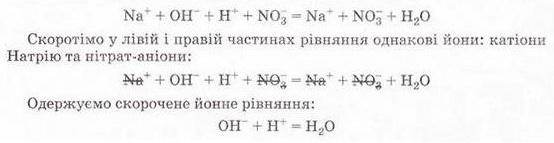|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Реакції обміну між електролітами
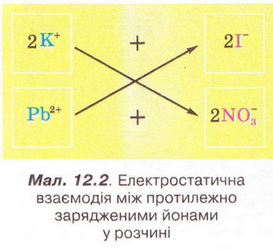
Реакції обміну у розчинах електролітів, умови їх перебігу. Йонні рівняння Після опрацювання § 12 ви зможете: складати рівняння реакцій обміну у розчинах електролітів у повній і скороченій йонній формах. На шляху до успіху пригадаємо з вивчених курсів хімії, фізики, математики: що таке хімічне рівняння; як взаємодіють заряди; що таке подібні доданки та у який спосіб їх зводять; які реакції називають реакціями: а) обміну; б) нейтралізації; що таке ступінь окиснення; які оксиди та гідрати оксидів реагують із кислотами; за яких умов відбуваються до кінця реакції у розчинах між: а) кислотами та солями; б) двома солями; в) солями і лугами; як позначають у хімічних рівняннях утворення осаду й виділення газу. • Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинах солей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. Уточнімо: йонними рівняннями можуть бути зображені будь-які реакції, що відбуваються за участю електролітів у розчинах. Якщо вони не супроводжуються зміною зарядів йонів (не змінюються ступені окиснення елементів), то їх називають реакціями йонного обміну. Скласти йонне рівняння досить просто. Виконаймо дослід і розгляньмо послідовність складання йонного рівняння на прикладі реакції між калій йодидом і плюмбум(ІІ) нітратом у розчині. Про її перебіг свідчить утворення яскраво-жовтого осаду плюмбум(ІІ) йодиду (мал. 12.1). Спочатку запишімо рівняння реакції без урахування дисоціації електролітів: Аби скласти рівняння цієї реакції у йонній формі, слід зважити на те, що електроліти у розчині дисоціюють на йони. За таблицею «Розчинність кислот, основ і солей у воді» (див. додаток) визначмо, які з-поміж реагентів є сильними електролітами. Обидві розчинні солі - плюмбум(ІІ) нітрат і калій йодид - у водному розчині практично повністю дисоціюють за йони. Тож запишімо їхні формули у йонному вигляді: РЬ2+ + 2NO-3 + 2К+ + 2I- Проаналізуймо, які з цих йонів взаємодіятимуть між собою з огляду знаки їхніх зарядів. Це потрібно, аби пересвідчитися, що ми правильно визначили продукти реакції. Електростатичні сили зумовлюватимуть притягування різнойменних і відштовхування однойменно заряджених йонів (мал. 12.2).
РЬ2+ + 2NO-3 + 2К+ + 2I- = 2K++ 2N0-3 + Рbl2↓ Зверніть увагу: у йонному рівнянні коефіцієнти перед формулами кожного з йонів записують з урахуванням індексів у формулах електролітів та коефіцієнтів перед ними. Приміром, унаслідок дисоціації однієї формульної одиниці плюмбум(ІІ) нітрату утворюється один катіон Плюмбуму(ІІ) і два нітрат-аніони. А під час дисоціації двох формульних одиниць калій йодиду утворюються два катіони Калію та два йодид-аніони. Очевидно, що в лівій і правій частинах йонного рівняння є однакові йони (які саме?). Оскільки вони не беруть участі в реакції, їхні формули ножна скоротити: Вилучімо з лівої та правої частин рівняння формули катіонів Калію й - нітрат-аніонів, аби одержати скорочене йонне рівняння. У ньому записані тільки ті частинки, які реально взаємодіють у розчині з утворенням яскраво-жовтого осаду плюмбум(ІІ) йодиду. Тобто скорочене йонне рівняння відбиває суть реакції обміну між електролітами у розчині. Воно показує, які йони взаємодіють і яка речовина є продуктом реакції. Виконаний дослід дає підстави стверджувати, що однією з умов необоротності реакції між електролітами у розчині є утворення осаду. Завдання Виберіть скорочене йонне рівняння, яке відповідає реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині: A Fe3+ + 3OH- = Fe(OH)3↓; Б K++ NO B Fe3+ + (OH-)3 = Fe(OH)3↓; Г 3K+ = 3NO З'ясуймо, за яких ще умов, окрім утворення осаду, реакції обміну у розчинах електролітів будуть необоротними - тобто відбуватимуться до кінця. Дослідімо реакцію між натрій гідроксидом і нітратною кислотою у розчині. Наочно пересвідчитися у перебігу реакції нейтралізації допоможе застосування індикатора. До розчину натрій гідроксиду добавмо кілька крапель спиртового розчину фенолфталеїну - специфічного індикатора лужного середовища. Ви, звичайно, пам'ятаєте, що під дією гідроксид-аніонів фенолфталеїн набуває малинового забарвлення. Краплями, щоразу обережно струшуючи колбу, добавлятимемо розбавлену нітратну кислоту (мал. 12.3), аж поки малинове забарвлення фенолфталеїну не зникне. Знебарвлення розчину свідчить про нейтралізацію лугу кислотою: NaOH + HNO3 = NaN03 + Н20 За допомогою таблиці розчинності (див. додаток) визначмо, що з чотирьох речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій гідроксид (луг), нітратна кислота і натрій нітрат розчинна сіль. Вода - дуже слабкий електроліт, тож практично не дисоціює. З огляду на це, запишімо повне йонне рівняння реакції між натрій гідроксидом і нітратною кислотою у розчині: Очевидно, що молекули води утворюються внаслідок взаємодії у розчині катіонів Гідрогену й гідроксид-аніонів. Отже, реакція обміну між електролітами у розчині практично необоротна, якщо один з продуктів - дуже слабкий електроліт, наприклад вода, або інша малодисоційована речовина. ЛАБОРАТОРНІ ДОСЛІДИ Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ Реакції обміну в розчинах електролітів Завдання 1. Проробіть досліди (варіант виконання вкаже вчитель хімії). Для ліпшого спостереження за перебігом реакцій використовуйте чорно-білий екран. Якщо досліди виконуєте у заглибинах пластини, беріть реактивів удвічі менше порівняно з кількостями, потрібними для дослідів у пробірках. 2. Опишіть і поясніть спостереження, складіть рівняння реакцій, запишіть їх у повній і (де це можливо) скороченій йонній формі. За потреби скористайтесь таблицею «Розчинність кислот, основ і солей у воді» (див. додаток). 3. Після завершення роботи обговоріть свої спостереження та складені скорочені йонні рівняння із сусідом по парті, який виконував інший варіант дослідів. Порівняйте висновки, яких ви дійшли. Які рівняння, на вашу думку, відображають суть реакцій обміну між електролітами у розчині? Обладнання: штатив з пробірками або пластина із заглибинами, скляні палички, чорно-білий екран. І варіант Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій нітрату, калій гідроксиду; хлоридна кислота. № 2. Реакції обміну в розчинах електролітів з випаданням осаду Інструкція У пробірку внесіть 5 крапель розчину купрум(ІІ) сульфату і добавте 5 крапель розчину калій гідроксиду. № 3. Реакції обміну в розчинах електролітів з виділенням газу Інструкція У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі хлоридної кислоти. № 4. Реакції обміну в розчинах електролітів з утворенням води Інструкція У пробірку внесіть 3-4 краплі розчину калій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину? Добавте краплю хлоридної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився. Додатково.* Змішування розчинів купрум(ІІ) сульфату і натрій нітрату. Інструкція У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій нітрату. Чи є ознаки перебігу реакції? Складіть рівняння реакції, запишіть його у повному йонному вигляді. Поясніть, чи можна скласти скорочене йонне рівняння. Зробіть висновок, чи відбулася хімічна реакція. II варіант Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій хлориду, натрій гідроксиду, сульфатної кислоти. № 2. Реакції обміну в розчинах електролітів з випаданням осаду Інструкція У пробірку внесіть 5 крапель розчину купрум(П) сульфату і добавте 5 крапель розчину натрій гідроксиду. № 3. Реакції обміну в розчинах електролітів з виділенням газу Інструкція У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі розчину сульфатної кислоти. № 4. Реакції обміну в розчинах електролітів з утворенням води Інструкція У пробірку внесіть 3-4 краплі розчину натрій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину? Додатково. * Змішування розчинів купрум(П) сульфату і натрій хлориду. Інструкція У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій хлориду. Чи є ознаки перебігу реакції? Поясніть, чи можна скласти скорочене йонне рівняння цієї реакції. Зробіть висновок, чи відбулася хімічна реакція.
Г. А. Лашевська, Геометрія, 9 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: