|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Азот
Строение и свойства атомов. Элемент азот N — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные (вспомните правило «8-N»). Отсюда следует, что атомы этих элементов могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степень окисления -3, например в соединениях с водородом — аммиаке NН3 и с металлами — нитридах Li3N, Mg3N2 и др.
Атомы азота могут также отдавать свои внешние электроны более электроотрицательным элементам (фтору, кислороду) и приобретать при этом степени окисления +3 и +5. Атомы азота проявляют восстановительные свойства и в степенях окисления +1, +2, +4.
Азот — простое вещество. В свободном состоянии азот существует в виде двухатомной молекулы М2. В этой молекуле два атома N связаны очень прочной тройной ковалентной связью:

Эту связь можно обозначить и так:
N=N
Азот — бесцветный газ без запаха и вкуса. В воде растворяется хуже кислорода. Прочностью молекулы азота обусловлена его химическая инертность.
При обычных условиях азот взаимодействует только с литием, образуя нитрид Li3N:
6Li + N2 = 2Li3N
С другими металлами он взаимодействует только при высоких температурах.
Также при высоких температурах и давлении в присутствии катализатора азот реагирует с водородом, образуя аммиак:
2N+ ЗН2 <-> 2NH3
(дайте характеристику этой реакции и рассмотрите условия смещения химического равновесия вправо).
При температуре электрической дуги он соединяется с кислородом, образуя оксид азота(II) (дайте характеристику этой реакции и также рассмотрите условия смещения химического равновесия вправо).
В природе азот содержится в основном в атмосфере — 78,09% по объему или 65,6% по массе. Над каждым гектаром земной поверхности постоянно «висят» 8 тыс. т азота. Из природных неорганических соединений азота наиболее известна чилийская селитра NaNO3.
Большая часть связанного азота содержится в органических веществах.
Азот, полученный перегонкой жидкого воздуха, в промышленности применяют для синтеза аммиака и производства азотной кислоты. Раньше этот газ в качестве инертной среды использовали для наполнения электрических ламп. В медицине чистый азот применяется в качестве инертной среды при лечении туберкулеза легких, а жидкий азот — при лечении заболеваний позвоночника, суставов и др.
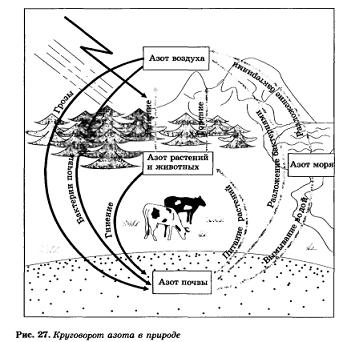
Круговорот азота в природе. Азот — жизненно важный элемент. Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, а без азота нет белка. Человек получает белки из растительной и животной пищи, животные, в свою очередь, получают их также из растений. Следовательно, растения — один из источников пополнения азота, который поддерживает жизнь.
Содержание связанного азота в почве очень незначительно (до 1 кг в 1 т), к тому же большая часть его входит в состав органических соединений и непосредственно недоступна для растений. Однако постепенно, в результате деятельности бактерий, органические соединения превращаются в минеральные — соли аммония или нитраты, которые и усваиваются растениями.
Азот входит в состав растительных белков. Животные получают готовые белковые вещества из растений; в животном организме содержится от 1 до 10% азота (по массе), в шерсти и в рогах — около 15%. Все важнейшие части клеток (цитоплазма, ядро, оболочка) построены из белковых молекул.
Еще большее значение имеют особые бактерии, которые живут в клубеньках на корнях бобовых растений (клевера, гороха, вики, люпина и др.), их так и называют «клубеньковыми». Вот эти бактерии и связывают свободный атмосферный азот, т. е. превращают его в соединения, которые усваивают растения, образуя белки своего организма.
Соединения азота в почве пополняются также во время грозовых ливней. Как вы уже знаете, при этом из азота и кислорода образуется оксид азота(П), который под действием кислорода воздуха превращается в оксид азота(IV):
2NO + 02 = 2NO2
Последний взаимодействует с водой (также в присутствии кислорода воздуха), и получается азотная кислота:
4NO2 + 02 + 2Н20 = 4НNO3
Эта кислота, попадая в почву, реагирует с находящимися в ней соединениями натрия, кальция, калия и образует соли — селитры, необходимые для растений (рис. 27).
Открытие азота. В 1772 г. английский ученый Д. Резерфорд и шведский исследователь К. Шееле обнаружили в своих экспериментах по сжиганию веществ газ, который не поддерживает дыхания и горения. Позднее, в 1787 г., А. Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения, и по его предложению этому газу было дано название «азот», означающее «безжизненный» (от лат. а — нет и зоэ — жизнь). Другое латинское название нитрогениум, введенное в 1790 г. Ж. Шапталем, означает «рождающий селитру».
1. Строение атомов и молекул азота.
2. Свойства азота: взаимодействие с металлами, водородом, кислородом.
3. Получение азота из жидкого воздуха.
4. Применение азота.
5. Азот в природе и его биологическое значение.
Напишите уравнения реакций взаимодействия азота с магнием, кальцием, алюминием. Рассмотрите эти окислительно-восстановительные процессы. Как называются продукты реакций? Каков вид химической связи в них и тип кристаллической решетки? Какими свойствами должны обладать продукты реакций?
Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
N2 -> Li3N -> NH3 -> N0 -> N02 -> НNO3
Рассмотрите первую реакцию как окислительно-восстановительную.
Дайте характеристику реакции по различным признакам:
2NO + 02 <-> 2NO2 + Q
Рассмотрите условия смещения химического равновесия вправо.
Определите коэффициенты в уравнениях реакций, соответствующих следующим схемам, методом электронного баланса:
а) NH3 + 02 -> N0 + Н20
б) МН3 + 02 -> N2 + Н20
В лаборатории азот получают разложением нитрита аммония:
NH4N02 -> N2 + 2Н20
Придумайте и решите задачу, в условии которой была бы указана масса исходного вещества и массовая доля в нем примесей, а требовалось бы найти объем одного продукта и число молекул другого получаемого вещества.
анекдоты к уроку химии, конспекты уроков 9 класса, учебники и учебные пособия
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











