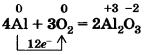|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Алюминий
Строение и свойства атомов. Алюминий Аl — элемент главной подгруппы III группы Периодической системы Д. И. Менделеева. Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдает при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия — бора радиус атома меньше (у бора он равен 0,080 нм, у алюминия — 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектрон-ный слой (2е-; 8е-; Зе-), который препятствует притяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий — простое вещество. Серебристо-белый легкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами легкие и прочные сплавы.
Алюминий — очень активный металл. В ряду напряжений он находится сразу же после щелочных и щелочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой пленкой оксида, которая защищает металл от воздействия компонентов воздуха и воды.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:
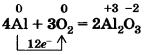
Эту реакцию вы наблюдаете при горении бенгальских огней и фейерверков.
Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии. Для того чтобы началась реакция, необходимо первоначальное нагревание, за исключением реакций с галогенами — хлором и бромом, зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты:

Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
2Аl + 6НСl = 2АlСl3 + ЗН2
2Аl + ЗН2SO4 = Аl2(SO4)3 + ЗН2
А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Как вы уже знаете, оксид и гидроксид алюминия обладают амфотерными свойствами, поэтому алюминий растворяется в водных растворах щелочей, образуя соли — алюминаты:
2Аl + 2NаОН + 2Н20 = 2NаАlO2 + ЗН2
Алюминий широко используется в металлургии для получения металлов — хрома, марганца, ванадия, титана, циркония из их оксидов. Как вы помните, этот способ носит название алюминотермии. На практике часто применяется термит — смесь Fе3O4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты.
Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий.
Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом — разложением расплава его оксида Аl2O3 на составные части с помощью электрического тока. Но температура плавления оксида алюминия около 2050 °С, поэтому для проведения электролиза необходимы большие затраты энергии.
Технически доступным металлом алюминий стал после того, как был найден способ понизить температуру плавления оксида алюминия хотя бы до 1000 °С. Этот способ открыли в 1886 г. американский и французский ученые Ч. Холл и П. Эру, которые установили, что оксид алюминия хорошо растворяется в расплавленном криолите, формула которого Nа3АlF6. Расплав оксида алюминия в криолите подвергают электролизу на алюминиевых заводах.
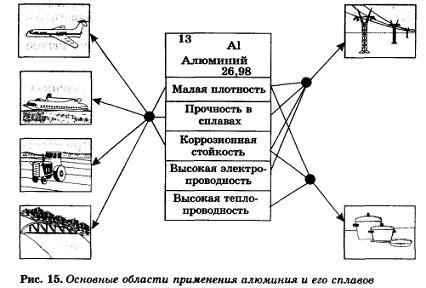
Мировое производство алюминия постоянно растет. Он оттеснил на третье и последующие места медь и другие цветные металлы и стал вторым по значению металлом продолжающегося железного века. Алюминий почти втрое легче стали и устойчив к коррозии, поэтому выгоднее стали в тех областях применения, где требуются эти свойства.
Соединения алюминия. В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает первое место среди металлов и третье — среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет около 9% (по массе).
Укажем важнейшие природные соединения алюминия.
Алюмосиликаты. Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов. Они и составляют основную массу земной коры. В частности, алюмосиликаты входят в состав полевых шпатов — наиболее распространенных минералов и глин.
Боксит — горная порода, из которой получают алюминий. Она содержит оксид алюминия Аl2O3.
Корунд — минерал состава Аl2O3, обладает очень высокой твердостью, его мелкозернистая разновидность, содержащая примеси, — наждак, применяется как абразивный (шлифовочный) материал.
Эту же формулу имеет и другое природное соединение — глинозем.
Хорошо известны прозрачные окрашенные примесями кристаллы корунда: красные — рубины и синие — сапфиры, которые используют как драгоценные камни. В настоящее время их получают искусственно и применяют не только для украшений, но и для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Оксид алюминия Аl2O3 — белое вещество с очень высокой температурой плавления. Может быть получен разложением при нагревании соответствующего ему гидроксида алюминия:
2Аl(ОН)3 = А12O3 + ЗН2O
Гидроксид алюминия Аl(ОН)3 выпадает в виде студенистого осадка при действии щелочей на растворы солей алюминия, например:
АlСl3 + ЗNaОН = Аl(ОН)3 + ЗNaСl
избыток
Как амфотерный гидроксид он легко растворяется в кислотах и в растворах щелочей:
Аl(ОН)3 + ЗНNO3 = Аl(NО3)3 + ЗН20
Алюминатами называют соли неустойчивых алюминиевых кислот — ортоалюминиевой и метаалюминиевой (ее можно рассматривать как ортоалюминиевую кислоту, от молекулы которой отняли молекулу воды). К природным алюминатам относится благородная шпинель (она украшает историческую реликвию — корону российских императоров) и драгоценный хризоберилл.
Соли алюминия, кроме фосфатов, хорошо растворимы в воде. Некоторые соли (сульфиды, сульфиты) разлагаются водой.
Хлорид алюминия АlСl3 применяют в качестве катализатора в производстве очень многих органических веществ.
Открытие алюминия.Алюминий был впервые получен датским физиком X. Эрстедом в 1825 г. Название этого элемента происходит от лат. алюмен, так в древности назывались квасцы, которые использовали для крашения тканей.
1. Строение атома алюминия.
2. Физические и химические свойства алюминия: образование бромида, сульфида, карбида, оксида, алюминатов.
3. Алюминотермия.
4. Получение алюминия электролизом.
5. Области применения алюминия.
6. Природные соединения алюминия: алюмосиликаты (глина и полевые шпаты), корунд (рубин, сапфир, наждак).
7. Амфотерность оксида и гидроксида алюминия.
Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?
Какое соединение алюминия могло послужить материалом для гиперболоида инженера Гарина в романе А. Толстого?
Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
На каких физических и химических свойствах основано применение в технике алюминия и его сплавов?
Напишите в ионном виде уравнения реакций между растворами сульфата алюминия и гидроксида калия при недостатке и избытке последнего.
Напишите уравнения реакций следующих превращений: Аl -> АlСl3 -> Аl(0Н)3 -> Аl2O3 -> NаАl02 -> Аl2(SO4)3 -> Аl(ОН)3 ->АlСl3 ->NаАlO2
Реакции, идущие с участием электролитов, запишите в ионной форме. Первую реакцию рассмотрите как окислительно-восстановительный процесс.
Какой объем водорода может быть получен при растворении в едком натре 270 мг сплава алюминия, содержащего меди? Выход водорода примите равным 85% от тео-ически возможного.
Напишите сочинение на тему «Художественный образ веществаа или химического процесса», используя свои знания по химии алюминия.
графики и таблицы к уроку химии 9 класса, идеальные уроки по химии, программа по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|