|
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Валентные состояния атома углерода
Вы уже знаете, что электронные орбитали характеризуются разными значениями энергии, различной геометрической формой и направленностью в пространстве. Так, 1s-орбиталь обладает более низкой энергией. Затем следует 2s-орбиталь, обладающая более высокой энергией. Обе эти орбитали имеют форму сферы. Естественно, 2s-орбиталь больше 1«-орбитали: большая энергия является следствием большего среднего расстояния между электронами и ядром. Три 2s-орбитали гантелеобраз-ной формы с равной энергией направлены вдоль осей координат. Следовательно, ось каждой 2р-орбитали перпендикулярна осям двух других 2р-орбиталей.
Атомы углерода, входящие в состав органических соединений, будут всегда четырехвалентны, имеют электронную конфигурацию 1s22s22р2 и могут находиться в трех валентных состояниях.
Первое валентное состояние атома углерода рассмотрим на примере молекулы метана СН4.
При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное состояние и имеет четыре неспаренных электрона: один и три р-электрона, которые и участвуют в образовании четырех а-связей с четырьмя атомами водорода. При этом следует ожидать, что три связи С—Н, образованные за счет спаривания трех р-электро-нов атомов углерода с тремя « электронами трех атомов водорода (s—р), должны бы отличаться от четвертой (s—s) связи прочностью, длиной, направлением. Расчет электронной плотности в кристаллах метана показывает, что все связи в его молекуле равноценны и направлены к вершине тетраэдра. Это объясняется тем, что при образовании молекулы метана кова-лентные связи возникают за счет взаимодействия не «чистых», а так называемых гибридных, т. е. усредненных по форме и размерам (а следовательно, и по энергии), орбиталей.
Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии.
Число гибридных орбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов.
В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода будут находиться в состоянии sр3-гибридизации, т. е. у атома углерода гибридизации подверглись орбитали одного s- и трех р-электронов и образовались четыре одинаковые гибридные орбитали.
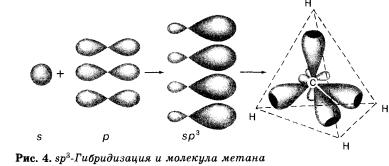
В результате перекрывания четырех гибридных sр3-орбиталей атома углерода и s орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми а-связями под углом 109°28'. Если в молекуле метана заменить один атом водорода на группу СН3, то получится молекула этана СН3—СН3.
Атом углерода, при котором находятся три атома водорода и один атом углерода, называют первичным.
В молекуле этана существует одинарная (ее иногда называют ординарной, обычной) неполярная углерод-углеродная связь длиной 0,154 нм.
В молекуле пропана СН3—СН2—СН3 при центральном атоме углерода находятся два атома водорода и два атома углерода. Такой атом называют вторичным.
Если атом углерода связан с тремя углеродными атомами, то говорят о третичном атоме:
СН3 - СН - СН3
|
CH3
Углерод, при котором находятся четыре атома углерода, называется четвертичным:
CH3
|
СН3 - С - СН3
|
CH3
Второе валентное состояние атома углерода рассмотрим на примере молекулы этилена С2Н4. Как вы помните, в ней между атомами углерода двойная связь, которая отражается в структурной формуле двумя одинаковыми черточками:
СН2=СН2
Связи, отраженные этими черточками, хотя и ковалент-ные, но разные по способу перекрывания — одна из них а, другая —п.
В молекуле этилена каждый атом углерода соединен не с четырьмя, а с тремя другими атомами (с одним атомом углерода и двумя атомами водорода), поэтому в гибридизацию вступают только три электронные орбитали: одна в и две р, т. е. происходит sр2-гибридизация. Эти три орбитали располагаются в одной плоскости под углом 120° по отношению друг к другу. Орбитали каждого атома углерода перекрываются с s-орбиталями двух атомов водорода и с одной такой же sp2-rm6-ридной орбиталью соседнего атома углерода и образуют три а-связи под тем же углом 120°. Следовательно, молекула этилена будет иметь плоскостное строение. Две р-орбитали атомов углерода, которые не участвуют в гибридизации, будут перекрываться в двух областях, перпендикулярных плоскости молекулы («боковое перекрывание»), и образуют п-связь.
Однако «боковое» перекрывание р-орбиталей происходит в меньшей степени, чем р-орбиталей по линии связи, и, кроме этого, оно образуется на большем удалении от ядер связывающихся атомов. Поэтому я-связь будет менее прочной, чем п-связь. И тем не менее под воздействием п-связи атомы углерода еще более сближаются друг с другом: в молекулах метана СН4 и этана С2Н6 расстояние между ядрами атомов (длина связи) составляет 0,154 нм, а в молекулах этилена С2Н4 — 0,134 нм.
Третье валентное состояние атома углерода рассмотрим на примере молекулы ацетилена С2Н2, в которой реализуется тройная связь СН=СН: одна а-связь и две я-связи. Молекула ацетилена имеет линейное строение, так как в ней каждый атом углерода соединен а-связями только с двумя другими атомами — атомом углерода и атомом водорода, при этом происходит вр-гибридизация, в которой участвуют лишь две орби-тали — одна s и одна р. Две гибридные орбитали ориентируются друг относительно друга под углом 180° и образуют две п-связи с s-орбиталью атома водорода и еще одну п-связи, расположенные во взаимно перпендикулярных плоскостях.
Появление третьей связи обусловливает дальнейшее сближение атомов углерода — расстояние между ними (длина С=-С связи) в молекуле ацетилена равно 0,120 нм.
1. Какие типы гибридизации электронных орбиталей атома углерода вы знаете?
2. Порядок соединения атомов в молекулах отражают структурные формулы. Определите тип гибридизации каждого атома углерода в молекуле бутадиена-1,2, если его структурная формула
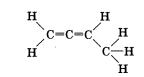
3. Сколько орбиталей второго энергетического уровня атома углерода не участвует в яр-гибридизации; в яр2-гибриди-зации; в яр3-гибридизации?
4. Чему равны углы между осями углеродного атома для:
а) sр2-гибридных орбиталей;
б) sр-гибридных орбиталей;
в) sр-гибридной и негибридной р-орбиталей;
г) негибридных р-орбиталей;
д) sр3-гибридных орбиталей?
акселеративные методы по химии 10 класса, кейсы по химии, фотографии для всех классов
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












