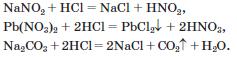|
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Взаємодія амоніаку та хлороводню з водою. Солі амонію. Якісна реакція на йони амонію та хлорид-іони Як це можна пояснити? У воді концентрації йонів Гідрогену Н+ і гідроксид-іонів ОН- — однакові: H2O ⇔ H+ + OH- , тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH3 у воді концентрація гідроксид-іонів ОН- збільшується, отже, утворюється лужне середовище, і фенолфталеїн стає малиновим. Виникнення лужного середовища пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NH+4. NH3 + H+ → NH4
При цьому вивільнюються з води гідроксид-іони ОН- , що й надає розчину лужної реакції. Кожний йон амонію NH+4 має чотири ковалентні зв'язки. Три з них юються за рахунок трьох неспарених електронів, які є на р-орбіталях зовнішнього електронного шару атома Нітрогену. Четвертий зв'язок утворюється за донорно-акцепторним механізмом між атомом Нітрогену аміаку (донор) та йоном гідрогену (акцептор): Н Н + l І Н — N: + Н+ → Н — N — Н І І
Взаємодія аміаку з водою відбувається за рівнянням: NH3 + Н20 ⇔ NH3 • Н20⇔ NH+4 + ОН-
Але в розчині лише невелика частина молекул NH3 перетворюється на йони амонію NH+4. Тому аміачна вода пахне аміаком. Аміачну воду позначають формулою NH3 • Н20 і називають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ: NH3 • Н20 ⇔ NH+4 + ОН- NH3 • Н20⇔ NH3↑ + Н20
2. Взаємодія з кислотами. Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу — концентрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим — дрібні кристалики хлориду амонію (нашатирю): NH3 + НСl = NH4Cl Отже, аміак, взаємодіючи з кислотами, утворює солі амонію: Напишіть рівняння реакцій між аміаком і: а) нітратною, б) сульфатною кислотами. Які солі амонію при цьому утворюються? Добування. У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH4Cl і гашеного вапна Са(ОH)2 за рівнянням: 2NH4Cl + Са(ОН)2 = CaCl2+2NH3↑ + 2Н20 . Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном? Застосування. Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках. У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
Фізичні властивостіФiзичні й хімічні властивості речовини.. Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
Хімічні властивостіФiзичні й хімічні властивості речовини.. 1. Дисоціація на йони. Як сильні електроліти солі амонію у водному розчині добре дисоціюють на йони: (NH4)2S04 ⇔2NH+4 + SO2-4 2. Взаємодія з іншими солями. Якщо в пробірку з розчином хлориду амонію долити розчин нітрату аргентуму, то випадає сирнистий (схожий на зсіле молоко) білий осад: NH4Cl + AgN03 = NH4N03+ AgCl↓ Ви переконалися, що солі амонію вступають у реакцію йонного обміну з іншими солями. Напишіть наведене рівняння у повній і скороченій йонних формах. Пригадайте, яких умов треба додержувати, щоб реакція обміну між двома солями відбулася до кінця, тобто практично була б необоротною. Чи витримані такі умови у даному разі?
3. Взаємодія з лугами. В результаті взаємодії солей амонію з лугами утворюється аміак, через що дану реакцій використовують як якісну на солі амонію: NH4Cl + NaOH = NaCl + NH3↑ + H20 Виділення аміаку NH3 —характерна ознака для розпізнавання солей амонію.
Лабораторна робота З Виявлення йонів амонію в розчині Налийте в пробірку 2 мл розчину сульфату амонію і добавте до нього стільки ж розчину гідроксиду натрію. Нагрійте рідину в пробірці до кипіння й обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки червоний лакмусовий папірець, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції. Отже, якісною реакцією на солі амонію є дія лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посинінням червоного вологого лакмусового папірця.
Доведіть за допомогою йонного рівняння, що гідроксид-іони ОН- є реактивом на йони амонію NH+4.
4. Розклад під час нагрівання: нагрівання NH4C ----------> NH3 + HCl <----------- NH3 + HN03 = NH4N03
Лабораторна робота 4 Утворення солей амонію Як пояснити утворення диму? Дослід повторіть, узявши замість хлоридної концентровану нітратну кислоту. Напишіть рівняння проведених реакцій.
Застосування. Нітрат амонію NH4N03 і сульфат амонію (NH4)2S04 використовують головним чином як добрива. Нітрат амонію NH4N03 (в суміші з алюмінієм і вугіллям) застосовують для виготовлення вибухової речовини — амоналу. Хлорид амонію NH4Cl під назвою «нашатир» використовують у процесі паяння для очищення поверхні паяльника.
Коли нагрітий паяльник занурюють у нашатир NH4Сl, то сіль розкладається (див. вище). Утворений хлороводень НСl взаємодіє з оксидом купруму (II) CuO, що вкриває поверхню паяльника, внаслідок чого з'являється хлорид купруму(II) СuСl2, який сплавляється з надлишком нашатирю NH4Cl. В результаті поверхня паяльника звільняється від оксидів, і розплавлене олово прилипає до очищеної міді. N2 + ЗН2 ⇔ 2NH3, ΔH = -92 кДж. 4 моль 2 моль
Звернімося до ршняння реакції. Що з нього видно?
Ми бачимо, що: 1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага; 2) реакція відбувається між газами із зменшенням об'єму; 3) реакція екзотермічна, відбувається з виділенням теплоти. Як же керувати такою реакцією, пам'ятаючи, що виробництво аміаку має бути економічно вигідним?
Згадаємо теорію, а саме — принцип Ле Шательє: якщо система перебуває у стані рівноваги, то в процесі дії на неї сил, що викликають зсув рівноваги, система переходить у такий стан, в якому ефект цього впливу послаблюється.
Виходячи з принципу Ле Шательє, розмірковуємо так: реакція екзотермічна, то треба знизити температуру, щоб аміак не розклався. Але із зниженням температури швидкість реакції зменшиться. Це нібито не страшно, бо можна використати каталізатор. Проте відомо, що каталізатор виявляє свою активність лише із нагріванням до певної температури. Отже, знижувати температуру можна, але тільки до певної межі.
Далі звертаємо увагу, що реакція між газами відбувається меншенням об'єму. Це означає, що рівновага зміщуватиметься у бік утворення аміаку за умови підвищеного тиску. Проте навіть за дуже високого тиску зв'язати весь азот і водень не вдається, а застосування високих тисків спричинює збільшення вартості обладнання і збільшення витрат енергії на стиснення газової суміші.
Виходячи з обговорення умов процесу, робимо висновок, що для синтезу аміаку треба:
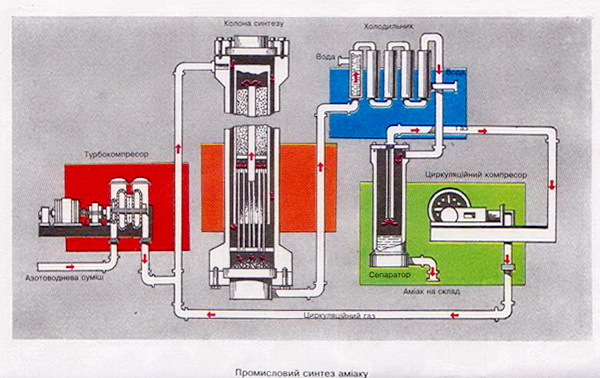
Такі умови вважаються оптимальними для економічно доцільного синтезу аміаку. Реакція відбувається в колоні синтезу(див. вклейку).
Колона синтезу складається з теплообмінника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутрішній діаметр корпусу колони. Отже, між каталізаторною коробкою і корпусом утворюється щілина. Холодна суміш азоту з воднем надходить у колону через цю щілину і запобігає перегріванню корпусу. Газова суміш іде донизу, проходить між гарячими трубками теплообмінника, нагризається і потрапляє до каталізаторної коробки. Тут, на каталізаторі, відбувається синтез аміаку. При цьому виділяється багато теплоти. Гаряча суміш аміаку, азоту й водню надходить у трубки теплообмінника, тому вони гарячі. Відбувається теплообмін, теплота реакції утилізується — це один з важливих принципів сучасного виробництва.
Газ, що виходить з колони синтезу, містить 12—15 % аміаку. В такому разі не зрозуміло, чому синтез вважається економічно доцільним. Річ у тім, що далі в процесі виробництва використовують принцип циркуляції, за яким азот і водень, що не прореагували, відокремлюються від зрідженого аміаку і знову повертаються в колону синтезу. Завдяки принципу циркуляції на сучасних заводах вихід аміаку становить 96—98 %.
В Україні перший завод з виробництва синтетичною аміаку став до ладу у 1933 р. в Горлівці Донецької області. Пізнше з'явилися заводи у Дніпродзержинську (1938), Сіверськодонецьку (1958), Черкасах (1962), Рівному (1965) тощо. Нині триває робота з дальшого вдосконалення технології аміачного виробництва.
Завдання для самоконтролю
На атомі Хлору зосереджується невеликий негативний заряд, а на атомі Гідрогену — такий самий за значенням, але позитивний заряд:
Поясніть, чому і як молекула НС1 розпадається на йони у водному розчині.
Для трьох останніх реакцій складіть йонно-молекулярні рівняння.
Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою: Чи можна замість твердої солі використати її водний розчин, а замість концентрованої кислоти — розбавлену? Відповідь аргументуйте.
Зміст уроку Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: