|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Загальні способи добування оксидів, їх використання. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуОсновні способи добування оксидівОксиди - сполуки атомів двох елементів, один з яких кисень в ступені окислення -2. Щоб згадати що, власне, являють собою оксиди, пропонуємо вам переглянути наступне відео. Відео 1. Оксиди.
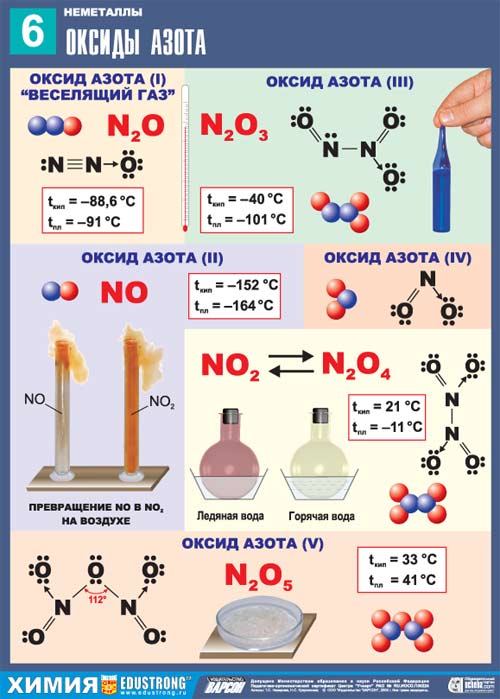
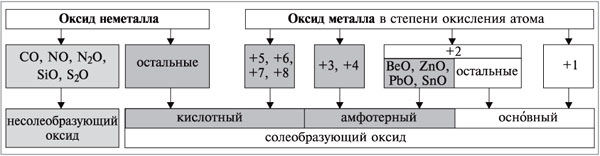
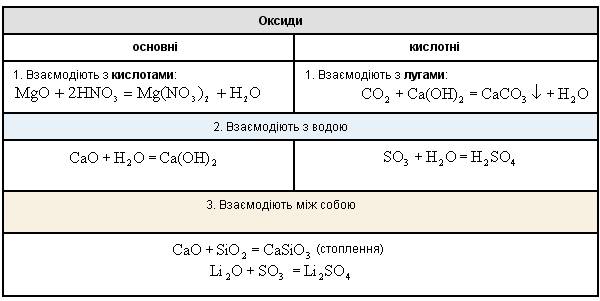
За хімічними властивостями оксиди поділяються на солетворні (утворюють солі при взаємодії з кислотами і/або лугами) і несолетворні (не утворюють солей, байдужі до кислот і лугів; до них відносяться СO, NO, N2O, SiO, S2O). Мал. 1. Оксиди азоту. Солетворні оксиди поділяють на основні, кислотні і амфотерні в залежності від типу відповідного гідроксиду. Kислотно-основні властивості родинних оксидів і гідроксидів (Na2O і NaOH, SO3 і H2SO4) співпадають. Основними називають оксиди, яким відповідають гідроксиди - основи. Кислотними називають оксиди, яким відповідають гідроксиди - кислоти. Як кислотні оксиди взаємодіють з водою ви можете спостерігати при перегляді наступного відео. Відео 2. Взаємодія кислотних оксидів з водою.
Амфотерними називають оксиди, яким відповідають амфотерні гідроксиди. Неметали утворюють тільки кислотні та несолетворні оксиди; метали утворюють всі основні, всі амфотерні та деякі кислотні оксиди. Багато металів побічних підгруп, які мають у сполуках змінну кількість атомів, можуть утворювати кілька оксидів і гідроксидів, характер яких залежить від кількості атомів елемента. Зі зростанням ступеня окиснення атома елемента його електронегативність зростає. Відповідно ростуть неметалічні властивості елемента, а також кислотні властивості його оксиду та гідроксиду. Оксиди металів зі ступенем окиснення атому +1 (Na2O, K2O та ін), а також більшість оксидів металів у ступені окиснення атому +2 (FeO, MgO тощо) є основними. Винятки: BeO, ZnO, PbO, SnO - амфотерні. Більшість оксидів металів зі ступенем окиснення атомів +3 і +4 - амфотерні (Al2O3, Cr2O3, Fe2O3, SnO2, PbO2 та ін.) Оксиди металів зі ступенем окиснення атомів +5, +6, +7, +8 - кислотні (Mn2O7, CrO3, Sb2O5 та ін). Мал. 2. Характеристика оксидів за ступенем окиснення. Основними способами добування оксидів є наступні: 1. Безпосереднє сполучення простої речовини з киснем (за різних умов), наприклад: 2. Горіння складних речовин, наприклад: 3. Розклад під час нагрівання оксигеновмісних сполук: карбонатів, нітратів, гідроксидів, наприклад: Мал. 3. Хімічні властивості оксидів. Контролюючий блок 1
Використання оксидів у повсякденному житті
Зокрема, оксид алюмінію – використовуються для виробництва алюмінію, власне, він є основним вихідним матеріалом для цього. Також він використовується для виробництва кераміки, різноманітного скла, для захисту металів від пагубного впливу навколишнього середовища (у якості нанесеного покриття). Оксид магнію використовують для виробництві цементів, вогнетривів, очистки нафтопродуктів, гуми. А в медицині його використовують підвищеній кислотності шлункового соку. У харчовій промисловості використовують як харчову добавку. Оксид кальцію широко використовують у будівельній справі, у хімічній промисловості (для отримання хлорного вапна). У будівництві застосовують гашене вапно - гідроксид кальцію. Для цього негашене вапно обробляють водою. Тоді пористі куски оксиду кальцію (негашеного вапна) поглинають воду і вступають з нею в реакцію з подальшим виділенням значної кількості тепла. Внаслідок цієї реакції частина води випаровує, а оксид кальцію перетворюється у пухку масу гідроксиду кальцію (гашеного Пропонуємо вам переглянути наступне відео, щоб виявити хімічні та фізичні властивості оксиду кальцію при взаємодії з водою. Відео 3. Взаємодія оксиду кальцію з водою.
Контролюючий блок 2
Домашнє завдання
Цікаво знати, що…У велику і широку пробірку насипають 2-3 г дрібно розтертого калій перманганату і закріплюють пробірку в штативі отвором догори. Обережно по стінці пробірки або піпеткою вливають у сіль 1-2 мл концентрованої H2SO4. З промокального або фільтрувального паперу виготовляють невеличкі кульки і з деякими інтервалами вкидають їх у пробірку. Паперові кульки при цьому з тріском спалахують, а з пробірки вилітає «вулканічний попіл» - бурий MnO2, або, точніше, MnO(OH)2 - продукт відновлення манган (VII) оксиду клітковиною паперу: 2KMnO4 + 2H2SO4 = 2KHSO4 + (2HMnO4) Явище дуже ефектне. Замість паперової кульки в пробірку з KMnO4 і H2SO4 можна вкинути ватний тампон або муху. Список використаних джерел1. Урок на тему «Оксиди та їх місце у нашому житті» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Малова О.М. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: