|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов Каждый период системы элементов Д. И. Менделеева заканчивается инертным газом.
Самым распространенным из инертных (благородных) газов в атмосфере Земли является аргон, который удалось выделить в чистом виде раньше других аналогов. В чем причина инертности гелия, неона, аргона, криптона, ксенона и радона? В том, что у атомов инертных газов на внешних, самых удаленных от ядра уровнях находится восемь электронов (у гелия — два). Восемь электронов иа инешнем уровне — предельное число для каждого элемента Периодической системы, кроме водорода и гелия. Это своеобразный идеал прочности энергетического уровня, к которому стремятся атомы всех остальных элементов Периодической системы.
Добиваться такого положения электронов атомы могут двумя нутями: отдавая электроны с внешнего уровня (в этом случае внешний незавершенный уровень исчезает, а предпоследний, который был завершен в предыдущем периоде, становится внешним) или принимая электроны, которых не хватает до заветной восьмерки. Атомы, имеющие ни внешнем уровне меньшее число электронов, отдают их атомам, у которых на внешнем уровне больше электронов. Легко отдать один электрон, когда он единственный на внешнем уровне, атомам элементов главной подгруппы I группы. Труднее отдавать два электрона, например, атомям элементов главной подгруппы II группы. Еще труднее отдавать свои три внешних электрона атомам элементов III группы. Тенденцию к отдаче электронов с внешнего уровня имеют атомы металлов. И чем легче атомы элемента-металла отдают свои внешние электроны, тем в большей степени выражены у него металлические свойства. Понятно поэтому, что наиболее типичными металлами в Периодической системе являются элементы главной подгруппы I группы. Из сказанного можно сделать следующий вывод.
В пределах периода с ростом заряда атомного ядра, а соответственно, и с ростом числа внешних злектронов металлические свойства химических элементов уменьшаются. Неметаллические свойства, характеризующиеся легкостью принятия электронов на внешний уровень, при этом усиливаются.
Наиболее типичными неметаллами являются элементы главной подгруппы VII группы. На внешнем уровне атомов этих элементов находятся семь электронов. До восьми электронов на внешнем уровне, то есть до устойчивого состояния атомов им нс хватает по одному электрону. Они легко их присоединяют, проявляя неметаллические свойства.
А как ведут себя атомы элементов главной подгруппы IV группы? Ведь у них на внешнем уровне четыре электрона и им. казалось бы. все равно, отдать или принять четыре электрона. Выяснилось, что на способность атомов отдавать или принимать электроны оказывает влияние не только число электронов на внешнем уровне, но и такал важная характеристика атома, как его радиус. В пределах периода число энергетических уровней у атомов химических элементов не меняется, оно одинаково, а вот радиус уменьшается, так как растет положительный заряд ядра (число протонов в нем). Вследствие этого притяжение электронов к ядру усиливается, и радиус атома уменьшается, атом как бы сжимается. Поэтому становится все труднее отдать внешние электроны и, наоборот, все легче принять недостающие до восьми электроны.
В пределах одной и той же подгруппы радиус атома растет с увеличением заряда атомного ядра, так как при постоянном числе электронов на внешнем уровне (он равен номеру группы) растет число энергетических уровней (оно равно номеру периода). Поэтому атому становится все легче отдать внешние электроны.
В пределах одного и того же периода металлические свойства уменьшаются, а номстлл лические —увеличиваются, так как:
а) увеличиваются заряды атомных ядер;
б) растет число электронов на внешнем уровне
В Периодической системе с ростом порядкового номера свойства атомов химических элементов меняются следующим образом:
В пределах одной и той же группы (в главной подгруппе) металлические свойства увеличиваются, неметаллические — уменьшаются, так как:
а) увеличиваются заряды атомных ядер;
б) число электронов на внешнем уровне постоянно растет;
в) число энергетических уровней уменьшается; в) число энергетических уровней постоянно увеличивается ;
г) радиус атома увеличивается г) радиус атома уменьшается,
Каков же результат «принятия - отдачи» электронов атомами химических элементов?
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного отрицательного заряда, станет положительно заряженной частичкой, а второй превратится в отрицательно заряженную частичку благодаря полученному электрону. Такие частички называют ионами.
Оба атома осуществят свою «заветную мечту» - получат столь желанную восьмерку электронов на внешнем уровне. Но какой ценой? Разноименно заряженные ионы в полном соответствии с законом притяжения противоположных зарядов тут же соединятся, то есть между ними возникнет химическая связь.
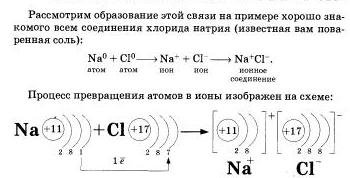
Химическая связь, возникающая между ионами, и называется ионной.
В заключение рассмотрим алгоритм (последовательность) рассуждений при записи схемы образования ионной связи, например можду атомами кальция и хлора.
1. Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:

Назовите самый типичный металл и самый типичный неметалл Периодической системы
Пользуясь дополнительной литературой, объясните, почему инертные газы стали называть благородными.
Насколько химически верно следующее литературное выражение: "Улицы ночного города были залиты неоном"?

информация для учителей 8 класса, материал для подготовки урока химии, проверка знаний
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












