|
|
|
| Строка 1: |
Строка 1: |
| | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Физика и астрономия, Физика, 11 класс, урок, на Тему, Изотопы</metakeywords> | | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Физика и астрономия, Физика, 11 класс, урок, на Тему, Изотопы</metakeywords> |
| | | | |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 11 класс|Физика 11 класс]]>> Изотопы''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 11 класс|Физика 11 класс]]>> Изотопы''' <br> <br> |
| - | <br> | + | |
| - | <br> | + | |
| | | | |
| | <br> | | <br> |
| | | | |
| - | ''' § 102 ИЗОТОПЫ'''<br><br>Изучение явления радиоактивности привело к важному открытию: была выяснена природа атомных ядер. | + | ''' § 102 ИЗОТОПЫ'''<br><br>Изучение явления [[Открытие_радиоактивности|радиоактивности]] привело к важному открытию: была выяснена природа атомных ядер. |
| | | | |
| - | В результате наблюдения огромного числа радиоактивных превращений постепенно обнаружилось, что существуют вещества, тождественные по своим химическим свойствам, но имеющие совершенно различные радиоактивные свойства (т. е. распадающиеся по-разному). Их никак не удавалось разделить ни одним из известных химических способов. На этом основании Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но различающихся, в частности, своей радиоактивностью. Эти элементы нужно помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал их изотопами (т. е. занимающими одинаковые места).<br> | + | В результате наблюдения огромного числа радиоактивных превращений постепенно обнаружилось, что существуют вещества, тождественные по своим химическим свойствам, но имеющие совершенно различные радиоактивные свойства (т. е. распадающиеся по-разному). Их никак не удавалось разделить ни одним из известных химических способов. На этом основании Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но различающихся, в частности, своей радиоактивностью. Эти элементы нужно помещать в одну и ту же клетку периодической системы Д. И. [[Периодическая_система_химических_элементов_Д._И._Менделеева._Знаки_химических_элементов|Менделеева]]. Содди назвал их изотопами (т. е. занимающими одинаковые места).<br> |
| | | | |
| - | Предположение Содди получило блестящее подтверждение и глубокое толкование год спустя, когда Дж. Дж. Томсон провел точные измерения массы ионов неона методом отклонения их в электричеелсом и магнитном полях. Он обнаружил, что неон представляет собой смесь двух видов атомов. Большая часть их имеет относительную массу, равную 20. Но существует незначительная часть атомов с относительной атомной массой 22. В результате относительная атомная масса смеси была принята равной 20,2. Атомы, обладающие одними и теми же химическими свойствами, различались массой. Оба вида атомов неона, естественно, занимают одно и то же место в таблице Д. И. Менделеева и, следовательно, являются изотопами. Таким образом, изотопы могут различаться не только своими радиоактивными свойствами, но и массой. Именно поэтому у изотопов заряды атомных ядер одинаковы, а значит, число электронов и оболочках атомов и, следовательно, химические свойства изотопов одинаковы. Но массы ядер различны. Причем ядра могут быть как радиоактивными, так и стабильными. Различие свойств радиоактивных изотопов связано с тем, что их ядра имеют различную массу.<br> | + | Предположение Содди получило блестящее подтверждение и глубокое толкование год спустя, когда Дж. Дж. Томсон провел точные измерения массы ионов неона методом отклонения их в электричеелсом и [[Действие_магнитного_поля_на_движущийся_заряд._Сила_Лоренца|магнитном]] полях. Он обнаружил, что неон представляет собой смесь двух видов атомов. Большая часть их имеет относительную массу, равную 20. Но существует незначительная часть атомов с относительной атомной массой 22. В результате относительная атомная масса смеси была принята равной 20,2. Атомы, обладающие одними и теми же химическими свойствами, различались массой. Оба вида атомов неона, естественно, занимают одно и то же место в таблице Д. И. Менделеева и, следовательно, являются [[Изотопы|изотопами]]. Таким образом, изотопы могут различаться не только своими радиоактивными свойствами, но и массой. Именно поэтому у изотопов заряды атомных ядер одинаковы, а значит, число электронов и оболочках атомов и, следовательно, химические свойства изотопов одинаковы. Но массы ядер различны. Причем ядра могут быть как радиоактивными, так и стабильными. Различие свойств радиоактивных изотопов связано с тем, что их ядра имеют различную массу.<br> |
| | | | |
| - | В настоящее время установлено существование изотопов у всех химических элементов. Некоторые элементы имеют только нестабильные (т.е. радиоактивные) изотопы. Изотопы есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).<br> | + | В настоящее время установлено существование изотопов у всех химических элементов. Некоторые элементы имеют только нестабильные (т.е. радиоактивные) изотопы. Изотопы есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).<br> |
| | | | |
| - | Особенно интересны изотопы водорода, так как они различаются по массе в 2 и 3 раза. Изотоп с относительной атомной массой 2 называется дейтерием. Он стабилен (т. е. не радиоактивен) и входит в качестве небольпюй примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется так называемая тяжелая вода. Ее физические свойства заметно отличаются от свойств обычной воды. При нормальном атмосферном давлении она кипит при 101,2 °С и замерзает при 3,8 °С. | + | Особенно интересны изотопы водорода, так как они различаются по массе в 2 и 3 раза. Изотоп с относительной атомной массой 2 называется дейтерием. Он стабилен (т. е. не радиоактивен) и входит в качестве небольпюй примеси (1 : 4500) в обычный [[Квантовые_постулаты_Бора._Модель_атома_водорода_по_Бору|водород]]. При соединении дейтерия с кислородом образуется так называемая тяжелая вода. Ее физические свойства заметно отличаются от свойств обычной воды. При нормальном атмосферном давлении она кипит при 101,2 °С и замерзает при 3,8 °С. |
| | | | |
| - | Изотоп водорода с атомной массой 3 называется тритием. Он [[Image:7.02-42.jpg]]-радиоактивен, и его период полураспада около 12 лет. | + | Изотоп водорода с атомной массой 3 называется тритием. Он [[Image:7.02-42.jpg]]-радиоактивен, и его период полураспада около 12 лет. |
| | | | |
| - | Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева. | + | Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева. |
| | | | |
| - | Примечательно, что при точном измерении относительных атомных масс изотопов выяснилось, что они близки к целым числам. А вот атомные массы химических элементов иногда сильно отличаются от целых чисел. Так, относительная атомная масса хлора равна 35,5. Это значит, что в естественном состоянии химически чистое вещество представляет собой смесь изотопов в различных пропорциях. Целочисленность (приближенная) относительных атомных масс изотопов очень важна для выяснения строения атомного ядра. | + | Примечательно, что при точном измерении относительных атомных масс изотопов выяснилось, что они близки к целым числам. А вот атомные массы химических элементов иногда сильно отличаются от целых чисел. Так, относительная атомная масса хлора равна 35,5. Это значит, что в естественном состоянии химически чистое вещество представляет собой смесь изотопов в различных пропорциях. Целочисленность (приближенная) относительных атомных масс изотопов очень важна для выяснения строения атомного ядра. |
| | | | |
| - | Все химические элементы имеют изотопы. Заряды атомных ядер изотопов одинаковы, но массы ядер различны.<br> | + | Все химические элементы имеют изотопы. Заряды атомных ядер изотопов одинаковы, но массы ядер различны.<br> |
| | | | |
| - | [[Image:7.02-1.jpg]]<br>Существуют ли изотопы у бария, относительная атомная масса которого 137,34!<br><br><br><br><br> | + | [[Image:7.02-1.jpg]]<br>Существуют ли изотопы у бария, относительная атомная масса которого 137,34!<br><br><br><br><br> |
| | | | |
| - | <br> ''Мякишев Г. Я., Физика. 11 класс : учеб. для общеобразоват. учреждений : базовый и профил. уровни / Г. Я. Мякишев, Б. В. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. — 17-е изд., перераб. и доп. — М. : Просвещение, 2008. — 399 с : ил.'' | + | <br> ''Мякишев Г. Я., [[Физика_и_астрономия|Физика]]. 11 класс : учеб. для общеобразоват. учреждений : базовый и профил. уровни / Г. Я. Мякишев, Б. В. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. — 17-е изд., перераб. и доп. — М. : Просвещение, 2008. — 399 с : ил.'' |
| | | | |
| | <br> <sub>Полный перечень тем по классам, календарный план согласно школьной программе по физике [[Гипермаркет знаний - первый в мире!|онлайн]], видеоматериал по физике для 11 класса [[Физика и астрономия|скачать]]</sub> | | <br> <sub>Полный перечень тем по классам, календарный план согласно школьной программе по физике [[Гипермаркет знаний - первый в мире!|онлайн]], видеоматериал по физике для 11 класса [[Физика и астрономия|скачать]]</sub> |
| Строка 47: |
Строка 45: |
| | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы | | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников | | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' | | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| Строка 69: |
Строка 67: |
| | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке | | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми | | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' | | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
Текущая версия на 06:11, 4 июля 2012
Гипермаркет знаний>>Физика и астрономия>>Физика 11 класс>> Изотопы
§ 102 ИЗОТОПЫ
Изучение явления радиоактивности привело к важному открытию: была выяснена природа атомных ядер.
В результате наблюдения огромного числа радиоактивных превращений постепенно обнаружилось, что существуют вещества, тождественные по своим химическим свойствам, но имеющие совершенно различные радиоактивные свойства (т. е. распадающиеся по-разному). Их никак не удавалось разделить ни одним из известных химических способов. На этом основании Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но различающихся, в частности, своей радиоактивностью. Эти элементы нужно помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал их изотопами (т. е. занимающими одинаковые места).
Предположение Содди получило блестящее подтверждение и глубокое толкование год спустя, когда Дж. Дж. Томсон провел точные измерения массы ионов неона методом отклонения их в электричеелсом и магнитном полях. Он обнаружил, что неон представляет собой смесь двух видов атомов. Большая часть их имеет относительную массу, равную 20. Но существует незначительная часть атомов с относительной атомной массой 22. В результате относительная атомная масса смеси была принята равной 20,2. Атомы, обладающие одними и теми же химическими свойствами, различались массой. Оба вида атомов неона, естественно, занимают одно и то же место в таблице Д. И. Менделеева и, следовательно, являются изотопами. Таким образом, изотопы могут различаться не только своими радиоактивными свойствами, но и массой. Именно поэтому у изотопов заряды атомных ядер одинаковы, а значит, число электронов и оболочках атомов и, следовательно, химические свойства изотопов одинаковы. Но массы ядер различны. Причем ядра могут быть как радиоактивными, так и стабильными. Различие свойств радиоактивных изотопов связано с тем, что их ядра имеют различную массу.
В настоящее время установлено существование изотопов у всех химических элементов. Некоторые элементы имеют только нестабильные (т.е. радиоактивные) изотопы. Изотопы есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Особенно интересны изотопы водорода, так как они различаются по массе в 2 и 3 раза. Изотоп с относительной атомной массой 2 называется дейтерием. Он стабилен (т. е. не радиоактивен) и входит в качестве небольпюй примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется так называемая тяжелая вода. Ее физические свойства заметно отличаются от свойств обычной воды. При нормальном атмосферном давлении она кипит при 101,2 °С и замерзает при 3,8 °С.
Изотоп водорода с атомной массой 3 называется тритием. Он 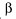 -радиоактивен, и его период полураспада около 12 лет. -радиоактивен, и его период полураспада около 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Примечательно, что при точном измерении относительных атомных масс изотопов выяснилось, что они близки к целым числам. А вот атомные массы химических элементов иногда сильно отличаются от целых чисел. Так, относительная атомная масса хлора равна 35,5. Это значит, что в естественном состоянии химически чистое вещество представляет собой смесь изотопов в различных пропорциях. Целочисленность (приближенная) относительных атомных масс изотопов очень важна для выяснения строения атомного ядра.
Все химические элементы имеют изотопы. Заряды атомных ядер изотопов одинаковы, но массы ядер различны.

Существуют ли изотопы у бария, относительная атомная масса которого 137,34!
Мякишев Г. Я., Физика. 11 класс : учеб. для общеобразоват. учреждений : базовый и профил. уровни / Г. Я. Мякишев, Б. В. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. — 17-е изд., перераб. и доп. — М. : Просвещение, 2008. — 399 с : ил.
Полный перечень тем по классам, календарный план согласно школьной программе по физике онлайн, видеоматериал по физике для 11 класса скачать
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










